直链烷基苯磺酸钠暴露对雄性小鼠的生殖毒性
2019-09-10王琦刘小强李丹任春娥刘维琴
王琦 刘小强 李丹 任春娥 刘维琴
[摘要] 目的 探讨直链烷基苯磺酸钠(LAS)对小鼠睾丸的损伤作用及其可能的机制。方法 将24只3周龄ICR种雄性小鼠随机分为对照组和低、中、高剂量LAS染毒组(每组6只小鼠),4组分别给予生理盐水、LAS 210 mg/kg、LAS 420 mg/kg和LAS 630 mg/kg连续灌胃30 d,每天1次。处死小鼠,收集血清,放射免疫法测定血清中睾酮浓度;分离睾丸和附睾组织,计数精子密度,光镜观察睾丸组织形态学变化,实时荧光定量PCR检测睾丸组织中甾体激素合成限速酶基因Star、Cyp11a1、Cyp17a1和Hsd3b2 mRNA的表达。结果 LAS染毒各剂量组小鼠睾丸和附睾脏器系数、精子密度均较对照组降低(F=77.619~375.293,P<0.05)。光镜观察显示,与对照组比较,LAS染毒高剂量组睾丸组织生精小管内生精细胞排列稀疏,细胞层数减少,精原细胞坏死凝集,间质细胞皱缩,支持细胞数量明显减少。LAS染毒中、高剂量组睾酮浓度较对照组下降,差异有统计学意义(F=25.574,P<0.05)。LAS染毒各剂量组睾酮合成相关限速酶基因Star、Cyp11a1、Cyp17a1、Hsd3b2 mRNA表达水平均较对照组下降,并且与LAS剂量正相关,差异有显著性(F=5.578~15.796,P<0.05)。结论 LAS能够损害小鼠睾丸形态结构,造成生精功能下降;并通过抑制Star、Cyp11a1、Cyp17a1、Hsd3b2等甾体激素合成限速酶基因的表達,减少睾酮的合成。
[关键词] 直链烷基苯磺酸钠;睾丸;睾酮;甾体激素合成限速酶基因
[中图分类号] R339.2 [文献标志码] A [文章编号] 2096-5532(2019)04-0437-05
[ABSTRACT] Objective To investigate the effect of linear alkylbenzene sulfonate (LAS) in testicular injury in mice and its possible mechanisms. Methods Twenty-four 3-week-old male ICR mice were randomly divided into control group and low-, medium-, and high-LAS dose groups (6 mice in each group). Four groups were given saline, LAS 210 mg/kg, LAS 420 mg/kg, and LAS 630 mg/kg, respectively, for 30 d, once a day. The mice were sacrificed and serum samples were collected. The testoste-rone concentration in serum was determined by radioimmunoassay; the testis and epididymis tissues were isolated, and the sperm density was determined. The morphology of the testis was observed by light microscopy, and the mRNA expression of steroid hormone synthesis rate-limiting enzyme genes including Star, Cyp11a1, Cyp17a1, and Hsd3b2 in the testis tissue was detected by quantitative real-time PCR. Results The organ coefficients of testis and epididymis and sperm density were lower in the LAS exposure groups than in the control group (F=77.619-375.293,P<0.05). Light microscopy showed that compared with the control group, the high-LAS dose group had sparsely arranged spermatogenic cells in the seminiferous tubules, a reduced number of cell layers, necrotic and aggregated spermatogonia, shrunken interstitial cells, and a significantly reduced number of Sertoli cells. The medium-and high-LAS dose groups showed a significant reduction in testosterone concentration compared with the control group (F=25.574,P<0.05). The mRNA expression levels Star, Cyp11a1, Cyp17a1, and Hsd3b2 were down-regulated in the me-dium- and high-LAS dose groups than in the control group, and were positively correlated with LAS dose (F=5.578-15.796,P<0.05). Conclusion LAS can damage the morphological structure of the testis and impair the spermatogenic function of mice, and it can reduce the synthesis of testosterone by inhibiting the expression of steroid hormone synthesis rate-limiting enzyme genes such as Star, Cyp11a1, Cyp17a1, and Hsd3b2.
[KEY WORDS] linearalkylbenzenesulfonate; testis; testosterone; steroidogenic enzymes
随着工业化和城市化建设速度的加快,环境因素对生殖健康的影响日趋严重[1]。环境污染可损伤生殖细胞染色体,引起胚胎源性疾病,对子代的生殖毒性包括子代生长发育缓慢、发育畸形、器官功能不全、胚胎停育、流产等[2]。表面活性剂是一种人工合成的化学洗涤剂,因其具有易溶于水并且去污力强特性而广泛应用于人类的生产和日常生活中。直链烷基苯磺酸钠(LAS)是化学洗涤剂最主要的有效成分[3]。LAS几乎在所有的环境介质中都能检测到。LAS可通过与人体皮肤直接接触、餐具和蔬菜水果残留等消化道方式进入人体,剂量通常非常小,一般认为不会产生明显的毒性反应。但是由于LAS成分中含有化学性质稳定的剧毒物苯,其含量虽低,却很难降解和消除,导致LAS长久而持续地污染环境,因此LAS长期蓄积产生的毒性已经引起人们广泛关注。目前,对LAS生殖毒性的研究多集中于水生生物[4-6],对哺乳动物生殖毒性的研究较少且多集中在形态学方面[7]。本课题组前期研究发现,LAS口饲染毒可以影响雌性小鼠卵巢类固醇激素合成[8]。本研究研究LAS对小鼠睾丸形态、睾酮合成以及相关限速酶基因的影響,探讨LAS对雄性小鼠的生殖毒性及其机制。现将结果报告如下。
1 材料与方法
1.1 实验材料
清洁级3周龄健康ICR种雄性小鼠24只,体质量8~11 g,由南京大学模式动物所提供。LAS(天津市鼎盛鑫化工有限公司,CAS:25155-30-0),DMEM 高糖培养液(HyClone),Premix Taq Version 2.0(TaKaRa),I125睾酮放免分析试剂盒(北京北方生物技术研究所),StepOne Plus Real-Time PCR仪(Applied Biosystems)。
1.2 动物分组与处理
将小鼠随机分为对照组和低、中、高剂量LAS染毒组,每组6只。4组分别灌胃给予0、210、420、630 mg/kg LAS溶液(溶剂为生理盐水),连续灌胃30 d,每天1次。
1.3 观察指标及方法
1.3.1 脏器系数及精子密度测定 于末次染毒次日,戊巴比妥麻醉后称小鼠体质量,腹主动脉采血后处死。分离睾丸和附睾,分别称质量,计算脏器系数(脏器系数=(脏器湿质量/体质量)×100%)。剥取一侧附睾,置于有1 mL生理盐水的平皿中,用眼科剪纵行剪开并轻压,静置5 min后,用细胞计数板在显微镜下计数精子密度。将一侧睾丸用40 g/L多聚甲醛固定,另一侧睾丸于液氮中速冻冷藏。
1.3.2 苏木精-伊红(HE)染色 取多聚甲醛固定的睾丸组织,经洗涤、脱水、组织透明、石蜡包埋、切片、HE染色、脱水、透明、树脂封片等处理后,显微镜下观察睾丸的组织形态,拍照并存档。
1.3.3 睾酮浓度测定 将小鼠血液标本以3 500 r/min离心10 min,分离上层血清,应用I125睾酮放免分析试剂盒测定睾酮浓度。
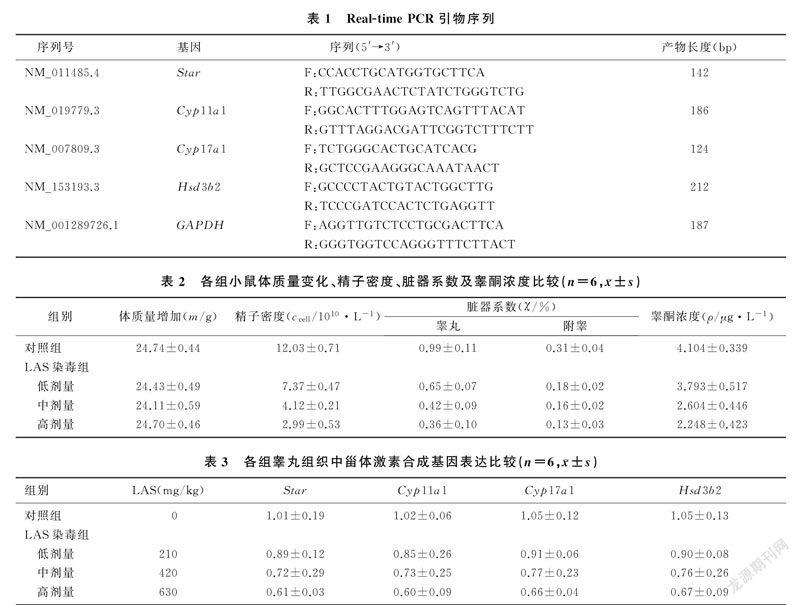
1.3.4 Real-Time PCR检测甾体激素合成限速酶Star、Cyp11a1、Cyp17a1和Hsd3b2基因的表达取液氮中冷藏睾丸,用Trizol法提取睾丸组织总RNA,按照TaKaRa反转录试剂盒说明书反转录成cDNA。Real-Time PCR按照试剂盒说明书进行,起始孵育温度为95 ℃,时间为60 s;变性温度为95 ℃,时间为15 s;退火温度为60 ℃,时间为60 s;延伸温度72 ℃,时间为180 s。扩增循环40个周期。内参为GAPDH,各引物序列见表1。结果用2-ΔΔCt表示[9]。
1.4 统计学处理
应用SPSS 22.0软件进行统计学分析,计量资料结果以±s形式表示,多组间比较采用单因素方差分析(One-Way ANOVA),两组间比较采用q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠体质量变化和睾丸、附睾脏器系数及精子密度比较
实验过程中,各组小鼠均生长正常,体质量增加量差异无显著性(P>0.05)。LAS染毒低、中、高剂量组小鼠的睾丸及附睾脏器系数均低于对照组,精子密度低于对照组,并且以上指标随着LAS染毒剂量增加逐渐降低,差异有统计学意义(F=77.619~375.293,P<0.05)。见表2。
2.2 各组睾丸形态结构的比较
HE染色显示,对照组睾丸生精小管的基膜、生精上皮结构完整,细胞排列规则有序,精原细胞分布紧靠基膜,生精细胞与支持细胞连接紧密,间质细胞饱满,形态正常。LAS染毒低剂量组与对照组比较睾丸形态结构无明显差异;中剂量组生精小管结构大多数尚完整,基膜细胞稀疏,部分区域排列紊乱;高剂量组生精小管内生精细胞排列稀疏,细胞层数减少,精原细胞坏死凝集,间质细胞皱缩,支持细胞数量明显减少。
2.3 各组睾酮浓度比较
与对照组比较,LAS染毒中、高剂量组睾酮浓度均明显下降,差异有统计学意义(F=25.574,P<0.05),低剂量组与对照组比较睾酮浓度差异无显著性(P>0.05)。见表2。
2.4 各组睾丸组织中甾体激素合成基因表达比较
与对照组相比较,LAS染毒各剂量组甾体激素合成基因Star、Cyp11a1、Cyp17a1和Hsd3b2的mRNA的表达水平均下降;并且随着LAS剂量的增加,Star、Cyp11a1、Cyp17a1和Hsd3b2 mRNA的表达均呈明显下降趋势,差异有统计学意义(F=5.578~15.796,P<0.05)。见表3。
3 讨 论
生殖器官最容易受环境污染物的影响,尤其胚胎期和青春期,环境污染物在生殖器官发育过程中的干扰作用更明显[10]。环境污染物可影响生殖细胞功能,导致体内内分泌异常,影响生殖系统激素合成分泌,影响生殖功能[11-13]。因此,研究环境对内分泌干扰时,暴露期的选择十分重要。本实验以3周龄青春期小鼠睾丸为研究对象,通过睾丸整体体外培养途径,尽可能保持了细胞之间的联系与器官的整体性,为从分子机制方面初步探讨LAS对小鼠睾丸睾酮合成影响的理想模型。研究显示,人体普遍暴露在LAS中,量虽较小,但长期蓄积可能对人体造成一定影响[14-15]。研究发现,每日经皮肤直接接触、餐具和蔬菜水果残留等方式进入体内LAS量可达10 mg以上[16-17],因此本研究设立3个不同浓度LAS染毒组,所设剂量范围涵盖了人体暴露剂量。
精原细胞脱落、间质细胞皱缩是睾丸损伤后常见而明显的形态学改变[18]。本文研究结果显示,与对照组比较,LAS染毒中剂量组的小鼠睾丸组织中精原细胞坏死凝集、间质细胞皱缩,曲细精管内生精细胞排列稀疏,细胞层数减少,精原细胞坏死凝集,间质细胞皱缩,支持细胞数量明显减少,且此变化与染毒浓度呈正相关。韩海艳等[7]和张颖等[19]的研究显示,LAS可导致精子形态发生改变,畸形率上升。还有对雄性生殖毒性研究结果显示,环境污染物双酚A可以使小鼠睾丸中精原细胞脱落消失,间质细胞皱缩[20]。本研究中LAS对睾丸细胞的形态学影响结果与以上文献结果相似。
睾丸间质细胞是雄性体内合成睾酮的主要部位。本研究发现,LAS染毒各剂量组小鼠睾丸间质细胞分泌的睾酮浓度下降,随着染毒剂量的增加,睾酮浓度下降更加明显,说明LAS暴露的生殖毒性具有剂量效应。已有研究发现,睾酮可以促进睾丸曲细精管的发育和精子发生和成熟,睾酮的降低可以影响生精小管的发育[21]。本研究中,LAS可引起曲细精管的损伤性改变,并可影响睾酮的合成,这一恶性循环最终导致了雄性小鼠生育功能的受损。
甾体激素合成限速酶包括Star、Cyp11a1、Cyp17a1和Hsd3b2等在睾酮合成的过程中发挥着重要的调节作用[22-23]。Star将体内的游离胆固醇转运至线粒体内质网,Cyp11a1可催化转移到线粒体内膜的胆固醇为孕烯醇酮,孕烯醇酮又可在Cyp17a1的作用下转变为雄烯二酮,3βHSD催化雄烯二酮转变为睾酮,继而完成睾酮的分泌[24-25]。本研究中,随着LAS剂量的增加,Star、Cyp11a1、Cyp17a1和Hsd3b2 mRNA的表达均呈明显下降趋势,说明LAS暴露能够降低甾体激素合成限速酶基因的表达水平,在睾酮合成通路中下调相关甾体激素合成限速酶的表达可影响睾酮的合成,这可能是LAS产生生殖毒性的一个调节机制。
睾丸支持细胞是与精子发生密切相关的重要细胞,为各级生精细胞提供营养支持及合适的生精微环境,并参与血-睾屏障的组成。睾丸组织中支持细胞与间质细胞紧密相邻,为睾酮的合成分泌提供结构支持和旁分泌调节。支持细胞通过分泌抑制素B等物质,参与调节血清睾酮的合成[26]。LAS染毒高剂量组支持细胞裂解和减少,提示LAS可能对睾丸支持细胞骨架有影响。这可能是睾酮合成在LAS高剂量组明显下降,导致睾丸发育障碍的原因之一。
此外,有学者研究发现,LAS可损伤人张氏肝细胞和皮肤细胞,其机制可能通过引起相应组织的氧化应激,导致氧化应激通路障碍,产生对各组织的损伤作用[27]。在应用抗氧化物质后,小鼠皮肤内源性氧自由基清除系统功能增强,改善了LAS的损伤作用[28]。本课题组前期的研究结果显示,對雌性小鼠进行LAS口饲染毒后,其雌性子代血清类固醇激素水平、血清SOD活力以及卵巢Star和P450scc的mRNA相对表达量均降低,血清MDA水平则升高,且呈线性相关[8]。这说明氧化应激损伤也可能是类固醇激素合成障碍的机制之一。
综上所述,LAS可以影响青春期小鼠睾丸的形态及功能,减少睾酮的合成,这种改变与染毒剂量呈正相关。在中剂量LAS染毒时,可能通过下调睾酮合成过程中的甾体激素合成基因包括Cyp17a1、Cyp11a1、Star和Hsd3b2等的表达,降低睾酮的合成;在高剂量LAS染毒时,睾丸的形态结构受损,睾酮合成相关酶的表达受抑制。综合效应的作用可能共同导致雄性小鼠生殖功能的损伤,影响了睾酮的合成。
[参考文献]
[1] 黄莉,王建华. 影响胚胎早期发育环境因素的研究进展[J]. 动物医学进展, 2005,25(1):7-10.
[2] 寇胜男,朗朗,季宇彬. 环境中化学物质引起的生殖毒性研究进展[J]. 中国药理通讯, 2010,27(2):63-64.
[3] YING Guangguo. Fate, behavior and effects of surfactants and their degradation products in the environment[J]. Environment International, 2006,32(3):417-431.
[4] COMBER S D, CONRAD A U, HSS S, et al. Chronic toxi-city ofsediment-associated linear alkylbenzenesulphonates(LAS) to freshwaterbenthic organisms[J]. Environmental Pollution, 2006,144(2):66l-668.
[5] TASAKI J, NAKAYAMA K, SHIMIZU I, et al. Cellular and molecular hypoxic response incommoncarp (Cyprinuscarpio) exposed tolinearalkylbenzenesulfonate at sublethalconcentrations[J]. Environmental Toxicology, 2017,32(1):122-130.
[6] ALVES R, PEREIRA B F, RIBEIRO R, et al. The scale epithelium as a novel, non-invasive tool for environmental assessment in fish: testing exposure to linear alkylbenzenesulfonate[J]. Ecotoxicology and Environmental Safety, 2016,129:43-50.
[7] 韩海艳,任春娥,乔鹏云,等. LAS对雄性小鼠及其子代生精功能毒性作用的研究[J]. 现代妇产科进展, 2013,22(8):622-625.
[8] 刘小强,李丹,王琦,等. 直链烷基苯磺酸钠对雌性小鼠卵巢类固醇激素合成的影响[J]. 中国药业, 2018,27(12):5-8.
[9] RAO X, HUANG X, ZHOU Z, et al. An improvement of the 2 (-delta delta CT) method for quantitative real-time polyme-rase chain reaction data analysis[J]. Biostat Bioinforma Biomath, 2013,3(3):71-85.
[10] COLBORN T, VOM SAAL F S, SOTO A M. Developmental effects of endocrine-disrupting chemicals in wildlife and humans[J]. Environmental Health Perspectives, 1993,101(5):378-384.
[11] 黄秋驰,王燕燕,杨燕,等. 环境中镉暴露对生殖系统影响的研究进展[J]. 环境卫生学杂志, 2014,4(4):413-417.
[12] 马明月,张玉敏. 孕期暴露双酚A 对子代雌性大鼠卵巢类固醇激素合成的影响[J]. 工业卫生与职业病, 2015,41(1):7-10.
[13] 赵文红,张鼎,周纯先,等. 直链烷基苯磺酸钠对黑腹果蝇生殖能力及寿命的影响[J]. 中南大学学报(医学版), 2011,36(2):154-158.
[14] MOTTERAN F, BRAGA J K, SILVA E L, et al. Kinetics of methane productionand biodegradation of linear alkylbenzenesulfonate from laundrywastewater[J]. Journal of Environmental Science and Health. Part A, Toxic/Hazardous Substances & Environmental Engineering, 2016,51(14):1288-1302.
[15] ZHU Wei, CHEN Huaimin, GUO Lili, et al. Effects of linear alkylbenzenesulfonate (LAS) on the interspecific competition between Microcystis and Scenedesmus[J]. Environmental Science and Pollution Research International, 2016,23(16):16194-16200.
[16] BRADAI M, HAN J, EL O A, et al. Cytotoxic effect of LAS on human intestinal Caco-2 cells:associated biomarkers for risk assessment[J]. Environmental Science and Pollution Research International, 2014,21(18):10840-10851.
[17] 王鳳山. 洗衣粉职业危害与防治对策[J]. 职业与健康杂志, 2000,16(6):6-8.
[18] LI Yuanjie, SONG Tianbao, CAI Yanyan, et al. Bisphenola exposure induces apoptosis and upregulation of Fas/FasL and caspase-3 expression in the testes of mice[J]. Toxicological Sciences, 2009,108(2):427-436.
[19] 张颖,任春娥,乔鹏云,等. 直链烷基苯磺酸钠对雄性小鼠生精功能亚慢性毒性作用研究[J]. 生殖医学杂志, 2012,21(5):459-464.
[20] ZHANG Caili, WANG Anzhong, SUN Xiaona, et al. Protective effects of lyciumbarbarum polysaccharides on testis spermatogenic injury induced by bisphenol a in mice[J]. Evidence-based Complementary and Alternative Medicine, 2013, 2013:690808.
[21] SPITZER M, HUANG G, BASARIA S, et al. Risks and be-nefits of testosterone therapy in older men[J]. Nature Reviews Endocrinology, 2013,9(7):414-424.
[22] YE Leping, ZHAO Binghai, HU Guoxin, et al. Inhibition of human and rat testicular steroidogenic enzyme activities by bisphenol A[J]. Toxicology Letters, 2011,207(2):137-142.
[23] FRYCZ B A, MURAWA D, BOREJSZA-WYSOCKI M A, et al. mRNA expression of steroidogenic enzymes, steroid hormone receptors and their coregulators in gastric cancer[J]. Oncology Letters, 2017,13(5):3369-3378.
[24] WOOD J R, STRAUSS J F. Multiple signal transduction pathways regulate ovarian steroidogenesis[J]. Reviews in Endocrine & Metabolic Disorders, 2002,3(1):33-46.
[25] JAMNONGJIT M, HAMMES S R. Ovarian steroids:thegood,thebad,and the signals thatraise them[J]. Cell Cycle, 2006,5(11):1178-1183.
[26] ANGELOPOULOU R, BALLA M, LAVRANOS G, et al. Sertoli cell proliferation in the fetal and neonatal rat testis: a continuous phenomenon[J]? Acta Histochemica, 2008,110(4):341-347.
[27] 趙文红,张雯,王金花,等. 直链烷基苯磺酸钠对小鼠皮肤组织老化的促进作用[J]. 中国老年学杂志, 2017,37(4):825-827.
[28] 赵文红,崔慧娴,孙倩男,等. 茶多酚对直链烷基苯磺酸钠致小鼠皮肤损伤的保护作用[J]. 茶叶科学, 2016,36(5):461-468.
(本文编辑 黄建乡)