含多西他赛联合化疗对癌症病人胰岛β细胞功能影响
2019-09-10匡弢张彦崔娟娟
匡弢 张彦 崔娟娟
[摘要] 目的 观察胰岛功能正常的恶性肿瘤病人接受以多西他赛为基础的联合方案化疗后,胰岛β细胞功能的变化。
方法 糖代谢正常的恶性肿瘤病人52例,应用以多西他赛为基础的联合方案化疗,观察化疗期间以及化疗结束后1月病人空腹血糖、空腹血胰岛素(FINS)、胰岛素抵抗指数、C肽释放试验的变化。
结果 接受4周期化疗后,病人空腹血糖、FINS以及胰岛素抵抗指数较化疗前及化疗后1个月升高,差异有统计学意义(F=8.041~10.486,P<0.05);C肽释放试验异常23例。化疗结束后1个月,病人空腹血糖、FINS以及胰岛素抵抗指数与化疗前比较差异无统计学意义(P>0.05),C肽释放试验仍有9例未恢复正常。
结论 以多西他赛为基础的联合化疗可损伤胰岛β细胞,且影响血糖代谢。
[关键词] 多西他赛;抗肿瘤联合化疗方案;肿瘤;糖代谢;胰岛素分泌细胞
[中图分类号] R587.1;R739.9
[文献标志码] A
[文章编号] 2096-5532(2019)06-0648-04
doi:10.11712/jms201906005
[开放科学(资源服务)标识码(OSID)]
INFLUENCE OF DOCETAXEL-BASED COMBINED CHEMOTHERAPY ON THE FUNCTION OF PANCREATIC β CELLS IN PATIENTS WITH MALIGNANT TUMOR
KUANG Tao, ZHANG Yan, CUI Juanjuan
(Department of Oncology, Affiliated Hospital of Qingdao University, Qingdao 266003, China)
[ABSTRACT] Objective To investigate the change in the function of pancreatic β cells after docetaxel-based combined chemotherapy in patients with malignant tumor who have normal pancreatic islet function before chemotherapy.
Methods A total of 52 patients with malignant tumors and normal glucose metabolism were enrolled and treated with docetaxel-based combined chemotherapy. Fasting blood glucose, fasting insulin, insulin resistance index, and C-peptide release test results were observed during chemotherapy and at 1 month after chemotherapy.
Results Fasting blood glucose, fasting insulin, and insulin resistance index after 4 cycles of chemotherapy were significantly higher than those before chemotherapy and at 1 month after chemotherapy (F=8.041-10.486,P<0.05), and 23 patients had abnormal results of the C-peptide release test. There were no significant changes in fasting blood glucose, fasting insulin, and insulin resistance index from before chemotherapy to 1 month after chemotherapy (P>0.05), and 9 patients still had abnormal results of the C-peptide release test.
Conclusion Docetaxel-based combined che-
motherapy can damage pancreatic β cells and affect blood glucose metabolism.
[KEY WORDS] docetaxel; antineoplastic combined chemotherapy protocols; neoplasms; glucose metabolism; insulin-secreting cells
2003年,美國国立癌症研究所(NCI)首次将血糖作为化疗毒副作用评价指标之一,并将其列入新版《常见不良事件评价标准》[1],随后恶性肿瘤病人化疗期糖代谢紊乱引起关注。多西他赛(Toceta-
xel)在恶性肿瘤的化疗中占有重要的地位,常见的不良反应有骨髓抑制、血管神经性水肿、体液潴留等。目前针对多西他赛化疗期间致恶性肿瘤病人糖代谢紊乱,以及对胰岛β细胞影响文献报道较少。本文研究对接受以多西他赛为基础的联合化疗的恶性肿瘤病人的糖代谢情况进行前瞻性研究,探讨含多西他赛的联合化疗对恶性肿瘤病人胰岛β细胞功能的影响。现将结果报告如下。
1 资料和方法
1.1 一般资料
2015年10月—2017年6月,选取青岛大学附属医院肿瘤科收治的初治恶性肿瘤病人65例,符合以下条件:①病理确诊为初治恶性肿瘤病人(既往未接受过化疗、介入、放疗、免疫治疗等任何抗肿瘤治疗),化疗前行糖化血红蛋白、C肽释放试验结果为正常,普通型,且空腹血糖(FBG)、空腹血胰岛素(FINS)均在在正常范围;
②年龄≤70岁,Karnofsky评分≥80分,病人体质量指数(BMI)在正常范围内(18.5~24.9 kg/m2),血压及肝肾功能指标均在正常范围内,且无感染症状,体温、白细胞均在正常参数值范围内;③一级亲属没有糖尿病病人,接受化疗前无糖尿病、高血压史;④不伴有出血或梗阻等急需急诊处理的并发症,预计入组病人的生存期超过半年;⑤接受C肽释放试验前无长期使用影响胰岛素抵抗的药物史(包括噻嗪类利尿药、呋塞米、糖皮质激素、口服避孕药、阿司匹林、氟哌啶醇、三环类抗抑郁药、β受体阻滞剂);⑥知情同意。排除标准:①化疗药物过敏或代谢障碍者;②肝癌、胰腺癌,或者合并肝脏、胰腺转移恶性肿瘤病人;③预计生存期不超过半年,恶病质病人;④曾经长期接受全身糖皮质激素治疗者;⑤合并可能引起消化系统功能紊乱、营养障碍的胃肠功能性疾病(伴有吞咽困难、活动性消化溃疡、肠不完全梗阻、消化道活动性出血、穿孔)。退出标准:①入组病人有权利在任何时间以任何原因退出该研究,并不影响其余相关治疗和随访,并记录病人退出研究的具体原因和时间;②病情进展,或出现严重的化疗不良反应及毒副作用,不宜继续接受化疗;③病情进展需要长期大剂量使用影响血糖及胰岛素分泌的药物(包括噻嗪类利尿药、呋塞米、糖皮质激素、口服避孕药、阿司匹林、氟哌啶醇、三环类抗抑郁药、β受体阻滞剂);④拒绝继续接受治疗,或因不良反应停止化疗超过2周。
1.2 化疗方法
所有病人均接受以多西他赛为基础的联合化疗,有52例病人完成相关数据采集,有13例病人退出试验(5例病人未完成化疗,4例病人未完成糖代谢相关数据采集,4例病人失访)。52例病人中37例接受TP方案化疗:多西他赛75 mg/m2 第1天+顺铂75 mg/m2 第1、2天;9例接受TLF方案化疗:多西他赛75 mg/m2 第1天 +亚叶酸钙200 mg/m2 第1~5天+氟尿嘧啶 0.75 g第1~5天;6例接受TCF方案化疗:多西他赛75 mg/m2 第1天+顺铂75 mg/ m2 第1、2天+氟尿嘧啶 0.75 g第1~5天。以3周为一个化疗周期,化疗4周期;使用多西他赛前1 d开始给予地塞米松7.5 mg (早晚各1次),第1~3天预处理。所有病人化疗期间给予托烷司琼5 mg/d止吐治疗。
1.3 检查指标及方法
所有入组病人在化疗前、化疗4个周期后、化疗结束后1月,均行FBG、FINS、胰岛素抵抗指数(IRI)检测及口服糖耐量试验(OGTT试验)、C肽释放试验。入组病人均在入院后当天晚上开始禁食12 h后,采集空腹静脉血,检测FBG、FINS以及基础C肽;之后口服75 g葡萄糖,分别于口服葡萄糖1、2、3 h后采血测C肽值。FBG的正常参考范围为3.90~6.16 mmol/L,FINS的正常参考范围2.6~24.9 mU/L。
1.4 结果分析
根据C肽释放试验结果分组。普通型:C肽基础值正常,峰值出现在口服葡萄糖后60 min内,并且峰值为基础值3倍或以上;峰值延迟型:C肽基础值正常,峰值出现在口服葡萄糖后120~180 min,峰值为基础值3倍或以上;峰值低反应型:C肽基础值正常,峰值为基础值3倍以下;无峰值型:基础以及口服葡萄糖后的C肽值均呈低平线。应用公式计算IRI:IRI=ln[(FBG×FINS)/22.5]。IRI>1.0为胰岛素抵抗阳性[2]。根据1999年WHO标准,糖尿病定义为FBG≥7.0 mmol/L;胰岛β细胞功能受损定义为FBG 6.12~6.99 mmol/L。
1.5 统计学分析
运用SPSS 19.0软件进行统计学处理,计量资料结果以±s形式表示,多组数据间比较采用重复测量设计的方差分析,两两比较采用SNK法;等级资料比较采用秩和检验。以P<0.05表示差异有统计学意义。
2 结 果
2.1 完成C肽释放试验的恶性肿瘤病人一般资料
完成C肽释放试验的恶性肿瘤病人52例中,男29例,女23例;年龄为47~75岁,中位年龄为61岁。其中头颈部肿瘤5例,肺癌15例,食管癌4例,胃癌12例,直肠癌8例,宮颈癌8例。东部协作组(ECOG)评分0~2分,病理分期Ⅱ~Ⅳ期。
2.2 恶性肿瘤病人化疗前后FBG水平比较
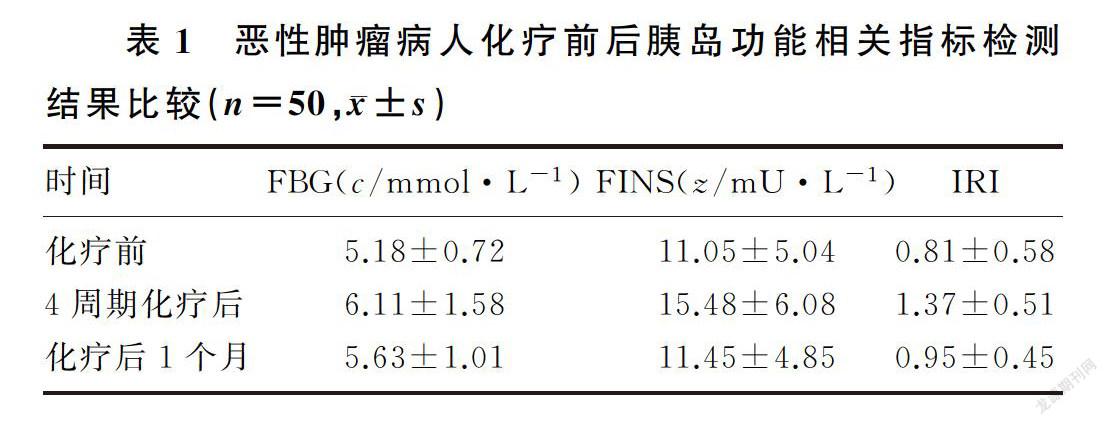
接受4周期联合化疗后病人的FBG水平高于化疗前和化疗后1个月,差异有显著性(F=8.041,q=5.670、2.927,P<0.05);化疗后1个月病人FBG水平和化疗前比较差异无统计学意义(P>0.05)。见表1。
2.3 恶性肿瘤病人化疗前后胰岛素水平比较
完成胰岛素检测的52例恶性肿瘤病人中,排除化疗前FINS高于正常参考范围病人2例,其余50例化疗前后FINS水平见表1。接受4周期联合化疗后,恶性肿瘤病人FINS水平明显高于化疗前及化疗后1个月,差异有显著意义(F=10.486,q=5.854、5.326,P<0.05);化疗结束1个月 FINS水平与化疗前比较差异无统计学意义(P>0.05)。
2.4 恶性肿瘤病人化疗前后IRI比较
在4周期化疗后, 50例病人中有13例存在胰岛素抵抗状态;化疗结束后随访1月,仍有9例存在胰岛素抵抗状态。接受4周期联合化疗后,病人IRI水平明显高于化疗前及化疗后1个月,差异有显著性(F=15.945,q=7.673、5.755,P<0.05);化疗结束1个月IRI与化疗前比较差异无统计学意义(P>0.05)。见表1。
2.5 恶性肿瘤病人化疗前后C肽释放试验结果的比较
本文52例恶性肿瘤病人化疗前C肽释放试验曲线均为普通型,提示胰岛功能正常。化疗前、4周期化疗后、化疗后1个月,恶性肿瘤病人C肽释放试验结果比较,差异均有显著性(Hc=31.755,P<0.05)。4周期化疗后,52例恶性肿瘤病人C肽释放试验曲线结果为峰值延迟型13例,峰值低反应型8例,无峰值型2例,化疗前后胰岛功能状态比较差异有显著性(Z=5.36、3.08,P<0.05)。化疗后随访1月后, C肽释放试验曲线结果为峰值延迟型5例,峰值低反应型2例,无峰值型2例。随访1月后,胰岛功能渐恢复至化疗前状态(P>0.05)。23例病人存在胰岛β细胞功能受损,其中有13例病人(9例接受TP方案,1例接受TLF方案,3例接受TCF方案化疗)表现为峰值延迟型,8例病人(5例接受TP方案化疗,3例接受TLF方案化疗)胰岛功能明显受损,2例病人(接受TCF方案化疗)胰岛功能趋向衰竭。化疗结束后随访1月,复查C肽释放试验,该23例胰岛功能受损病人中有15例恢复正常,5例仍表现为早期胰岛素抵抗,2例病人胰岛功能明显受损、趋向衰竭。
3 讨 论
近几年随着恶性肿瘤病人生存期延长,治疗相关性不良反应受到越来越多关注。化疗为恶性肿瘤尤其是中晚期肿瘤病人的主要治疗手段之一。临床研究显示,无基础糖尿病的恶性肿瘤病人接受化疗后,可发生糖代谢紊乱,甚至诱发糖尿病[3]。而合并糖尿病的恶性肿瘤病人接受化疗后,极易发生糖尿病急性并发症,从而降低治疗的依从性,影响病人远期生存率以及生活质量[4]。动物实验结果显示,化疗药物可以影响大鼠糖代谢[5-6]。FALKSON等[7]研究显示,195例已缓解的乳癌病人化疗过程中化疗诱发糖代谢紊乱的发生率为8.5%。周宁等[8]观察250例女性乳癌术后病人,发现以紫杉类为主的化疗方案更易引起血糖升高。HOTTA等[9]观察发现,Ⅲ期结直肠癌病人化疗3个疗程后,更易出现糖耐量异常。其他临床观察也发现血糖异常多发生于多疗程大剂量化疗后[10-13]。
人体内C肽由胰岛素原裂解产生,与胰岛素共同存在于同一颗粒囊内,以等分子方式分泌;在体内C肽与胰岛素分泌的峰值曲线相同,故C肽可用于判断胰岛β细胞功能。同时,C肽与胰岛素结构不同,二者无交叉免疫原性,C肽测定在已使用胰岛素或体内已产生胰岛素抗体的病人更具优势,所以C肽检测对于内源性胰岛素的分泌能力评价更具有价值。OGTT检查结果显示,C肽释放曲线为普通型,提示胰岛功能正常;延迟型则提示早期胰岛素抵抗;低反应型主要是分泌峰值降低,而基础C肽水平尚正常,说明胰岛β细胞储备功能受损明显;无反应型提示胰岛β细胞功能受损明显,趋向衰竭[14]。本文通过检测FBG、FINS及C肽释放试验等,观察恶性肿瘤病人接受以多西他赛为基础的联合化疗4周期以及化疗结束后1月胰岛功能的变化,全面评估以多西他赛为基础的联合化疗对恶性肿瘤病人糖代谢的影响。结果显示,恶性肿瘤病人化疗后糖代谢发生变化,表现为FBG或FINS升高,IRI增加;结合C肽释放试验有23例病人存在胰岛β细胞功能受损,其中有13例病人为延迟型,提示化疗对胰岛功能的损伤主要表现为早期胰岛素抵抗。化疗结束后随访1月,复查C肽释放试验,结果提示在化疗期间23例胰岛功能受损的病人中,有15例恢复正常,5例仍表现为早期的胰岛素抵抗,2例胰岛功能明显受损、趋向衰竭病人没有恢复。这些病人胰岛β细胞功能最终能否完全恢复至化疗前状态,有待继续随访。
以多西他赛为基础的联合化疗对胰岛β细胞功能的影响,考虑与以下因素有关。①多西他赛作用于细胞的微丝、微管系统,在抗肿瘤的同时可以影响胰岛β细胞分泌与释放胰岛素,从而引起血糖升
高[8]。②接受多西他赛化疗期间,需要短期使用地塞米松预处理以减轻化疗副作用,因糖耐量正常的病人短期使用糖皮质激素后发展为糖尿病并不常见[15],糖尿病的发生可能与糖皮质激素的长期使用有关[16-17],目前尚不清楚糖皮质激素对胰岛β细胞功能的影响。本文研究中化疗期间C肽释放曲线出现异常的病人,接受地塞米松的中位累积剂量为225 mg,该剂量的糖皮质激素对人体血糖的代谢有一定的影响,但对于胰岛细胞分泌功能是否有影响,目前尚不清楚。③文献报道顺铂可以影响血糖代谢[11,18],多出现在反复长疗程大剂量化疗后。本文病人平均接受4周期含顺铂方案化疗,中位累积剂量480 mg,顺铂联合多西他赛化疗是否更易使病人胰岛β细胞功能发生变化,尚需进一步分析。
綜上所述,以多西他赛为基础的联合化疗对恶性肿瘤病人的胰岛功能有影响,并且在化疗结束随访1月有部分病人仍不能够恢复。恶性肿瘤病人化疗结束后胰岛功能的损伤能否最终恢复正常,多久恢复正常,需要进一步研究。化疗对恶性肿瘤病人血糖的影响应引起临床的重视。
[参考文献]
[1]戴月娣,陶莉,胡夕春,等. 化疗对恶性肿瘤合并糖尿病患者血糖的影响[J]. 临床肿瘤学杂志, 2008,13(3):254-257.
[2]张彦琴,张丽,叶淑兰,等. 白血病合并糖尿病15例病因探讨[J]. 中国实用内科杂志, 1996,16(9):555.
[3]林燕. 乳腺癌化疗诱发糖尿病1例[J]. 中国普通外科杂志, 2002,11(8):487.
[4]万桂玲,吴仕光,魏奎秀. 恶性肿瘤与糖尿病的相关性[J]. 齐鲁医学杂志, 2005,20(6):478-480.
[5]兰文华,匡弢,崔娟娟. 氧化应激对氟尿嘧啶诱导大鼠糖代谢异常的影响[J]. 齐鲁医学杂志, 2016,31(1):10-12.
[6]王朝华,曾浩霞,付天云,等. 不同化疗药物对大鼠血糖代谢的实验研究[J]. 中国妇产科临床杂志, 2010,11(1):48-51.
[7]FALKSON G, GELMAN R S, PANDYA K J, et al. Eastern cooperative oncology group randomized trials of observation versus maintenance therapy for patients with metastatic breast cancer in complete remission following induction treatment[J]. Journal of Clinical Oncology, 1998,16(5):1669-1676.
[8]周寧,杨顺娥,王淑琴. 化疗药物对乳腺癌患者糖代谢的影响[J]. 新疆医科大学学报, 2008,31(10):1393-1395.
[9]HOTTAT, TAKIFUJIK. Toxicity during I-LV/5FU adjuvant chemotherapy as a modified RPMI regimen for patients with colorectal cancer[J]. Oncology Reports, 2005,14(2):433-439.
[10]DANSUNTORNWONG B, CHANPRASERTYOTHIN S, JONGJAROENPRASERT W, et al. The relation between parameters from homeostasis model assessment and glycemic control in type 2 diabetes[J]. Journal of the Medical Association of Thailand, 2007,90(11):2284-2290.
[11]NAN D N, FERNANDEZ-AYALA M, VILLEGAS M E, et al. Diabetes mellitus following cisplatin treatment[J]. Acta Oncologica, 2003,42(1):75-78.
[12]张俊吉,沈铿,郎景和. 化学药物对卵巢恶性肿瘤患者血糖代谢的影响[J]. 中华妇产科杂志, 2002,37(8):481-483.
[13]张辉,王正慧,唐江岳. 晚期恶性肿瘤患者血糖测定的意义[J]. 四川肿瘤防治, 1999,12(4):14-16.
[14]陈栋,段文若,何娟,等. C肽释放反应类型在糖尿病中的应用[J]. 标记免疫分析与临床, 2001,8(1):1-3.
[15]SAAG K G, KOEHNKE R, CALDWELL J R, et al. Low-dose long-term corticosteroid-therapy in rheumatoid-arthriti-
san analysis of serious adverse events[J]. American Journal of Medicine, 1994,96(2):115-123.
[16]VOLGI J R, BALDWIN D J. Glucocorticoid therapy and diabetes management[J]. The Nursing Clinics of North America, 2001,36(2):333-339.
[17]CLORE J N, THURBY H L. Glucocorticoid-induced hyperglycemia[J]. Endocrine Practice, 2009,15(5):469-474.
[18]BURTNESS B, GIBSON M, EGLESTON B, et al. Phase Ⅱ trial of docetaxel-irinotean combination in advanced esophageal cancer[J]. Annals of Oncology, 2009,20(7):1242-1248.
