微孔板改良法评价多种国内外单花蜜的体外抑菌活性
2019-09-10王晶波秦文杨倬王丽媛卓勤宫照龙沈葹
王晶波 秦文 杨倬 王丽媛 卓勤 宫照龙 沈葹

摘 要:目的:开展国内外多种单花蜜体外抑菌活性差异的系统评价。方法:以無菌Mueller-Hinton Broth培养基稀释得到3.75%~90%(w/v)不同浓度的单花蜜,采用96微孔板改良法,用空白无菌培养基和标准菌株作对照孔,测定18种单花蜜对金黄色葡萄球菌、沙门氏菌和大肠埃希氏菌的最低抑菌浓度、最低杀菌浓度、迟缓期持续时间、对数期持续时间和最大细菌密度5个抑菌活性指标。结果:18种单花蜜均具有不同程度的抑菌活性,且抑菌生长曲线均优于标准菌株对照孔,延长了3种致病菌的迟缓期持续时间、缩短了对数期持续时间和降低了最大细菌密度,其中小茴香蜂蜜最低抑菌浓度为7.5%,最低杀菌浓度为15%,均优于麦卢卡蜂蜜。结论:96微孔板改良法灵敏、快速、客观、可直观显示不同的单花蜜具有抑菌活性差异,其中小茴香蜂蜜、葵花蜂蜜、椴树蜂蜜活性最为显著,本文为蜂蜜的功能评价与市场开发提供了科学依据。
关键词:微孔板改良法;体外抑菌;小茴香蜂蜜;单花蜜
我国是世界养蜂大国,2016年我国蜂蜜产量高达48.14 万t,出口数量占世界蜂蜜出口量的12.32%[1],且我国地域辽阔,蜜源植物群落和种类名目繁多,分布极为广泛。现代医学发现,蜂蜜对革兰氏阳性菌和阴性菌都有不同程度的抑制作用[2-5],可加速创伤组织修复及对胃溃疡和胃炎具有治疗作用,国内外研究多发现尤以新西兰的麦卢卡蜂蜜抗菌功效突出,被认为是一种特殊药物,成为蜂蜜抑菌活性评价的标志性产品[6-7]。我国蜂蜜应用历史悠久且蜂蜜种类繁多,数千年前蜂蜜就有被用来外敷伤口防治感染和消化道治疗的记载[8-11],但目前缺乏对于我国不同蜜源植物的单花蜜系统抑菌活性评价。因此,系统评价我国不同蜜源植物蜂蜜的抑菌特性,且与国外蜂蜜做对比研究,提升我国蜂蜜的功效价值与市场开发势在必行。
目前,蜂蜜的体外抑菌评价方法多采用琼脂扩散法[12-14]或营养肉汤梯度稀释法[15],琼脂扩散法通常通过测定抑菌圈直径的大小来定性抑菌活性,该法经典、简单、易掌握,但精确度不高;营养肉汤梯度稀释法常用来定量最小抑菌浓度,结果比琼脂扩散法精确,但操作较为复杂,试剂耗费多,人为误差大,不适用于样品的高通量检测。近年来,有报道96微孔板法[3,16],其操作过程比较简单,试剂耗费少,结果精确直观,重复性好,但报道的文献方法缺乏对抑菌迟缓期持续时间和对数期持续时间的评价,因此,本文将96微孔板法与抑菌生长曲线[17]方法结合建立了96微孔板改良法,可灵敏、快速、客观地评价单花蜜的抑菌活性。采用96微孔板改良法,通过最低抑菌浓度、最低杀菌浓度、迟缓期持续时间、对数期持续时间和最大细菌密度等5 个抑菌指标,对12种国产单花蜜(洋槐、枣花、荆条、椴树、葵花、小茴香、荞麦、五味子、枸杞、黄连、土黄连、荔枝)和6种国外单花蜜(麦卢卡、薰衣草、红桉树、向日葵、橙花)的抑菌活性进行了系统评价。
1 材料与方法
1.1 试剂和仪器
Mueller-Hinton Broth培养基(MHB),北京索莱宝科技有限公司;营养琼脂、营养肉汤、脑心浸出液肉汤(BHI)、细菌琼脂粉和血琼脂平板,北京陆桥技术股份有限公司。
酶标仪SpectraMax i3x,基因有限公司;生化培养箱MMM Incucell 222,德国MMM公司;电热恒温水槽DK-450B,上海森信实验仪器有限公司。
1.2 样本采集及处理
单花蜜样本,均购买自森蜂园、汪氏蜜蜂园、同仁堂、农科院等知名品牌,包括A洋槐蜂蜜(产地山东沂蒙)、B枣花蜂蜜(产地江西南昌)、C荆条蜂蜜(产地北京昌平)、D椴树蜂蜜(产地长白山)、 E葵花蜂蜜(产地内蒙古临河)、F小茴香蜂蜜(产地玉门)、G荞麦蜂蜜(产地北京)、H五味子蜂蜜(产地北京)、I枸杞蜂蜜(产地浙江衢州)、J黄连蜂蜜(产地上海奉贤)、K土黄连蜜(产地江西南昌)、L荔枝蜂蜜(产地北京)、M薰衣草蜂蜜(产地西班牙)、N红桉树蜂蜜(TA 20+)(产地澳大利亚)、O向日葵蜂蜜(产地德国)、P橙花蜂蜜(产地法国)、Q麦卢卡蜂蜜(UMF 5+)(产地新西兰)、R麦卢卡蜂蜜(UMF 15+)(产地新西兰),均室温避光保存。单花蜜样品各取9g,加入10 mL无菌MHB培养基,以37℃水浴辅助溶解、混匀,然后用无菌MHB培养基逐级稀释得到3.75%、7.5%、15%、30%、45%、60%、75%、90%(w/v)不同浓度的蜂蜜溶液,4℃冰箱保存,1周内使用。
1.3 菌种信息
金黄色葡萄球菌CICC 21600、沙门氏菌CICC 21513、大肠埃希氏菌CICC 21530,均为中国工业微生物菌种保藏中心提供。用BHI复苏标准菌株,于营养琼脂平板上37℃、24h进行复苏传代备用。实验时取24h细菌,用无菌MHB培养基调整菌浓度为0.5 麦氏浊度(1×108CFU/mL),并用MHB培养基稀释500倍作为实验用细菌原液(2×105CFU/mL)。
1.4 最低抑菌浓度的测定
本实验采用96微孔板法[16]测定最低抑菌浓度(MIC),样品组每孔依次加入细菌原液10μL和不同浓度的蜂蜜溶液190μL,重复测定3 次,以无菌MHB培养基作为空白组,以细菌原液10μL加入无菌MHB培养基菌株190μL作为对照组。用酶标仪于600 nm测定培养前和37℃培养24h后的吸光度值,分别记为OD0和OD24,空白组调零,蜂蜜对细菌的抑制率按式(1)计算,抑制率为100%对应的最小蜂蜜浓度为该单花蜜的最低抑菌浓度(MIC)。
抑制率(%)=(1-样品组OD24-样品组OD0对照组OD24-对照组OD0)×100%(1)
1.5 最低杀菌浓度的测定
分别吸取1.4实验中所有抑制率为100%相应孔的蜂蜜稀释液各10μL到血琼脂平板,均匀涂布后37℃培养24h,以允许小于0.1%的细菌生长,即血琼脂平板上菌落数≤10对应的最小蜂蜜浓度,确定为该单花蜜的最低杀菌浓度(MBC)。
1.6 抑菌生长曲线
本实验以96微孔板法为基础,结合48h蜂蜜抑菌生長曲线的测定[17]形成96微孔板改良法,来测定蜂蜜对3种致病菌的抑菌活性,具体方法为:样品组每孔依次加入细菌原液10μL和30%(w/v)的蜂蜜溶液190μL,重复测定3 次,以无菌MHB培养基作为空白组,以细菌原液10μL加入无菌MHB培养基菌株190μL作为对照组。采用酶标仪37℃孵育并于600nm连续测定吸光度值,每间隔10min振动5s,每30min测定1次吸光度值,持续测定48h,以持续时间为横坐标、以吸光度值为纵坐标绘得3种致病菌在不同单花蜜的作用下48h内的生长曲线,计算出迟缓期持续时间、对数期持续时间和最大细菌密度等指标,结果以平均值±标准差表示(n=3)。
2 结果与分析
2.1 MIC和MBC测定结果
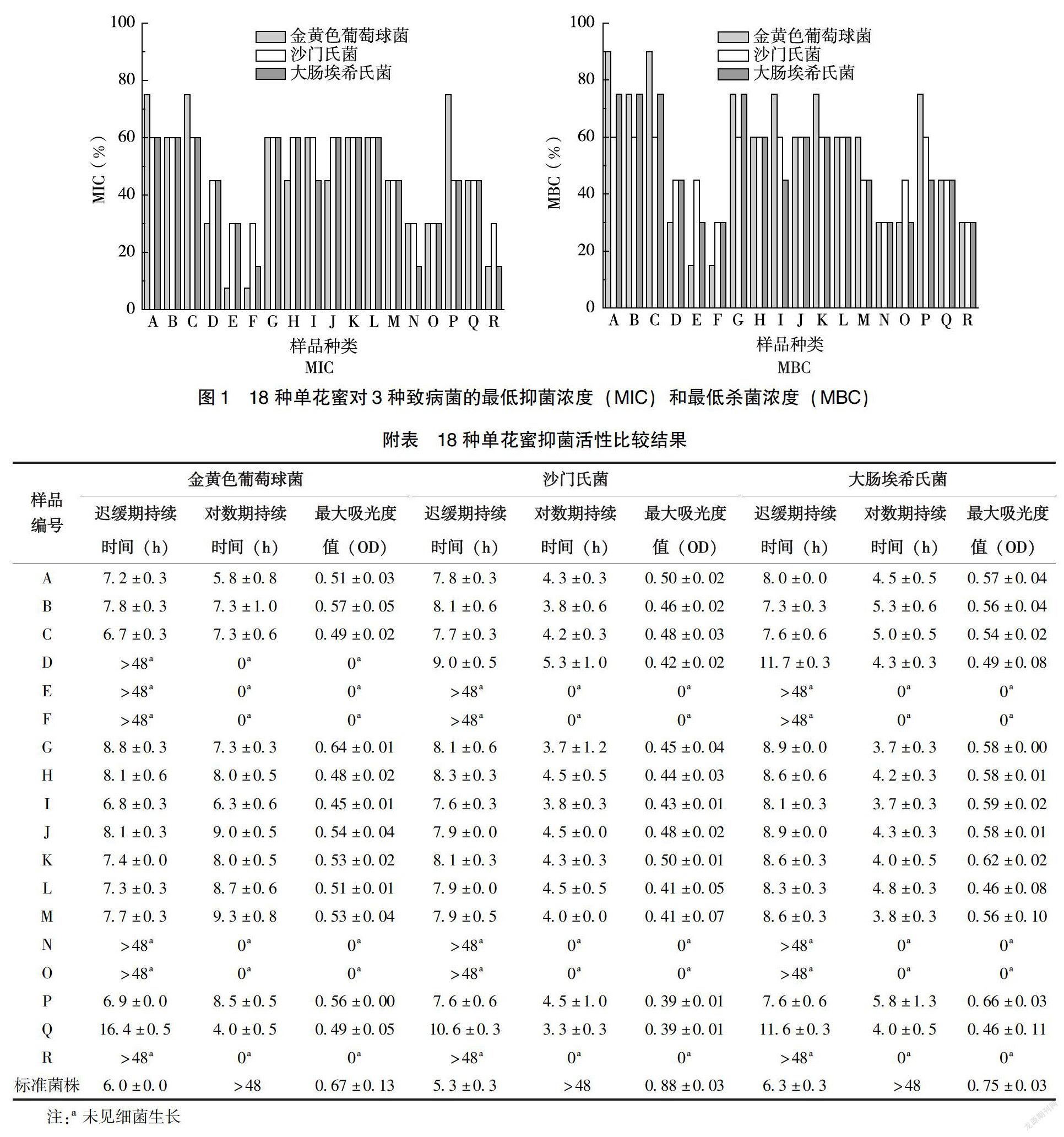
所有单花蜜样本对金黄色葡萄球菌、沙门氏菌、大肠埃希氏菌均有不同程度的抑菌活性,其中对金黄色葡萄球菌的MIC和MBC分别为7.5%~75%和15%~90%,对沙门氏菌的MIC和MBC均为30%~60%,对大肠埃希氏菌的MIC和MBC分别为15%~60%和30%~75%;此外,不同蜜源的单花蜜抑菌差异显著,其中E(葵花蜂蜜)、F(小茴香蜂蜜)对金黄色葡萄球菌的MIC和MBC分别低达7.5%、15%,R(麦卢卡蜂蜜UMF 15+)对金黄色葡萄球菌的MIC和MBC分别为15%、30%,F(小茴香蜂蜜)、R(麦卢卡蜂蜜UMF 15+)对沙门氏菌的MIC和MBC均为30%,对大肠埃希氏菌的MIC和MBC分别为15%、30%。结果显示,葵花蜂蜜和小茴香蜂蜜对金黄色葡萄球菌的抑制效果优于麦卢卡蜂蜜UMF 15+,小茴香蜂蜜对沙门氏菌和大肠埃希氏菌的抑菌活性和麦卢卡蜂蜜相同(图1)。
2.2 抑菌生长曲线结果
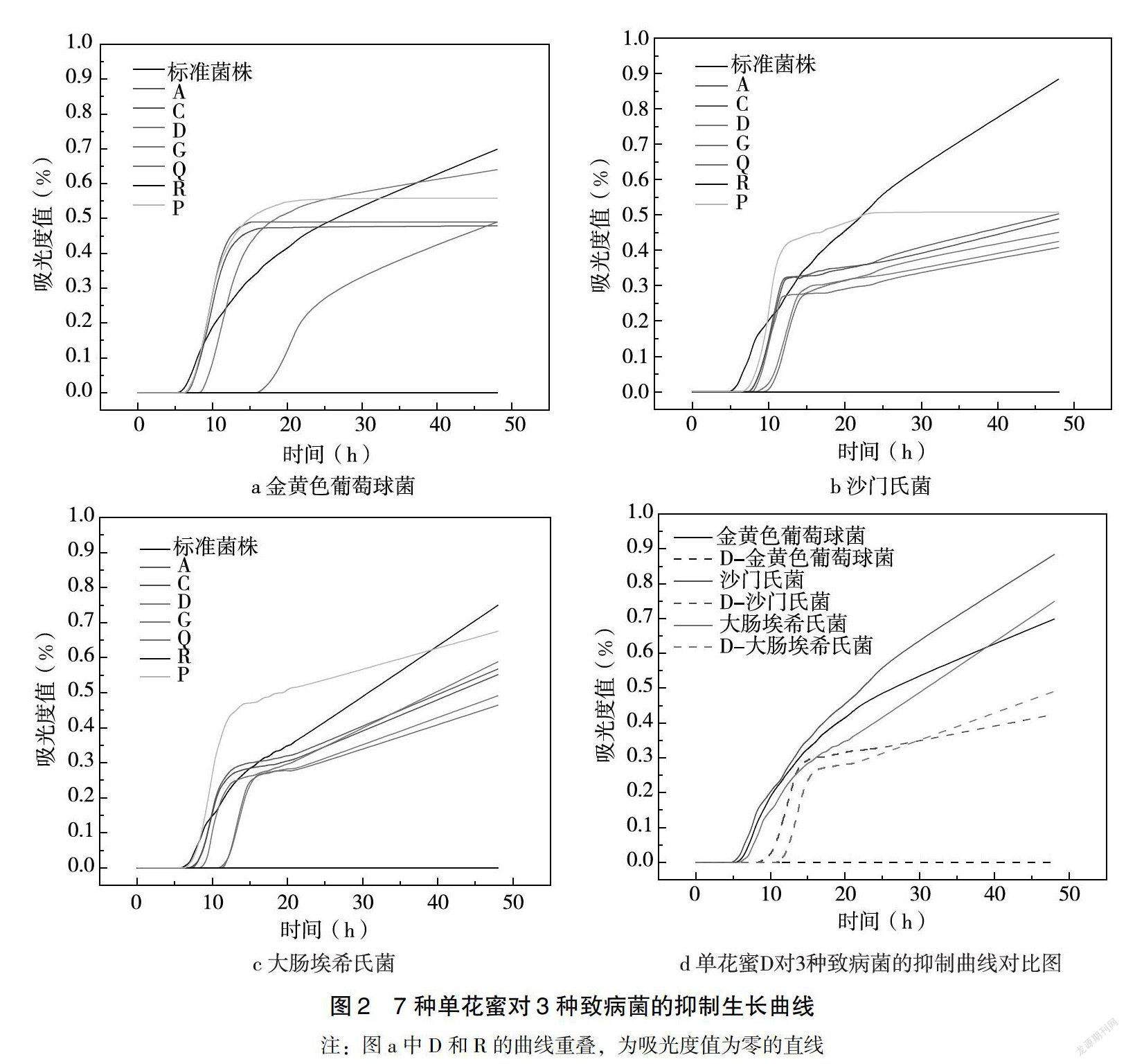
根据不同蜜源单花蜜(30% w/v浓度)对金黄色葡萄球菌、沙门氏菌和大肠埃希氏菌的抑菌生长曲线(图2),可以得出迟缓期持续时间、对数期持续时间和最大细菌密度。由附表可知,与标准菌株对照组对比,18种单花蜜均延长了对3种致病菌的迟缓期持续时间、缩短了对数期持续时间和降低了最大细菌密度,其中对金黄色葡萄球菌、沙门氏菌和大肠埃希氏菌的迟缓期持续时间分别为≥6.7±0.3h、≥7.6±0.3h、≥7.3±0.3h;对金黄色葡萄球菌、沙门氏菌和大肠埃希氏菌的对数期持续时间分别为0~9.3h、0~5.3h和0~5.8h;对金黄色葡萄球菌、沙门氏菌和大肠埃希氏菌的最大细菌密度以最大吸光度值表示,分别为0~0.64、0~0.50和0~0.66。研究发现,D(椴树蜜)对金黄色葡萄球菌的生长曲线具有明显抑制作用,E(葵花蜜)、F(小茴香蜂蜜)、N(红桉树蜜)、O(向日葵蜜)和R(麦卢卡蜂蜜UMF 15+)在48h内未见3种致病菌生长,对致病菌具有显著的完全抑制活性,抑菌生长曲线均为吸光度值为零的直线。
3 结论
本研究采用96微孔板改良法,测定了不同蜜源单花蜜的最低抑菌浓度、最低杀菌浓度、迟缓期持续时间、对数期持续时间和最大细菌密度5个指标,该方法灵敏、快速、客观,可直观对比国内外18种单花蜜的抑菌活性及差异。所有样本均具有差异显著的抑菌活性,且抑菌生长曲线均优于标准菌株对照孔,延长了3种致病菌的迟缓期持续时间、缩短了对数期持续时间和降低了最大细菌密度,其中D(椴树蜜)、E(葵花蜜)、F(小茴香蜂蜜)、N(红桉树蜜)、O(向日葵蜜)和R(麦卢卡蜂蜜UMF 15+)活性显著,尤以葵花蜂蜜和小茴香蜂蜜的抑菌活性优于麦卢卡蜂蜜,本文的研究结果为提升我国蜂蜜的功效价值与小众蜂蜜的市场开发提供了科学依据。蜂蜜化学成分复杂,富含多种氨基酸、维生素、矿物质、微量元素等营养成分,同时还含有多种酚酸类、黄酮类、过氧化氢等活性物质[18],因此,可进一步开展蜂蜜的抑菌成分与功效相关性研究,为蜂蜜在临床用药和食物保健等方面提供科学依据,为蜂蜜的多元化应用开辟更加广阔的前景。
参考文献
[1]Shen S,Wang J,Zhuo Q,et al.Quantitative and discriminative evaluation of contents of phenolic and flavonoid and antioxidant competence for Chinese honeys from different botanical origins[J].Molecules,2018,23(5):1110.
[2]黄东萍,蒋贵发,周文誉,等.几种蜂蜜对幽门螺旋杆菌的体外抗菌作用[J].时珍国医国药,2006,17(1):1989-1990.
[3]Nishio E K,Ribeiro J M,Oliveira A G,et al.Antibacterial synergic effect of honey from two stingless bees:Scaptotrigona bipunctata Lepeletier,1836,and S.postica Latreille,1807[J].Scientific Reports,2016(6):21641.
[4]Huttunen S,Riihinen K,Kauhanen J,et al.Antimicrobial activity of different finnish monofloral honeys against human pathogenic bacteria[J].APMIS,2012,121(9):827-834.
[5]孔祥溢,关健,杨义,等.蜂蜜促进创伤愈合的免疫调控机制研究进展[J].医学研究杂志,2015,44(10):18-21.
[6]Oelschlaegel S,Gruner M,Wang P N,et al.Classification and characterization of manuka honeys based on phenolic compounds and methylglyoxal[J].Journal of Agricultural and Food Chemistry,2012,60(29):7229-7237.
[7]Stephens J M,Schlothauer R C,Morris B D,et al.Phenolic compounds and methylglyoxal in some New Zealand manuka and kanuka honeys[J].Food Chemistry,2010(1):78-86.
[8]Majno G.The healing hand:man and wound in the ancient world[J].Plastic and Reconstructive Surgery,1976(2):230.
[9]ZumLa A,Lulat A.Honey-a remedy rediscovered[J].Journal of the Royal Society of Medicine,1989,82(7):384-385.
[10]Israili Z H.Antimicrobial properties of honey[J].American Journal of Therapeutics,2014,21(4):304-323.
[11]Malone M,Tsai G.Wound healing with apitherapy:a review of the effects of honey[J].Journal of Apitherapy,2016,1(1):29-32.
[12]Roshan N,Rippers T,Locher C,et al.Antibacterial activity and chemical characteristics of several Western Australian honeys compared to manuka honey and pasture honey[J].Archives of Microbiology,2017,199(2):347-355.
[13]Irish J,Blair S,Carter DA.The antibacterial activity of honey derived from Australian flora[J].PLoS One,2011,6(3):e18229.
[14]Motamayel F A,Hendi S S,Alikhani M Y,et al. Antibacterial activity of honey on cariogenic bacteria[J].Journal of Dentistry,2013,10(1):10-15.
[15]Rezvani M B,Niakan M,Kamalinejad M,et al.The synergistic effect of honey and cinnamon against Streptococcus mutans bacteria[J].Asian Pacific Journal of Tropical Biomedicine,2017,7(4):314-320.
[16]Deng J,Liu R,Lu Q,et al.Biochemical properties,antibacterial and cellular antioxidant activities of buckwheat honey in comparison to manuka honey[J].Food Chemistry,2018,252(30):243-249.
[17]Rodríguez B A,Mendoza S,Iturriga M H,et al.Quality parameters and antioxidant and antibacterial properties of some Mexican honeys[J].Journal of Food Science,2012,71(1):C121-127.
[18]伊作林,楊柳,席芳贵,等.蜂蜜成分及功能活性的研究进展[J].中国蜂业,2018(4):51-54.
Abstract:Objective To evaluate the antibacterial activities of various domestic and foreign various monofloral honeys in-vitro systematically.Method Using 96-well microplates modified method,monofloral honeys were diluted in sterile Mueller-Hinton Broth medium to obtain different concentrations from 3.75% to 90%(w/v),compared with blank sterile medium and standard strain,5 indicators of antibacterial activities of the 18 monofloral honeys against Staphylococcus aureus, salmonella and Escherichia coli were determined,including minimum inhibitory concentration,minimum bactericidal concentration,lag phase duration,logarithmic duration and maximum bacterial density.Result It was indicated that the 18 monofloral honeys had different antibacterial activities,and were better than the standard strain control well based on the inhibition growth curves.The 18 monofloral honeys prolonged the durations of lag phase,shortened durations of logarithmic duration and reduced the maximum bacterial density against three pathogenic bacteria.The minimum inhibitory concentration and the minimum bactericidal concentration of fennel honey was 7.5% and 15%,which were better than Manuka honey.Conclusion 96-well microplates modified method is sensitive,fast,objective and intuitive to indicate that different monofloral honeys have discrepant antibacterial activities,especially fennel honey,sunflower honey and linden honey can remarkably inhibited the growth of three pathogenic bacteria,which provided the scientific basis for functional evaluation and market development of honeys.
Keywords:Microplates Modified Method;antibacterial activity in vitro;fennel honey;monofloral honey
(责任编辑 李婷婷)
