黄沙鳖抗菌肽cathelicidin基因克隆及表达特征分析
2019-09-10马沙盛雪晴许飘尹
马沙 盛雪晴 许飘尹


摘要:【目的】克隆黄沙鳖cathelicidin基因并分析其组织分布特征及在攻毒后的表达变化,为深入研究cathelicidin功能及在黄沙鳖先天免疫中的潜在作用提供基础数据。【方法】采用RT-PCR结合RACE克隆黄沙鳖cathelicidin基因cDNA全长序列,利用生物信息学分析软件对黄沙鳖cathelicidin基因及其推导氨基酸序列进行结构特征分析,并采用实时荧光定量PCR检测黄沙鳖cathelicidin基因在不同组织中的表达特征及攻毒后的表达变化。【结果】黄沙鳖cathelicidin基因cDNA序列全长1026 bp(GenBank登录号MK250818),包括483 bp的开放阅读框(ORF)、315 bp的5'非编码区(5'UTR)和228 bp的3'非编码区(3'UTR)。黄沙鳖cathelicidin基因cDNA序列编码160个氨基酸,包括氨基端的信號肽区域、含有4个保守半胱氨酸(Cys)残基的cathelin区域及羧基端的成熟肽区域。黄沙鳖cathelicidin基因推导氨基酸序列与中华鳖cathelicidin基因推导氨基酸序列(KY948708.1)的相似性最高,为97.5%;基于cathelicidin基因推导氨基酸序列相似性构建的系统发育进化树也显示黄沙鳖与中华鳖的亲缘关系最近。黄沙鳖cathelicidin基因在脾脏和肝脏中的相对表达量相对较高,其次是心脏,在脑组织、肾脏、肠道、肌肉、表皮和背甲的相对表达量较低。以温和气单胞菌攻毒后,黄沙鳖脾脏cathelicidin基因相对表达量呈升—降—升—降的波动变化趋势,出现2个峰值(攻毒后第3和36 h),对应的cathelicidin基因相对表达量分别是对照(注射等量无菌生理盐水)的23.1和3.5倍。【结论】黄沙鳖cathelicidin基因在脾脏和肝脏中高表达量,且可被温和气单胞菌感染诱导,说明cathelicidin基因在黄沙鳖抵抗病原感染过程中发挥重要作用。
关键词: 黄沙鳖;抗菌肽;cathelicidin;基因克隆;表达特征
0 引言
【研究意义】黄沙鳖(Pelodiscus sinensis)为中华鳖(P. sinensis)的地理种群(黄雪贞等,2012;农新闻等,2015),主要分布于我国两广的西江流域,为广西名优养殖品种之一,其养殖业也是广西水产养殖的重要支柱产业之一(张秋明等,2010)。黄沙鳖味鲜肉嫩、营养丰富,其裙边富含易被人体吸收的小分子胶原蛋白,单位质量的肌肉粗蛋白含量和必需氨基酸指数均高于中华鳖(赖春华等,2011;周吴萍等,2012),深受广大消费者喜爱。但近年来由于各种病害的暴发流行,导致黄沙鳖养殖损失惨重(农新闻等,2015)。Cathelicidins是一类由氨基端信号肽、中间cathelin结构域和羧基端成熟肽构成的宿主抗菌肽(张东玲和喻达辉,2015),广泛分布于各种脊椎动物体内,是宿主防御病毒和细菌等病原入侵的重要屏障,为脊椎动物先天免疫的关键组成部分。因此,加强对黄沙鳖cathelicidin基因的研究,有助于进一步认识黄沙鳖的先天免疫系统。【前人研究进展】cathelicidin于20世纪90年代最先在猪中被发现,后来陆续有研究证实该抗菌肽在其他哺乳类、鸟类、鱼类、两栖类和爬行类等脊椎动物中也广泛存在(Lehrer and Ganz,2002;Zanetti,2005)。cathelicidin在动物体中通常以无活性前体肽的形式存在,需经蛋白酶水解才能释放出具有活性的成熟肽(广慧娟,2013)。cathelicidin成熟肽能与带负电荷的细菌磷脂细胞膜相互作用,从而破坏细菌的细胞膜以达到抑菌效果,具有较强的广谱抗菌活性,且不易产生耐药性(Saleem et al.,2010;Tajbakhsh et al.,2018)。于海宁等(2014,2015)研究表明,采用化学方法合成的中华鳖cathelicidin成熟肽Ps-CATH4具有很强的抗菌活性,不易产生耐药性,细胞毒性低,且具有抑制炎症细胞因子释放等作用。cathelicidin除了具有抗微生物活性外,还参与宿主的抗炎症、结合内毒素、趋化作用、抑制组织损伤、促血管生成及伤口修复等各种防御性生理进程中(王晨等,2017;Chen et al.,2018)。例如猪cathelicidin PR-39可减轻由自由基引起的组织损伤,具有促血管生成及促创伤愈合等功能作用(Zanetti,2005);人源cathelicidin LL-37除了能诱导单核细胞和中性粒细胞等白细胞发生趋化运动外,还可调节先天性免疫和获得性免疫等(Chen et al.,2018)。【本研究切入点】目前,已有关于中华鳖cathelicidin基因序列的研究报道(于海宁等,2014),但针对黄沙鳖cathelicidin基因克隆及相关表达特征至今未见报道。【拟解决的关键问题】克隆黄沙鳖cathelicidin基因并采用实时荧光定量PCR检测其组织分布特征及在攻毒后的表达变化,为深入研究cathelicidin功能及在黄沙鳖先天免疫的潜在作用提供基础数据。
1 材料与方法
1. 1 试验材料
健康黄沙鳖购自广西武宣县某养鳖场,个体均重约45 g。经20 d的检疫饲养观察,确定无异常后用于细菌攻毒试验。攻毒试验采用的温和气单胞菌(Aeromonas sobria)WMG2菌株为广西水生动物病害诊断实验室于2015年分离自南宁市武鸣区患病黄沙鳖,攻毒试验前先进行生化鉴定和分子鉴定确认。TRIzol试剂购自Introvigen公司;TIANgel Midi Purification Kit试剂盒购自天根生化科技(北京)有限公司;MgC12、dNTPs、Taq DNA聚合酶、10×PCR缓冲液、DL1000 DNA Marker、pMD18-T载体Cloning Kit试剂盒、大肠杆菌DH5α感受态细胞、PrimeScript RT reagent Kit with gDNA Eraser试剂盒、SYBR Premix Ex Taq试剂盒和SMARTer RACE 5'/3' Kit试剂盒均购自TaKaRa公司;普通营养琼脂培养基购自北京陆桥技术股份有限公司。
1. 2 RNA提取及cDNA合成
按TRIzol试剂说明提取各样品总RNA,采用OD-1000分光光度计测定总RNA的纯度和浓度,-80 ℃保存备用。或以cDNA反转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser反转录合成cDNA。
1. 3 黄沙鳖cathelicidin基因克隆
以RT-PCR克隆黄沙鳖cathelicidin基因的中间片段。参考NCBI上已公布中华鳖等相近物种的cathelicidin基因序列,设计其中间片段的扩增引物cath-p-F和cath-p-R(表1),反应体系和扩增程序参照Taq DNA聚合酶说明书。同时采用RACE对黄沙鳖cathelicidin基因的5'端和3'端序列进行克隆。以已获得的黄沙鳖cathelicidin基因中间序列为基础,分别设计5'-RACE和3'-RACE特异性引物(表1),按SMARTer RACE 5'/3' Kit试剂盒说明克隆黄沙鳖cathelicidin基因的5'端和3'端序列。所有PCR产物经切胶回收纯化后,分别连接至pMD18-T载体上,再转化DH5α感受态细胞,经菌液PCR验证呈阳性的克隆送至广州华大生物科技有限公司测序。
将中间片段、5'端和3'端序列进行拼接后即获得黄沙鳖cathelicidin基因cDNA序列。利用ORF Finder找到黄沙鳖cathelicidin基因的开放阅读框(ORF)编码区。以1.2反转录合成的cDNA为模板、ORF-F和ORF-R(表1)为引物对黄沙鳖cathelicidin基因ORF进行扩增验证。
1. 4 生物信息学分析
采用DNASTAR和DNAMAN等生物信息学分析软件对黄沙鳖cathelicidin基因编码蛋白进行基本理化性质预测及其氨基酸序列同源性比对分析,使用SignalP 4.1进行蛋白信号肽预测,并以ClustalX和MEGA 5.0构建系统发育进化树。
1. 5 黄沙鳖cathelicidin基因组织分布特征及攻毒后的表达变化
1. 5. 1 黄沙鳖cathelicidin基因的组织分布特征 随机从3只健康黄沙鳖的脑组织、心脏、肝脏、肾脏、脾脏、肠道、肌肉、表皮和背甲中取样,每份取样0.1 g,加入TRIzol冷冻匀浆,然后提取各组织总RNA。每份样品取2.0 μL总RNA按照1.2反转录合成cDNA。设计实时荧光定量PCR引物cath-qPCR-F和cath-qPCR-R(表1),并以18S-F和18S-R作为内参基因18S rRNA的实时荧光定量PCR扩增引物(刘文婷等,2017)。根据SYBR Premix Ex Taq试剂说明进行实时荧光定量PCR检测,采用2-△△Ct法计算黄沙鳖cathelicidin基因的相对表达量(设脑组织中的cathelicidin基因相对表达量为1.00),并以SPSS 18.0中的Duncan’s新复极差法对黄沙鳖cathelicidin基因组织分布差异进行分析。
1. 5. 2 黄沙鳖cathelicidin基因攻毒后的表达变化
将WMG2菌株划线接种于普通营养琼脂培养基上,30 ℃培养18 h后用无菌生理盐水洗下菌落并稀释成菌悬液。根据预试验结果,采用麦氏比浊管结合活菌计数的方法将细菌浓度调整为106 CFU/mL。通过腹腔注射对健康黄沙鳖进行攻毒,试验组注射菌悬液(0.2 mL/只),对照组注射等量无菌生理盐水。攻毒后将不同处理组黄沙鳖置于不同养殖箱中,于注射后不同时间节点(0、3、6、12、24、36、48和72 h)分别随机取样(3只)进行剖解,取其脾脏置于液氮中保存或直接进行实时荧光定量PCR检测。采用 t 检验进行攻毒前后黄沙鳖cathelicidin基因表达变化差异分析。
2 结果与分析
2. 1 黄沙鳖cathelicidin基因克隆及序列分析结果
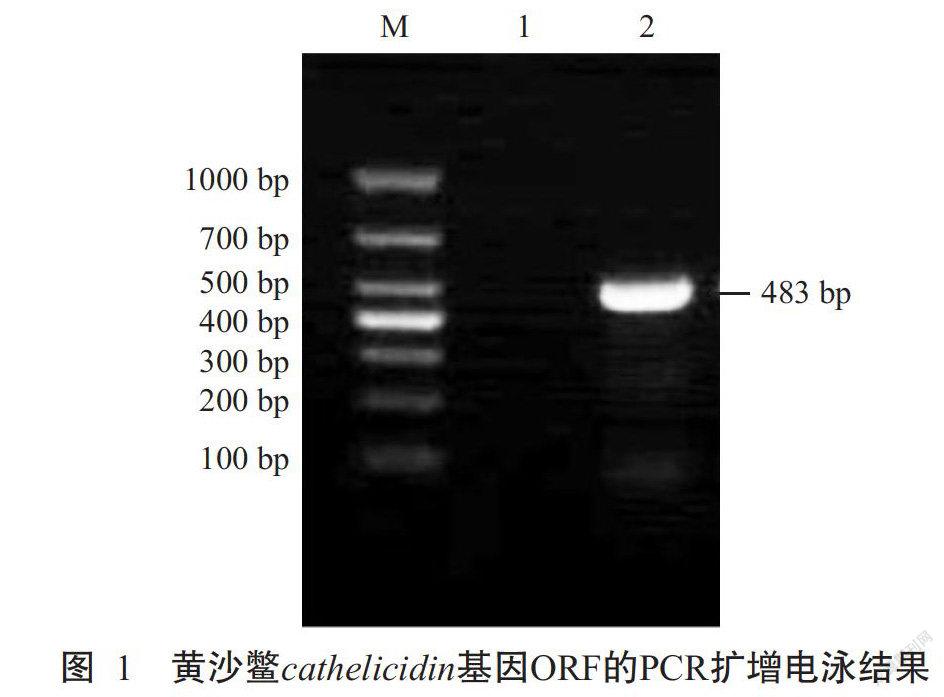
测序结果显示,黄沙鳖cathelicidin基因的中间序列长度为369 bp,5'端序列长度为805 bp,3'端序列长度为597 bp。经拼接后获得的cDNA序列全长为1026 bp。将黄沙鳖cathelicidin基因cDNA序列提交至GenBank,其登录号为MK250818。
黄沙鳖cathelicidin基因cDNA序列含有起始密码子ATG及3'端多聚腺苷酸化信号AATAAA和poly(A)尾结构,表明克隆得到的黄沙鳖cathelicidin基因核苷酸序列信息完整。黄沙鳖cathelicidin基因的ORF全长483 bp(图1),编码160个氨基酸,5'非编码区(5'UTR)长度为315 bp,3'非编码区(3'UTR)长度为228 bp(图2)。DNASTAR预测分析结果显示,cathelicidin成熟肽理论分子量为3913.63 Da,理论等电点(pI)为13.003。
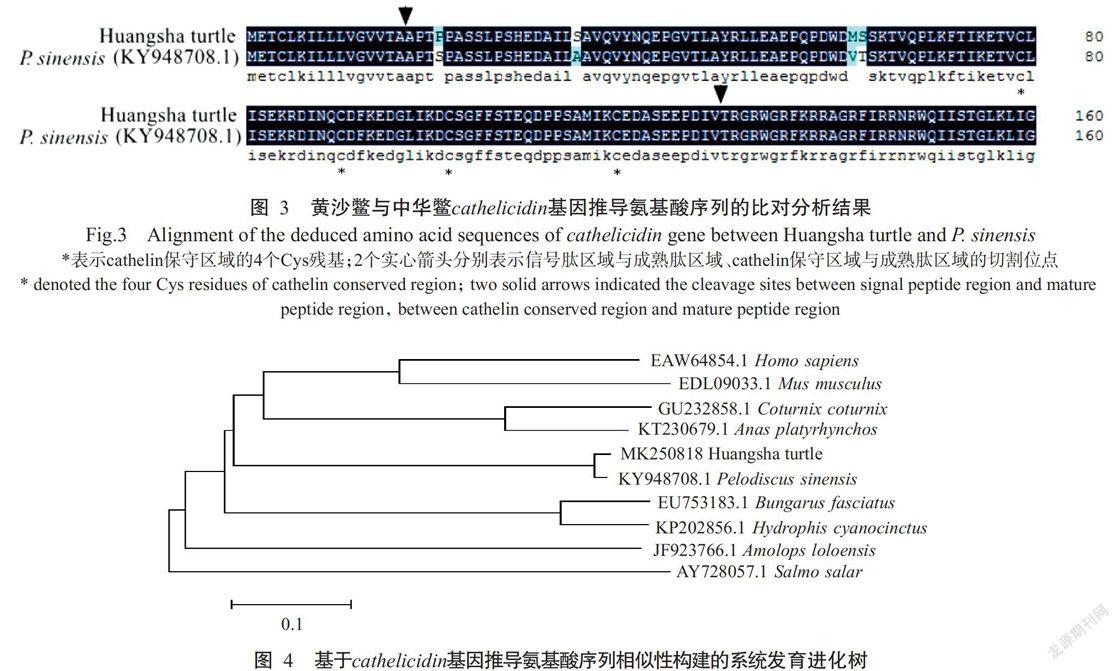
DNAMAN分析结果显示,黄沙鳖cathelicidin基因推导氨基酸序列与中华鳖cathelicidin基因推导氨基酸序列(KY948708.1)的相似性很高,具有相似的结构特征(图3),包括氨基端的信号肽区域、含有4个保守半胱氨酸(Cys)残基的cathelin区域及羧基端的成熟肽区域,进一步说明克隆得到的黄沙鳖cathelicidin基因属于Cathelicidins基因家族。
运用DNASTAR对黄沙鳖cathelicidin基因推导氨基酸序列与GenBank上已发布的其他物种cathelicidin基因推导氨基酸序列进行比对分析,结果显示黄沙鳖与中华鳖(KY948708.1)的相似性最高,为97.5%;与绿头鸭(Anas platyrhynchos,KT230679.1)、鹌鹑(Coturnix coturnix,GU232858.1)、金环蛇(Bungarus fasciatus,EU753183.1)、青环海蛇(Hydrophis cyanocinctus,KP202856.1)、人类(Homo sapiens,EAW 64854.1)、小鼠(Mus musculus,EDL09033.1)、棕点湍蛙(Amolops loloensis,JF923766.1)和大西洋鲑(Salmo salar,AY728057.1)的相似性依次为34.5%、30.8%、30.4%、29.7%、29.3%、29.0%、25.8%和19.4%。基于cathelicidin基因推导氨基酸序列相似性构建的系统发育进化树(图4)也显示,黄沙鳖与中华鳖的亲缘关系最近,再与绿头鸭、鹌鹑、人类、小鼠、金环蛇和青环海蛇聚为一簇,在進化关系上相对较近;而与棕点湍蛙和大西洋鲑的进化关系上相对较远,处于不同的分支上。
2. 2 黄沙鳖cathelicidin基因在不同组织中的表达情况
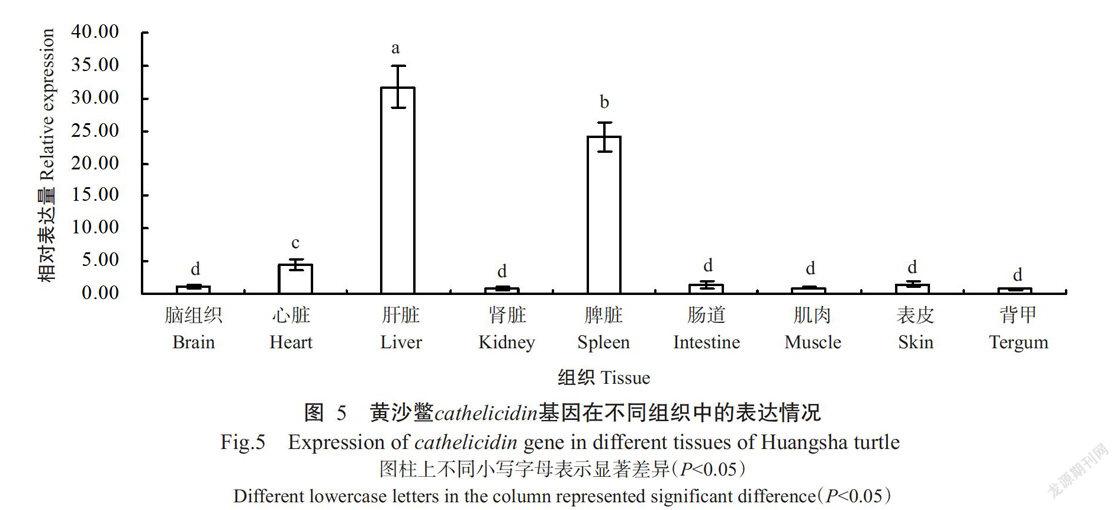
黄沙鳖cathelicidin基因在不同组织中的表达分布存在明显差异(图5),以在肝脏中的相对表达量最高,显著高于其他组织的相对表达量(P<0.05,下同);其次是脾脏,其相对表达量显著低于肝脏,但显著高于其他组织;在心脏中的相对表达量显著低于肝脏和脾脏,但显著高于在脑组织、肾脏、肠道、肌肉、表皮和背甲中的相对表达量;在脑组织、肾脏、肠道、肌肉、表皮和背甲的相对表达量较低,且各组织间差异不显著(P>0.05,下同)。
2. 3 黄沙鳖cathelicidin基因在攻毒后的表达模式
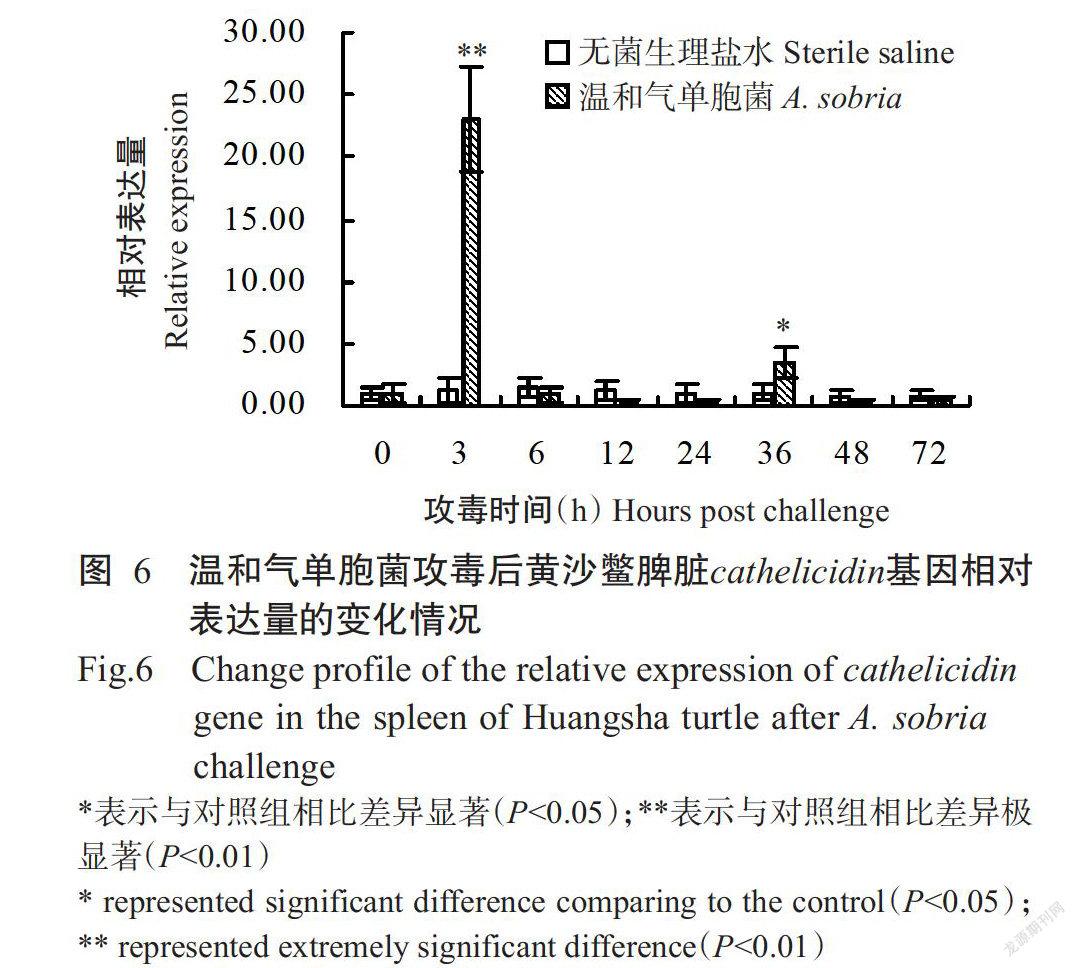
实时荧光定量PCR检测结果显示,对照组黄沙鳖脾脏cathelicidin基因的相对表达量无显著变化,始终维持在正常水平;试验组黄沙鳖在以温和气单胞菌攻毒后,其脾脏cathelicidin基因相对表达量呈升—降—升—降的波动变化趋势,出现2个峰值(图6)。第一个峰值出现在攻毒后第3 h,黄沙鳖cathelicidin基因相对表达量是对照组黄沙鳖的23.1倍,二者差异极显著(P<0.01);第二个峰值出现在攻毒后第36 h,对应的cathelicidin基因相对表达量是对照组黄沙鳖的3.5倍,二者差异显著。其他时间节点则表现为试验组黄沙鳖脾脏cathelicidin基因相对表达量与对照组黄沙鳖的差异均不显著。
3 讨论
近年来,许多研究证实了先天免疫系统在龟鳖抵抗病原侵袭过程中所发挥的关键作用,一些先天免疫因子如抗菌肽等已受到广泛关注(李思明等,2007;王婧,2018;Shi et al.,2018;Xu et al.,2018)。本研究克隆获得黄沙鳖cathelicidin基因的cDNA全长序列(GenBank登录号MK250818),该序列包含完整的ORF,编码160个氨基酸。黄沙鳖cathelicidin基因推导氨基酸序列与已报道其他物种cathelicidin氨基酸序列具有相似的结构特征,包括信号肽区域、保守的cathelin区和羧基端的成熟肽区域(殷梦光,2015),进一步说明本研究克隆获得的黄沙鳖cathelicidin基因属于Cathelicidins基因家族。基于cathelicidin基因推导氨基酸序列相似性构建的系统发育进化树显示,黄沙鳖与中华鳖的亲缘关系最近,由同一个分支进化而来。由于不同物种的cathelicidin成熟肽具有多样性,因此黄沙鳖cathelicidin基因与除中华鳖外其他物种间的相似性均不高(19.4%~34.5%),即cathelicidin的进化关系与物种进化顺序基本一致(广慧娟,2013)。
本研究结果表明,黄沙鳖cathelicidin基因在脾脏和肝脏的相对表达量较高,其次是心脏,在脑组织、肾脏、肠道、肌肉、表皮和背甲的相对表达量较低。综合其他学者的研究结果,发现cathelicidin基因在不同物种的组织表达分布情况具有多样性。黑眶蟾蜍(Bufo melanostictus)cathelicidin基因在皮肤、肝脏、脾脏、大肠、小肠和卵巢中均有表达,其中在脾脏和大肠中的表达量较高(王梅,2015);细鳞鱼(Brachymystax lenok)cathelicidin基因在各组织中的表达量排序为鳃>脾脏>肝脏>肌肉>小肠(厉政,2013)。关于鸡(Gallus gallus)的3种cathelicidins基因(CATH-1、CATH-2和CATH-3),CATH-1在脾脏、输卵管和大肠的表达量最高,其次是十二指肠、肝脏、心脏、睾丸和肾脏;CATH-2在胃脏、脾脏、输卵管和大肠表达量最高,其次是十二指肠、心脏、肾脏、睾丸和肝脏;CATH-3在大肠和脾脏表达量最高,其次是心脏和肾脏,其他组织则未检测到CATH-3的表达(Yacoub et al.,2016)。可见,cathelicidin基因在不同物种的淋巴器官(脾脏)中均具有较高的表达量,即与机体免疫系统密切相关。
经温和气单胞菌攻毒后,黄沙鳖脾脏cathelicidin基因相对表达量的2个峰值分别出现在攻毒后第3和36 h。袁旦一(2013)研究表明,以维氏气单胞菌(Aeromonas veronii)经腹腔注射感染斑点叉尾鮰(Ietalurus punetaus),2 h后即可从其脾脏中检测到维氏气单胞菌,且脾脏、肾脏和肝脏为最主要的感染靶器官。因此,推测温和气单胞菌经腹腔注射感染黄沙鳖后,可在3 h内通过血液循环入侵脾脏,并迅速诱导脾脏cathelicidin基因上调表达。攻毒后,黄沙鳖脾脏cathelicidin基因相对表达量呈升—降—升—降的波动变化趋势,出现2个峰值,与Broekman等(2013)关于帝王鲑(Oncorhynchus tshawytscha)cathelicidin基因的研究结果相似。究其原因可能是:(1)cathelicidin基因在攻毒后第3和36 h的表达峰值分别由不同转录因子调节诱导所造成;(2)脾脏细胞具有某种负反馈循环调节机制以保护细胞免受高浓度抗菌肽的破坏(Broekman et al.,2013;王慧等,2018)。黄沙鳖脾脏cathelicidin基因的表达能响应温和气单胞菌诱导,说明cathelicidin基因在黄沙鳖抵抗病原感染过程中发挥重要作用。
本研究结果表明,黄沙鳖cathelicidin基因推导氨基酸序列的成熟肽区域含有9个精氨酸(Arg)残基,即含有较多的阳离子氨基酸残基,由于这些残基易吸引带负电荷的细菌细胞膜并与之相互作用而达到抗菌效果(Saleem et al.,2010),据此推测黄沙鳖cathelicidin成熟肽可能是一种活性较强的抗菌肽。至今,已有不少学者通过天然提纯、化学合成及生物工程表达等方法获得cathelicidin成熟肽产物,如金环蛇cathelicidin-BF(Wang et al.,2008)、环颈雉(Phasianus colchicus)cathelicidin(Wang et al.,2011)、脆皮大头蛙(Limnonectes fragilis)Lf-CATH1a重组成熟肽(广慧娟,2013)等,且均具有一定抗菌效果。于海宁等(2014,2015)采用化学合成方法获得的中华鳖cathelicidin成熟肽Ps-CATH4,并证实其具有很强的抗菌活性,不易产生耐药性,细胞毒性低,还能抑制炎症因子释放而具有抗炎症作用。可见,本研究克隆获得的黄沙鳖cathelicidin基因cDNA序列可為基因工程表达抗菌肽提供基础,也将为有效控制黄沙鳖细菌性疾病提供新的途径。
4 结论
黄沙鳖cathelicidin基因在脾脏和肝脏中高表达量,且可被温和气单胞菌感染诱导,说明cathelicidin基因在黄沙鳖抵抗病原感染过程中发挥重要作用。
参考文献:
广慧娟. 2013. 脆皮大头蛙Cathelicidins基因克隆、表达及结构与功能分析[D]. 大连:大连理工大学. [Guang H J. 2013. Gene cloning,expression and structure and functional characterization of cathelicidins from Limnonectes fragilis[D]. Dalian:Dalian University of Technology.]
黄雪贞,钱国英,李彩燕. 2012. 中华鳖3个地理群体线粒体基因D-loop区遗传多样性分析[J]. 水产学报,36(1):17-24. [Huang X Z,Qian G Y,Li C Y. 2012. The genetic diversity of mitochondrial DNA D-loop region of three geographical populations in Trionyx sinensis[J]. Journal of Fisheries of China,36(1):17-24.]
赖春华,李军生,廖永聪,廖诚珍,谢志扬. 2011. 黄沙鳖与中华鳖肌肉氨基酸的分析及评价[J]. 食品工业科技,32(5):373-374. [Lai C H,Li J S,Liao Y C,Liao C Z,Xie Z Y. 2011. Analysis and evaluation on amino acids of muscles of Chinese yellow sand soft-shelled turtle and Trionyx sinensis[J]. Science and Technology of Food Industry,32(5):373-374.]
李思明,歐阳玲花,周定刚,温安祥,韦启鹏,刘林秀,邹志恒. 2007. 鳄龟不同组织抗菌肽粗提物的初步研究[J]. 江西农业学报,19(4):77-78. [Li S M,Ouyang L H,Zhou D G,Wen A X,Wei Q P,Liu L X,Zou Z H. 2007. Prmiary research on antimicrobial peptides from Chelydra serpentina[J]. Acta Agriculturae Jiangxi,19(4):77-78.]
厉政. 2013. 细鳞鱼Cathelicidins的鉴定及宿主防御肽CATH_BRALE的结构与功能分析[D]. 大连:大连理工大学. [Li Z. 2013. Identification of cathelicidins,structu-ral and functional characterization of CATH_BRALE,the defense molecule in the ancient salmonoid,Brachymystax lenok[D]. Dalian:Dalian University of Technology.]
刘文婷,张贝贝,张耀红,管越强. 2017. 中华鳖实时定量PCR内参基因的筛选与评价[J]. 内蒙古大学学报(自然科学版),48(5):531-537. [Liu W T,Zhang B B,Zhang Y H,Guan Y Q. 2017. Screening and evaluation of qPCR re-ference genes in Pelodiscus sinensis[J]. Journal of Inner Mongolia University(Natural Science Edition),48(5):531-537.]
农新闻,黄艳华,龙苏,梁静真,牛志伟,刘杰,米强,黄钧. 2015. 黄沙鳖致病性温和气单胞菌的分离鉴定及其毒力基因检测[J]. 南方农业学报,46(7):1322-1328. [Nong X W,Huang Y H,Long S,Liang J Z,Niu Z W,Liu J,Mi Q,Huang J. 2015. Isolation,identification and virulence gene detection of pathogenic Aeromonas sobria from Truogx sinensis[J]. Journal of Southern Agriculture,46(7):1322-1328.]
王晨,冯兰,于海宁,王义鹏. 2017. Cathelicidins结构与功能的关系及其分子设计研究进展[J]. 生物工程学报,33(1):27-35. [Wang C,Feng L,Yu H N,Wang Y P. 2017. Relationship between structure and function of cathelicidins and their molecular design:A review[J]. Chinese Journal of Biotechnology,33(1):27-35.]
王慧,杨文佳,骆建林,李国勇,张婷,白禹,李灿. 2018. 大鲵抗菌肽基因KK1/KK5/KK8对嗜水气单胞菌的侵染响应[J]. 南方农业学报,49(8):1627-1632. [Wang H,Yang W J,Luo J L,Li G Y,Zhang T,Bai Y,Li C. 2018. Response of Andrias davidianus antimicrobial peptide genes to infection of Aeromonas hydrophila[J]. Journal of Sou-thern Agriculture,49(8):1627-1632.]
王婧,刁小龙,陈晓兰,王帅兵,陈海峰,张龙. 2018. 抗菌肽Indolicidin的研究进展[J]. 江苏农业学报,34(4):949-954. [Wang J,Diao X L,Chen X L,Wang S B,Chen H F,Zhang L. 2018. Research progress of antibacteial peptides Indolicidin[J]. Jiangsu Journal of Agricultural Scien-ces,34(4):949-954.]
王梅. 2015. 黑眶蟾蜍抗菌肽cathelicidin-DM的基因克隆、组织表达及结构与功能的分析[D]. 昆明:昆明理工大学. [Wang M. 2015. Gene cloning,expression,structure and functional cathelicidin-DM from Duttaphrynus melahos-tictus[D]. Kunming:Kunming University of Science and Technology.]
殷梦光. 2015. 合江棘蛙(Paa robertingeri)Cathelicidin家族抗菌肽的基因克隆、结构与生物功能研究[D]. 贵阳:贵州师范大学. [Yin M G. 2015. Cloning,structure and biological function analysis of Cathelicidins from Paa robertihgeri[D]. Guiyang:Guizhou Normal University.]
于海宁,王义鹏,乔雪,蔡莎莎. 2014. 一种源于中华鳖的抗微生物肽及其基因、制备方法和应用:中国,CN103936845A[P]. 2014-07-23. [Yu H N,Wang Y P,Qiao X,Cai S S. 2014. An antimicrobial peptide from Pelodiscus sinensis and its gene,preparation method and application:China,CN103936845A[P]. 2014-07-23.]
于海寧,王义鹏,乔雪,鲁一灵,王晨. 2015. 中华鳖Cathelicidin—Ps-CATH4肽在制备抗炎症药物中的应用:中国,CN104725499A[P]. 2015-06-24. [Yu H N,Wang Y P,Qiao X,Lu Y L,Wang C. 2015. Application of Ps-CATH4, Cathelicidin of Pelodiscus sinensis in preparation of anti-inflammatory drug:China,CN104725499A[P]. 2015-06-24.]
袁旦一. 2013. 维氏气单胞菌感染斑点叉尾鮰的动态病理学研究[D]. 成都:四川农业大学. [Yuan D Y. 2013. Dynamic pathologic study of Ictalurus punctatus (channel catfish) infected with Aeromonas veronii[D]. Chengdu:Sichuan Agricultural University.]
张东玲,喻达辉. 2015. 日本鳗鲡I型Cathelicidin基因的克隆与原核表达[J]. 生物技术通报,31(7):124-131. [Zhang D L,Yu D H. 2015. Cloning and prokaryotic expression of Cathelicidin gene from Japanese eel I,Anguilla japonic[J]. Biotechnology Bulletin,31(7):124-131.]
张秋明,何捷,潘喜玲. 2010. 广西黄沙鳖养殖现状与发展对策[J]. 中国水产,(4):18-19. [Zhang Q M,He J,Pan X L. 2010. Current situation and development strategy of cultivation for Truogx sinensis in Guangxi[J]. China Fishe-ries,(4):18-19.]
周吴萍,赖春华,廖永聪,廖诚珍,谢志扬,李军生. 2012. 广西养殖黄沙鳖营养品质研究[J]. 食品研究与开发,33(3):178-181. [Zhou W P,Lai C H,Liao Y C,Liao C Z,Xie Z Y,Li J S. 2012. Study on nutrient quality of farmed Chinese yellow sand soft-shelled turtle in Guangxi[J]. Food Research and Development,33(3):178-181.]
Broekman D C,Guðmundsson G H,Maier V H. 2013. Diffe-rential regulation of cathelicidin in salmon and cod[J]. Fish and Shellfish Immunology,35(2):532-538.
Chen X,Zou X Q,Qi G Y,Tang Y,Guo Y,Si J,Liang L. 2018. Roles and mechanisms of human cathelicidin LL-37 in cancer[J]. Cellular Physiology and Biochemistry,47(3):1060-1073.
Lehrer R I,Ganz T. 2002. Cathelicidins:A family of endogenous antimicrobial peptides[J]. Current Opinion in Hematology,9(1):18-22.
Saleem M,Nazir M,Ali M S,Hussain H,Lee Y S,Riaz N,Jabbar A. 2010. Antimicrobial natural products:An update on future antibiotic drug candidates[J]. Natural Pro-duct Reports,27(2):238-254.
Shi Y,Shen S,Hu S,Ding T,Hong X,Chen C,Zhu X,Zhao Z. 2018. Comparative study of two immunity-related GTPase genes in Chinese soft-shell turtle reveals their molecular characteristics and functional activity in immune defense[J]. Developmental and Comparative Immunology,81:63-73.
Tajbakhsh M,Karimi A,Tohidpour A,Abbasi N,Fallah F,Akhavan M M. 2018. The antimicrobial potential of a new derivative of cathelicidin from Bungarus fasciatus against methicillin-resistant Staphylococcus aureus[J]. Journal of Microbiology,56(2):128-137.
Wang Y P,Hong J,Liu X H,Yang H L,Liu R,Wu J,Wang A L,Lin D H,Lai R. 2008. Snake cathelicidin from Bungarus fasciatus is a potent peptide antibiotics[J]. PLoS One,3(9):e3217.
Wang Y P,Lu Z K,Feng F F,Zhu W,Guang H J,Liu J Z,He W Y,Chi L L,Li Z,Yu H N. 2011. Molecular clo-ning and characterization of novel cathelicidin-derived myeloid antimicrobial peptide from Phasianus colchicus[J]. Developmental and Comparative Immunology,35(3):314-322.
Xu H,Zhao J,Zou Y,Lu B,Chen H,Zhang W,Wu Y,Yang J. 2018. Identification,characterization and expression analysis of MAVS in Pelodiscus sinensis after challenge with Poly I:C[J]. Fish and Shellfish Immunology,77:222-232.
Yacoub H A,Elazzazy A M,Mahmoud M M,Baeshen M N,Al-Maghrabi O A,Alkarim S,Ahmed E S,Almehdar H A,Uversky V N. 2016. Chicken cathelicidins as potent intrinsically disordered biocides with antimicrobial activity against infectious pathogens[J]. Developmental and Comparative Immunology,65:8-24.
Zanetti M. 2005. The role of cathelicidins in the innate host defenses of mammals[J]. Current Issues in Molecular Bio-logy,7(2):179-196.
(責任编辑 兰宗宝)
