广西巴马小型猪miR-148b慢病毒制备及靶基因通路预测分析
2019-09-10张名媛郭晓萍孙晴超司景磊兰干球郭亚芬蒋钦杨
张名媛 郭晓萍 孙晴超 司景磊 兰干球 郭亚芬 蒋钦杨

摘要:【目的】构建广西巴马小型猪miR-148b慢病毒表达载体并对其靶基因进行预测及相关通路分析,为揭示miR-148b的作用机制打下基础。【方法】以广西巴马小型猪血液基因组DNA为模板,扩增miR-148b的前体及部分侧翼序列,使用T4连接酶将目的片段连接至pLV-CMV-MCS-EF1载体上,构建获得pLV-miR-148b慢病毒表达载体;以pLV-miR-148b慢病毒表达载体转染293T细胞48 h后进行表达验证;利用miRDB、miRWalk 2.0和TargetScan 7.2三大数据库预测分析广西巴马小型猪miR-148b的靶基因,并以MirPath v.3分析miR-148b靶基因相关通路。【结果】广西巴马小型猪miR-148b片段大小为385 bp,与miRBase 21.0网站上已发布猪miR-148b成熟序列(前体和侧翼序列)的同源性达100%。构建获得的pLV-miR-148b慢病毒表达载体能在293T细胞中成功表达,且相对表达量极显著高于pLV-GFP慢病毒空载质粒转染组(P<0.01)。数据库预测分析得到18个广西巴马小型猪miR-148b的靶基因,分别为CLOCK(时间昼夜调控因子)、MIER1(转录调控因子)、MECP2(甲基化CpG结合蛋白)、ZNF704(锌指蛋白)、SPTY2D1(SPT2染色质蛋白)、QKI(RNA结合蛋白)、ZBTB20(锌指蛋白)、MGAT4A(钠/磷酸转运蛋白)、UHMK1(编码蛋白激酶)、PIK3C2A(磷酸肌醇-3-激酶2α肽)、C6orf62(6号染色体开放阅读框62抗体)、HECW2(E3泛素蛋白连接酶)、MAP1B(微管相关蛋白)、NHS(NHS肌动蛋白调节因子)、B4GALT6(β-1,4-半乳糖基转移酶)、ATP2A2(肌浆ATP酶/内质网Ca2+转运酶)、AP4E1(蛋白复合物接头分子)和BBX(锌指蛋白);且发现有11条靶基因相关通路,其中与疾病相关的通路有脂肪酸合成通路、细胞外基质受体相互作用通路、癌症的蛋白聚糖通路、神经胶质瘤通路、癌症的小分子核糖核酸通路、肾细胞癌通路、N-聚糖生物合成通路和致心律失常性右室心肌病通路。【结论】广西巴马小型猪miR-148b慢病毒表达载体能在293T细胞中成功表达,miR-148b存在18个靶基因和11条相关通路,且主要在脂肪酸合成、N-聚糖生物合成及致心律失常性右室心肌病等相关疾病通路上发挥作用。
关键词: 广西巴马小型猪;miR-148b;慢病毒载体;靶基因;相关通路预测
0 引言
【研究意义】microRNA(miRNA)的发现对药物研发和基础生物医学研究领域产生了巨大影响。miRNA作为一种非编码RNA,是一类进化保守的单链小分子RNA,其长度一般在19~23 nt,调控50%左右的蛋白编码基因,且被证实与很多疾病有关。miR-148是一种新发现的miRNA,属于miR-148/152家族,其家族包括miR-148a、miR-148b和miR-152。miR-148/152家族各成员在很多肿瘤疾病中存在差异表达,肿瘤的生长、增殖、凋亡、血管新生及对药物的敏感性等生物学功能均受其调控影响(王晓雪等,2015)。广西巴马小型猪具有体型矮小、遗传相似性高、与人类相近且遗传稳定性强等特点,是作为相关疾病模型研究的理想实验材料(宋少锐等,2014;张广杰等,2018;黄叶等,2019),因此,制备广西巴马小型猪miR-148b慢病毒表达载体,并对其靶基因进行预测及相关通路分析,可为揭示miR-148b的作用机制打下基础。【前人研究进展】miR-148a、miR-148b和miR-152因具有相同的种子序列(UCAGUGCA)而被归为同一家族,即miR-148/152家族,具有相近的结构和功能(王晓雪等,2015)。其中,Pre-miRNA 148a定位于基因组7p15.2,属于基因间miRNA,其长度为68 nt;Pre-miRNA 148b定位于基因组12q13.13,为内含子miRNA,长度为99 nt。在大多数肿瘤细胞中,miR-148a通常呈低表达状态(Linhart et al.,2007),如在肝癌细胞SMMC-7721的侵袭和迁移过程中,miR-148a对此具有负调控作用(贾筱琴等,2014)。在胃癌组织中,miR-148a/b起到抑癌基因的作用,因启动子区域的CpG岛异常甲基化而失活,导致其在胃癌组织中呈低表达状态(居峰等,2013)。Chen等(2010)、Ueda等(2010)、Zheng等(2011)研究表明,在体外试验中上调miR-148a/b表达能显著抑制胃癌细胞的迁移能力。李国喜等(2013)研究发现,在鸡胚发育过程中miR-148a的表达呈时序性,且其表达集中在出壳后的发育过程中,为广泛性表达,调控着诸多器官组织的生长发育。居峰等(2013)研究证实miR-148a的甲基化状态与DNA甲基转移酶I(DNMT1)呈正相关。DNA甲基转移酶(DNMTs)是导致CpG岛异常甲基化的重要因素,目前所知的DNMTs可分为DNMT1和DNMT3两种,其中,DNMT1与甲基化的形成有关,DNMT3则参与甲基化状态的维持(Okano et al.,1999;Ooi et al.,2007)。关于miR-148b的研究,发现其与多种癌症相关,如血液恶性肿瘤(王晓雪等,2015)、肝癌(谭翠和莫春容,2016)、乳腺癌(Chen et al.,2018)、胃癌(Li et al.,2018)和腎癌(Zhang et al.,2018)等。王晓雪等(2017)研究表明,miR-148b在急性髓系白血病患者及细胞系中的表达水平较正常对照显著降低,主要发挥抑癌基因表达的作用。此外,谭翠和莫春容(2016)研究显示miR-148b通过靶向调控双特异性磷酸酶1(DUSP1)影响细胞因子CD206的分泌,进而参与肝癌的发生发展过程。【本研究切入点】目前,国内外研究均表明miR-148/152家族在一些生物的肿瘤性疾病中发挥着抑癌基因作用,或在生物的器官发育过程中起调节作用,但至今鲜见以广西巴马小型猪为动物模型研究miR-148b抑制肿瘤发生发展作用机理的相关报道。【拟解决的关键问题】以广西巴马小型猪为研究对象,构建pLV-miR-148b慢病毒表达载体,验证miR-148b在293T细胞中的表达情况,并对其靶基因进行预测及相关通路分析,为揭示miR-148b的作用机制打下基础。
1 材料与方法
1. 1 试验材料
广西巴马小型猪血液样品和293T细胞由广西大学动物遗传育种实验室保存提供;pCDH-CMV-MCS-EF1慢病毒载体购自美国SBI公司;血液DNA提取试剂盒、SYBR® Prime ScriptTM miRNA RT-PCR Kit、限制性内切酶、pMD19-T载体和T4连接酶购自日本TaKaRa公司;去内毒素质粒试剂盒和胶回收试剂盒均购自美国OMEGA公司;大肠杆菌Trans5α感受态细胞购自北京全式金生物技术有限公司;LTX转染试剂、PBS、胎牛血清、DMEM和胰酶购自美国Life公司。
1. 2 引物设计与合成
参照miRBase 21.0网站(http://www.mirbase.org)已公布的猪miR-148b成熟序列(前体和侧翼序列),根据miRNA引物设计原则,利用Oligo 7.0设计引物(miR-148b-F:5'-GAATTCTCCTTTGCAGTAG GCTCGTT-3'和miR-148b-R:5'-GGATCCCAATGG ACTAGGCTTGACCTT-3'),同时设计miRNA定量特异性引物5'-GTCAGTGCATCACAGAACTTTGT AA-3'。所有引物委托深圳华大基因科技有限公司合成。
1. 3 miR-148b克隆
使用血液DNA提取试剂盒提取广西巴马小型猪血液DNA,以血液DNA为模板扩增miR-148b(前体和部分侧翼序列)。PCR反应体系20.0 μL:2×Ex Taq PCR Master Mix 10.0 μL,DNA模板3.0 μL,上、下游引物各0.5 μL,Free water(自由水)补足至20.0 μL。扩增程序:94.0 ℃预变性2 min;94.0 ℃ 15 s,62.4 ℃ 15 s,72.0 ℃ 30 s,进行30个循环;72.0 ℃延伸5 min。扩增产物以2.0%琼脂糖凝胶电泳进行检测,胶回收纯化后连接至pMD19-T载体,再转化Trans5α感受态细胞,扩增菌液并进行PCR鉴定,提取质粒进行酶切鉴定。将阳性菌液分别送至生工生物工程(上海)股份有限公司和深圳华大基因科技有限公司进行测序。
1. 4 pLV-miR-148b慢病毒表达载体构建及鉴定
将pLV-CMV-MCS-EF1空载质粒和pMD19-miR- 148b阳性菌质粒进行EcoRⅠ和BamHⅠ双酶切线性化处理,经1.0%琼脂糖凝胶电泳检测后胶回收纯化片段,用T4连接酶将miR-148b连接至pLV-CMV-MCS-EF1载体上,然后转化Trans5α感受态细胞,挑取单个阳性菌落扩菌培养并进行鉴定,重组质粒命名为pLV-miR-148b。采用双酶切鉴定和菌液PCR验证重组质粒是否能成功表达,同时送至深圳华大基因科技有限公司进行测序。
1. 5 miR-148b在293T细胞中过表达验证
第1 d(细胞转染前24 h)将复苏293T细胞以每孔1×105个/mL的密度培养于6孔细胞培养板中;第2 d待293T细胞汇合度达60%~80%时,用LTX转染试剂将pLV-GFP慢病毒空载质粒和pLV-miR-148b慢病毒重组质粒分别转染293T细胞,于转染后48 h观察293T细胞的绿色荧光表达情况,并拍照和记录。
1. 6 实时荧光定量PCR(qPCR)鉴定
收集上述阳性细胞,提取细胞RNA,根据mi-RNA反转录试剂盒说明反转录合成cDNA,再以稀释后的cDNA为模板进行qPCR验证。反应体系如下:2×SYBR® Premix Ex TaqTM 10.0 μL,ddH2O 4.2 μL,miR-486上游引物0.4 μL,通用下游引物0.4 μL,cDNA模板5.0 μL。扩增程序:95 ℃预变性5 min;95 ℃ 10 s,60 ℃ 30 s,进行40个循环,扩增读取荧光信号;95 ℃ 1 s,65 ℃ 1 min,读取熔解曲线。采用2-ΔΔCt法计算miR-148b的相对表达量。
1. 7 miR-148b靶基因預测
利用miRDB、miRWalk 2.0和TargetScan 7.2三大数据库分析miR-148b的靶向基因,并整合提交至Bioinformatics & Evolutionary Genomics分析网站,预测miR-148b靶基因。
1. 8 miR-148靶基因相关通路分析
使用DIANA Tools中的MirPath v.3分析miR-148b靶基因相关通路,分析通路间的差异以获得更可靠的miR-148b疾病相关通路,再进行Show Heatmap分析以获得通路间热图。
2 结果与分析
2. 1 广西巴马小型猪miR-148b扩增结果
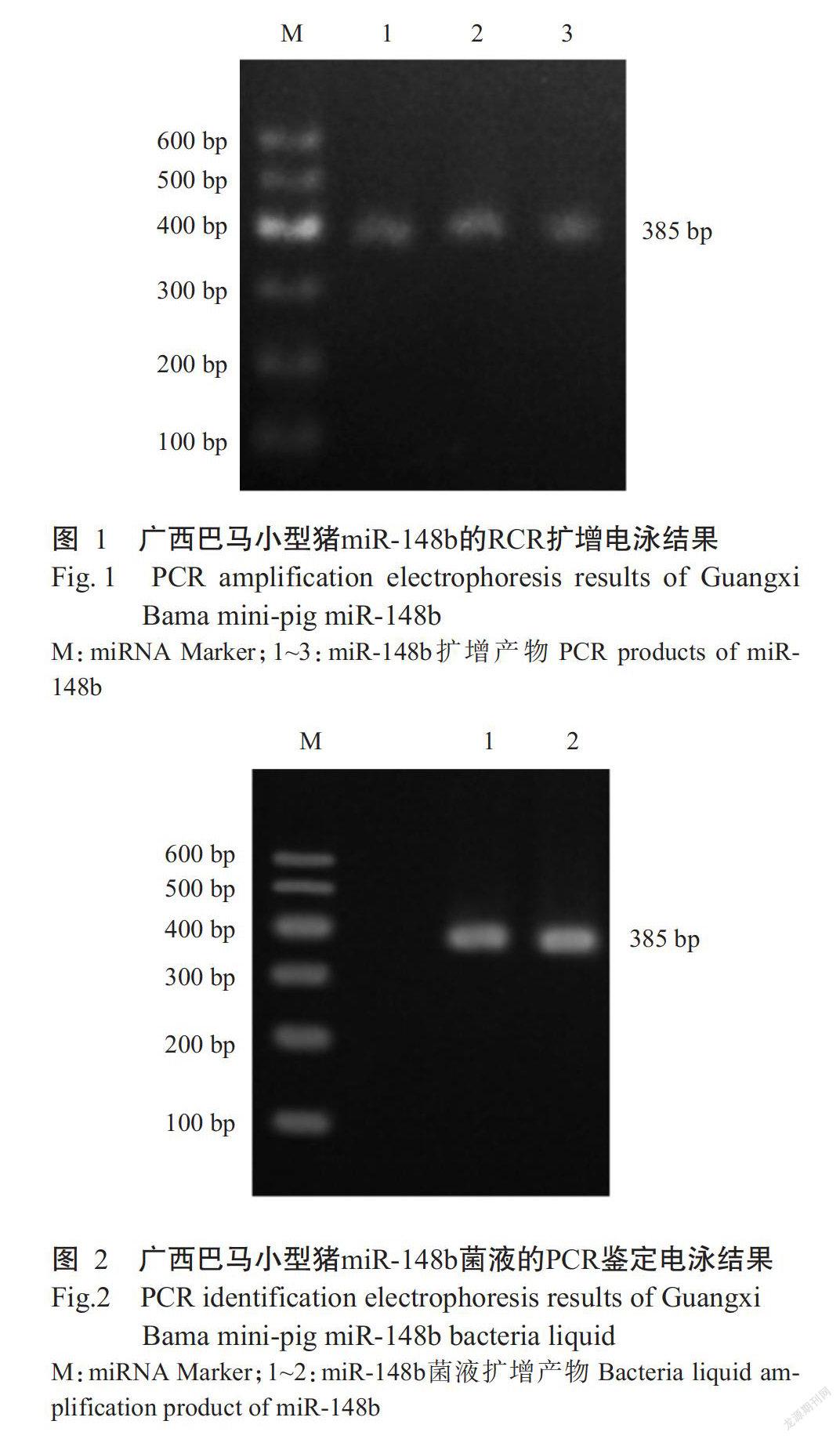
以广西巴马小型猪血液DNA为模板,成功扩增出miR-148b的前体及部分侧翼序列,电泳条带清晰,目的片段大小约400 bp(图1),与预期结果一致。miR-148b的菌液PCR鉴定结果也显示,扩增获得的目的条带清晰且大小正确(图2),可用于后续研究。生工生物工程(上海)股份有限公司和深圳华大基因科技有限公司的测序结果均表明成功扩增获得广西巴马小型猪miR-148b,其片段大小为385 bp。
2. 2 pLV-miR-148b慢病毒表达载体验证结果
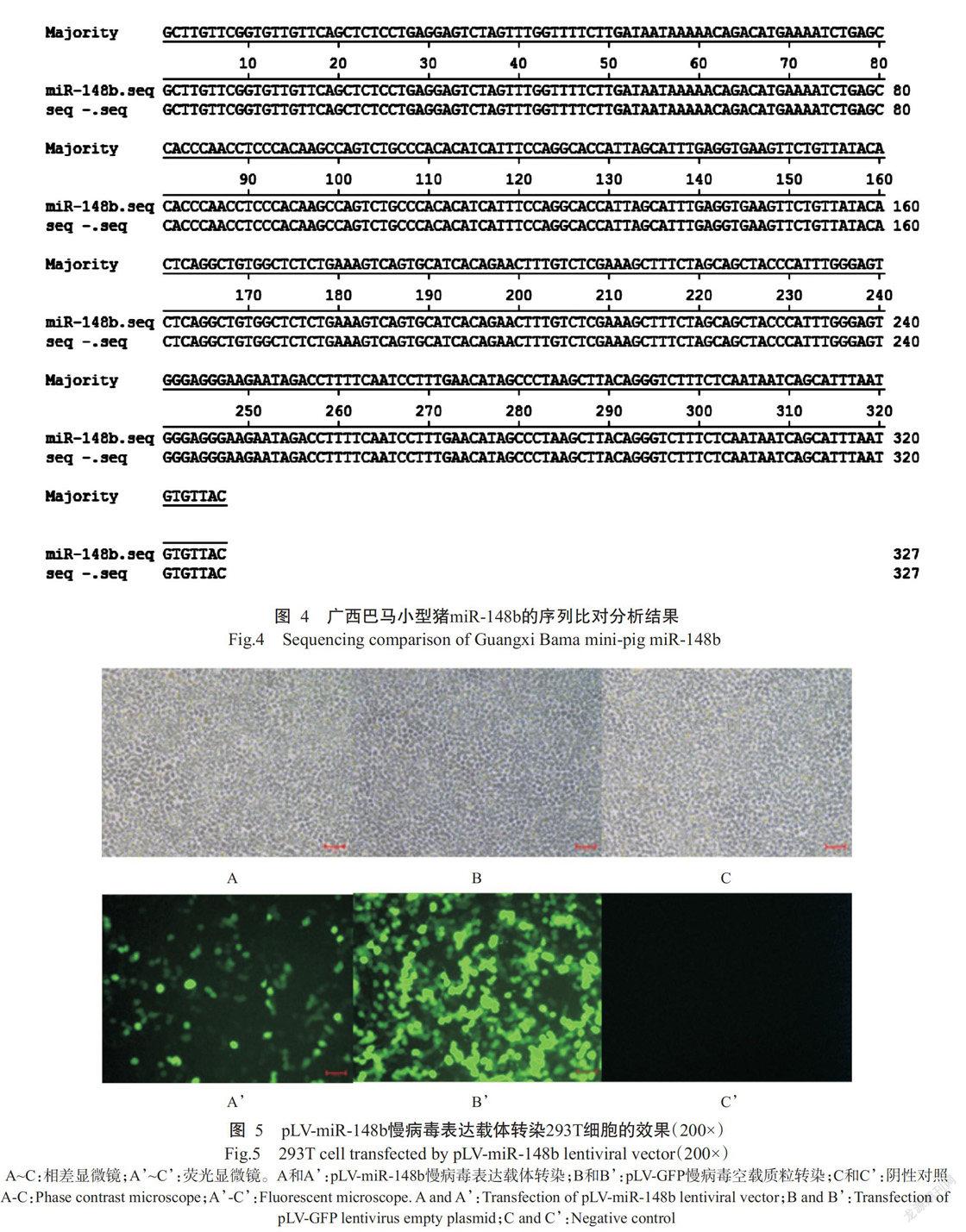
构建的pLV-miR-148b慢病毒表达载体经双酶切鉴定,获得两条清晰且大小位置均正确的目的条带,其中广西巴马小型猪miR-148b的片段大小为385 bp(图3),说明pLV-miR-148b慢病毒表达载体构建成功。将pLV-miR-148b慢病毒表达载体的测序结果提交至miRBase 21.0网站进行序列比对分析,结果(图4)发现广西巴马小型猪miR-148b与miRBase 21.0网站上已发布猪miR-148b成熟序列(前体和侧翼序列)的同源性达100%。
2. 3 pLV-miR-148b慢病毒表达载体在293T细胞中的表达情况
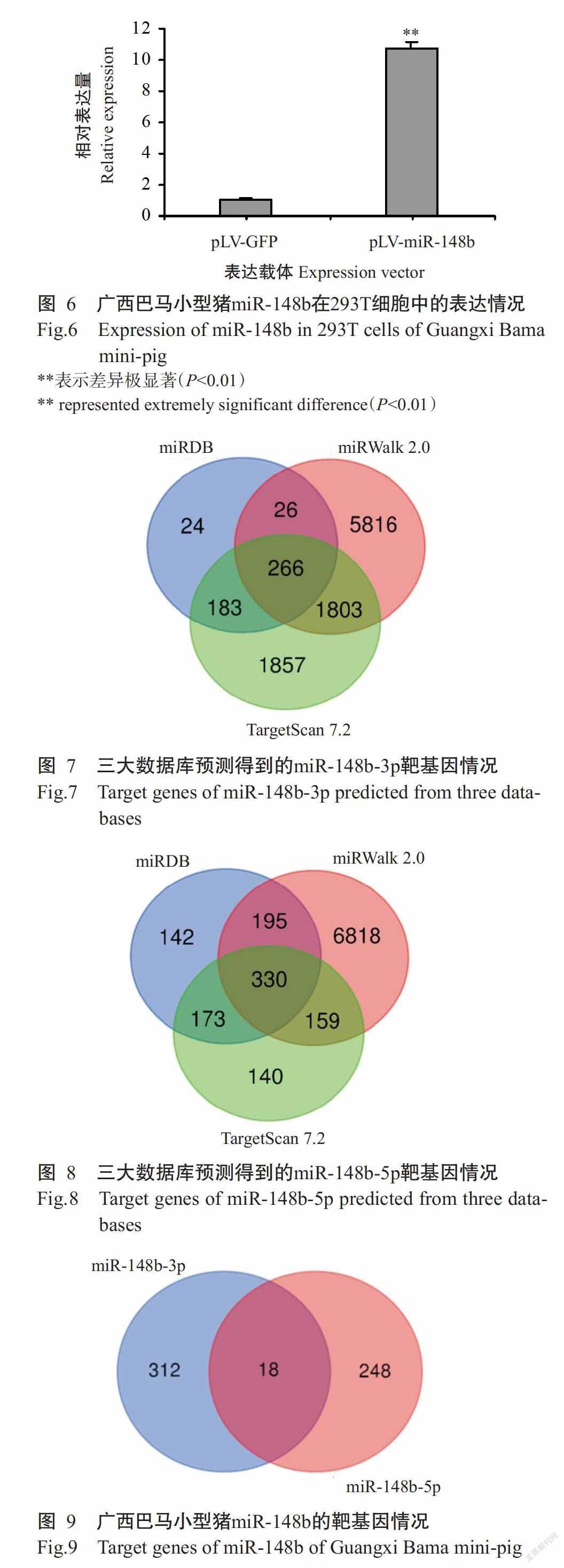
以pLV-miR-148b慢病毒表达载体和pLV-GFP慢病毒空载质粒分别转染293T细胞48 h后,荧光显微镜下均能观察到293T细胞中有绿色荧光表达,而阴性对照组未观察到绿色荧光(图5)。说明构建的pLV-miR-148b慢病毒表达载体能在293T细胞中成功表达。同时利用qPCR检测293T细胞中miR-148b的表达情况,结果(图6)显示,pLV-miR-148b慢病毒表达载体转染组的相对表达量极显著高于pLV-GFP慢病毒空载质粒转染组(P<0.01)。
2. 4 广西巴马小型猪miR-148b靶基因预测结果
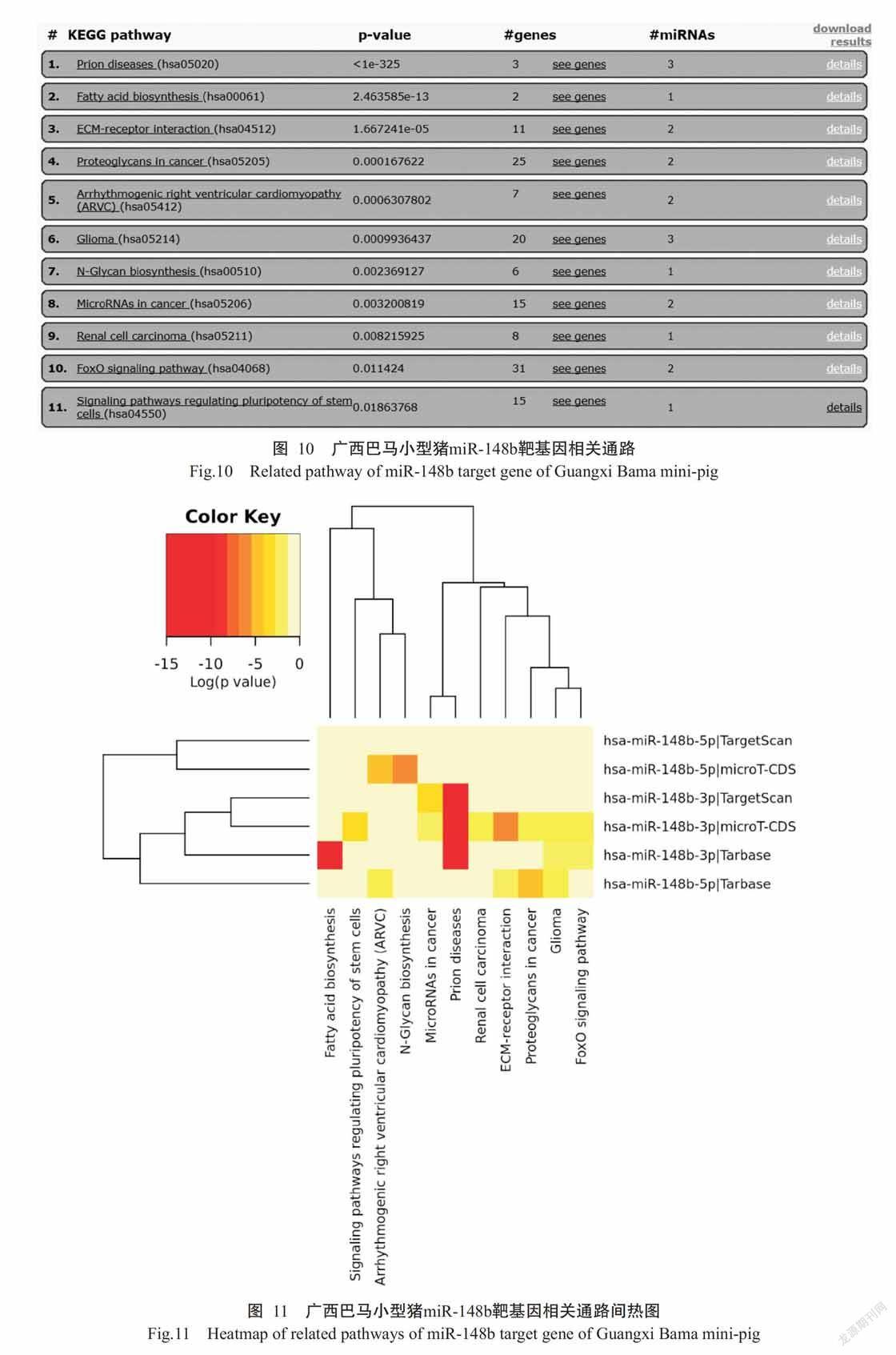
利用miRDB、miRWalk 2.0和TargetScan 7.2三大数据库分析广西巴马小型猪micRNA-148b的靶向基因,结果(图7和图8)表明,从miRDB数据库获得miR-148b-3p的靶向基因840个,miR-148b-5p的靶向基因499个;从miRWalk 2.0数据库获得miR-148b-3p的靶向基因7502个,miR-148b-5p的靶向基因7911个;从TargetScan 7.2数据库获得miR-148b-3p的靶向基因802个,miR-148b-5p的靶向基因4109个。
将预测结果提交至Bioinformatics & Evolutiona-ry Genomics分析网站得到Venn图,再根据Venn图得到miR-148b-3p并集的330个靶基因和miR-148b-5p并集的266个靶基因,查找广西巴马小型猪miR-148b的靶基因,结果发现存在18个共有靶基因(图9),分别为CLOCK(时间昼夜调控因子)、MIER1(转录调控因子)、MECP2(甲基化CpG结合蛋白)、ZNF704(锌指蛋白)、SPTY2D1(SPT2染色质蛋白)、QKI(RNA结合蛋白)、ZBTB20(锌指蛋白)、MGAT4A(钠/磷酸转运蛋白)、UHMK1(编码蛋白激酶)、PIK3C2A(磷酸肌醇-3-激酶2α肽)、C6orf62(6号染色体开放阅读框62抗体)、HECW2(E3泛素蛋白连接酶)、MAP1B(微管相关蛋白)、NHS(NHS肌动蛋白调节因子)、B4GALT6(β-1,4-半乳糖基转移酶)、ATP2A2(肌浆ATP酶/内质网Ca2+转运酶)、AP4E1(蛋白复合物接头分子)和BBX(锌指蛋白)。
2. 5 广西巴马小型猪miR-148b靶基因相关通路分析结果
采用DIANA Tools中的MirPath v.3对18个广西巴马小型猪miR-148b靶基因进行相关通路分析,结果发现有11条相关通路(图10),其中与疾病相关的通路有脂肪酸合成通路(Fatty acid biosynthesis)、细胞外基質受体相互作用通路(ECM-receptor interaction)、癌症的蛋白聚糖通路(Proteoglycans in cancer)、神经胶质瘤通路(Glioma)、癌症的小分子核糖核酸通路(microRNAs in cancer)、肾细胞癌通路(Renal cell carcinoma)、N-聚糖生物合成通路(N-Glycan biosynthesis)和致心律失常性右室心肌病通路(Arrhythmogenic right ventricular cardiomyopathy)。将P进行对数换算,分析通路间差异以获得更可靠的miR-148b相关通路,同时进行Show Heatmap分析以获得通路间热图(图11),结果发现,miR-148b-3p在脂肪酸合成相关疾病中有重要意义,而miR-148b-5p可能在N-聚糖生物合成和致心律失常性右室心肌病等相关疾病通路上发挥作用。
3 讨论
miRNA是一种非编码RNA,其作用机制是通过mRNA剪切和抑制蛋白翻译的方式,在转录后水平负调控其靶基因表达(王宏浩等,2018)。目前,大多数miRNA是通过反向遗传学发现,如lin-4、let-7及其他通过经典遗传学发现的miRNA等,但其功能研究尚处于初级阶段,作用靶点和相关分子调控机制也尚未明确。这类miRNA通过基因突变或在miRNA的靶位点上引入突变而抑制miRNA的作用,因此可观察细胞或活体动物中表达出的性状变化来推测miRNA功能的相关信息(Cannell et al.,2008),也可通过过表达miRNA推测其相关功能。本研究通过构建广西巴马小型猪miR-148b的慢病毒表达载体,转染293T细胞进行相关表达验证,并预测miR-148b靶基因及可能的疾病相关通路,为后续的功能研究及miRNA肿瘤治疗药物开发等提供理论指导。
miR-148/152家族成员在许多恶性肿瘤性疾病中存在异常表达,且主要集中在消化系统、循环系统和生殖系统等,普遍发现miR-148表达量呈显著下降趋势,即发挥一定的抑癌基因作用。此外,miR-148/152家族成员在一定程度上与疾病的临床分期和预后相关,对细胞凋亡及肿瘤细胞对化疗药物的敏感性也密切关联(Wang et al.,2016)。贾筱琴等(2014)研究发现,在体外试验中肝癌细胞SMMC-7721的侵袭和迁移受miR-148a抑制,进一步证实miR-148a可能是通过调节SMMC-7721肝癌细胞中vimentin、MMP-2和MMP-9的表达以降低MMP-2和MMP-9的活性,从而改变肿瘤细胞的侵袭和迁移能力。赵锦成等(2016)研究表明, miR-148a在鼻咽癌中也起到对鼻咽癌细胞增殖的抑制作用,可能是通过靶向调控EGFR机制参与鼻咽癌细胞的发生发展。Zhang等(2018)研究发现,肾癌中miR-148b-3p的表达量很低,推测其具有促进肾癌细胞凋亡及抑制细胞增殖和迁移的作用。在现有的研究主要集中在miR-148a,针对miR-148b的研究则相对较少,也说明miR-148b具有更多亟待发掘的内容。本研究通过数据库预测分析得知,广西巴马小型猪miR-148b存在18个靶基因,结合MirPath v.3的相关通路分析,发现有11条靶基因相关通路,其中与疾病相关的通路有脂肪酸合成通路、细胞外基质受体相互作用通路、癌症的蛋白聚糖通路、神经胶质瘤通路、癌症的小分子核糖核酸通路、肾细胞癌通路、N-聚糖生物合成和致心律失常性右室心肌病等,为下一步研究miR-148b疾病相关机制提供了依据。虽然关于miR-148/152家族的深入研究正在逐步展开,但具体的调控作用机制及在医药方面的实际应用等问题仍然亟待解决,包括新发现miRNA在各种复杂器官系统病理变化过程中的作用靶点及其分子调控网络机制等,均需进一步探究。
4 结论
广西巴马小型猪miR-148b慢病毒表达载体能在293T细胞中成功表达,miR-148b存在18个靶基因和11条相关通路,且主要在脂肪酸合成、N-聚糖生物合成及致心律失常性右室心肌病等相关疾病通路上发挥作用,可为肿瘤诊断治疗及相关miRNA肿瘤治疗药物的研发提供理论依据。
参考文献:
黄叶,吴延军,朱思燃,奉玲丽,瞿秋红,江雨航,夏琴,崔悦悦,莫家远,兰干球. 2019. 广西巴马小型猪CTGF基因真核表达载体构建及其相关生物信息学分析[J]. 南方农业学报,50(3):468-476. [Huang Y,Wu Y J,Zhu S R,Feng L L,Qu Q H,Jiang Y H,Xia Q,Cui Y Y,Mo J Y,Lan G Q. 2019. Construction of eukaryotic expression vector of CTGF gene in Guangxi Bama miniature pig and related bioinformatics analysis[J]. Journal of Southern Agriculture,50(3):468-476.]
贾筱琴,缪俊俊,雍军,张子兰,花晨,李国利. 2014. miR-148a对肝癌细胞株侵袭和迁移的抑制作用及机制[J]. 中国癌症杂志,24(6):412-417. [Jia X Q,Miao J J,Yong J,Zhang Z L,Hua C,Li G L. 2014. Inhibition of the invasion and migration of hepatocellular carcinoma cells by miR-148a and the mechanisms[J]. China Oncology,24(6):412-417]
居峰,左君波,朱阿考,晏江,夏加增,张熔熔,万佳艺. 2013. 胃癌组织中miR-148a基因甲基化状态与DNA甲基转移酶1的关系[J]. 中华实用诊断与治疗杂志,27(4):361-363. [Ju F,Zuo J B,Zhu A K,Yan J,Xia J Z,Zhang R R,Wan J Y. 2013. Association between the methylation status of miR-148a gene and DNA methyltransferase 1 in gastric cancer tissues[J]. Journal of Chinese Practical Dia-gnosis and Therapy,27(4):361-363.]
李國喜,闫峰宾,王乐乐,贾丽娟,孙桂荣,康相涛. 2013. 鸡miR-148a的组织表达及其发育调控功能预测分析[J]. 中国生物化学与分子生物学报,29(10):962-968. [Li G X,Yan F B,Wang L L,Jia L J,Sun G R,Kang X T. 2013. Tissue expression profile and putative development regulatory function of miR-148a in chickens[J]. Chinese Journal of Biochemistry and Molecular Biology,29(10):962-968.]
宋少锐,吴延军,蒋世强,张名媛,郭亚芬,兰干球,蒋钦杨, 2014. 广西巴马小型猪MCP-1基因克隆及序列分析[J]. 南方农业学报,45(9):1669-1673. [Song S R,Wu Y J,Jiang S Q,Zhang M Y,Guo Y F,Lan G Q,Jiang Q Y. 2014. Cloning and analysis of MCP-1 gene in Guangxi Bama mini-pig[J]. Journal of Southern Agriculture,45(9):1669-1673.]
谭翠,莫春容. 2016. miR-148b/DUSP1调节巨噬细胞分泌细胞因子CD206促进肝癌的发生[J]. 第三军医大学学报,38(3):270-275. [Tan C,Mo C R. 2016. miR-148b/DUSP1 mediates macrophage CD206 secretion to induce hepatocarcinoma cell growth[J]. Journal of Third Military Medical University,38(3):270-275.]
王宏浩,韩文静,张燕军,苏蕊,刘志红,王瑞军,王志英,赵艳红,王志新,李金泉. 2018. circRNA研究现状及展望[J].南方农业学报,49(3):431-439. [Wang H H,Han W J,Zhang Y J,Su R,Liu Z H,Wang R J,Wang Z Y,Zhao Y H,Wang Z X,Li J Q. 2018. Research in circRNA:A review[J]. Journal of Southern Agriculture,49(3):431-439.]
王晓雪,富威,梁颖,李艳. 2017. miR-148b在急性髓系白血病患者及细胞系中的表达与生物学功能[J]. 现代肿瘤医学,25(3):340-344. [Wang X X,Fu W,Liang Y,Li Y. 2017. Preliminary study on expression and biological functions of miR-148b in acute myeloid leukemia patients and cell lines[J]. Journal of Modern Oncology,25(3):340-344.]
王曉雪,王玥,王萍萍,李艳. 2015. microRNA-148/152家族在血液恶性肿瘤中的表达[J]. 中国实验血液学杂志,23(4):1173-1178. [Wang X X,Wang Y,Wang P P,Li Y. 2015. Expression of microRNA-148/152 family in hematologic malignancies[J]. Journal of Experimental Hematology,23(4):1173-1178.]
张广杰,崔悦悦,邱庆庆,夏琴,李龙,司景磊,夏攀杰,邹辉,兰干球. 2018. 广西巴马小型猪SP1基因克隆测序及其真核表达载体的构建[J]. 南方农业学报,49(2):360-366. [Zhang G J,Cui Y Y,Qiu Q Q,Xia Q,Li L,Si J L,Xia P J,Zou H,Lan G Q. 2018. Clone sequencing of gene SP1 in Guangxi Bama mini pig and construction of its eukaryotic expression vector[J]. Journal of Southern Agriculture,49(2):360-366.]
赵锦成,石颖,王宇,张颖,马新,贾占红,吴再军,张京秋. 2016. miR-148a在鼻咽癌中的表达及其对肿瘤细胞生物学功能的影响[J]. 临床耳鼻咽喉头颈外科杂志,30(15):1219-1223. [Zhao J C,Shi Y,Wang Y,Zhang Y,Ma X,Jia Z H,Wu Z J,Zhang J Q. 2016. The expre-ssion of miR-148a in nasopharyngeal carcinoma and its effect on tumor cell biology functions in nasopharyngeal carcinoma[J]. Journal of Clinical Otorhinolaryngology Head and Neck Surgery,30(15):1219-1223.]
Cannell I G,Kong Y W,Bushell M. 2008. How do micro-RNAs regulate gene expression?[J]. Biochemical Socie-ty Transactions,36(6):1224-11231.
Chen X,Wang Y W,Gao P. 2018. SPIN1,negatively regula-ted by miR-148/152,enhances Adriamycin resistance via upregulating drug metabolizing enzymes and transporter in breast cancer[J]. Journal of Experimental & Clinical Cancer Research,37:100. doi:10.1186/s13046-018-0748-9.
Chen Y,Song Y X,Wang Z N,Yue Z Y,Xu H M,Xing C Z,Liu Z K. 2010. Altered expression of miR-148a and miR-152 in gastrointestinal cancers and its clinical significance[J]. Journal of Gastrointestinal Surgery,14(7):1170-1179.
Li X W,Jiang M Z,Chen D,Xu B,Wang R,Chu Y,Wang W J,Zhou L,Lei Z J,Nie Y Z,Fan D M,Shang Y L,Wu K C,Liang J. 2018. miR-148b-3p inhibits gastric cancer metastasis by inhibiting the Dock6/Rac1/Cdc42 axis[J]. Journal of Experimental & Clinical Cancer Research,37:71. doi:10.1186/s13046-018-0729-z.
Linhart H G,Lin H,Yamada Y,Moran E,Steine E J,Gokhale S,Lo G,Cantu E,Ehrich M,He T,Meissner A,Jaenisch R. 2007. Dnmt3b promotes tumorigenesis in vivo by gene-specific de novo methylation and transcriptional silencing[J]. Genes & Development,21(23):3110-3122.
Okano M,Bell D W,Haber D A,Li E. 1999. DNA methyltransferases Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development[J]. Cell,99(3):247-257.
Ooi S K T,Qiu C,Bernstein E,Li K Q,Jia D,Yang Z,Erdjument-Bromage H,Tempst P,Lin S P,Allis C D,Cheng X D,Bestor T H. 2007. DNMT3L connects unmethylated lysine 4 of histone H3 to de novo methylation of DNA[J]. Nature,448(7154):714-717.
Ueda T,Volinia S,Okumura H,Shimizu M,Taccioli C,Rossi S,Alder H,Liu C G,Oue N,Yasui W,Yoshida K,Sasaki H,Nomura S,Seto Y,Kaminishi M,Calin G A,Croce C M. 2010. Relation between microRNA expression and progression and prognosis of gastric cancer:A microRNA expression analysis[J]. Lancet Oncology,11(2):136-146.
Wang R F,Ye F,Zhen Q,Song T Y,Tan G L,Chu W W,Zhang Y X,Lv B L,Zhao X J,Liu J B. 2016. micro-RNA-148b is a potential prognostic biomarker and predictor of response to radiotherapy in non-small-cell lung cancer[J]. Journal of Physiology and Biochemistry,72(2):337-343.
Zhang H,Ye Q,Du Z F,Huang M,Zhang M,Tan H F. 2018. MiR-148b-3p inhibits renal carcinoma cell growth and pro-angiogenic phenotype of endothelial cell potentially by modulating FGF2[J]. Biomedicine & Pharmacotherapy,107:359-367.
Zheng B,Liang L,Wang C,Huang S,Cao X,Zha R,Liu L,Jia D,Tian Q,Wu J,Ye Y,Wang Q,Long Z,Zhou Y,Du C,He X,Shi Y. 2011. microRNA-148a suppresses tumor cell invasion and metastasis by downregulating ROCK1 in gastric cancer[J]. Clinical Cancer Research,17(24):7574-7583.
(責任编辑 兰宗宝)
