多子小瓜虫感染后草鱼TLR信号通路基因的表达动态
2019-09-10赵飞谭爱萍孔璐璐刘付翠邓玉婷潘厚军张瑞泉姜兰
赵飞 谭爱萍 孔璐璐 刘付翠 邓玉婷 潘厚军 张瑞泉 姜兰

摘要:【目的】明确草鱼Toll样受体(Toll-like receptor,TLR)信号通路基因在防御多子小瓜虫(Ichthyophthirius multifiliis)感染过程中的免疫作用,为有效防控鱼类多子小瓜虫感染提供理论参考。【方法】以多子小瓜虫感染草鱼后,采用实时荧光定量PCR检测分析在不同时间点(感染后6 h、12 h、1 d、2 d、3 d、5 d和7 d)草鱼部分TLRs基因(TLR1、TLR2、TLR4、TLR9、TLR20和TLR21)、接头蛋白基因(MyD88和TRIF)、信号转导分子(IRAK4和IRAK1)及细胞因子(IL-1β、TNF-α和IFN)在其皮膚和脾脏中的表达动态变化。【结果】草鱼感染多子小瓜虫后,TLR1、TLR2、TLR9、TLR20和TLR21基因在皮肤和脾脏中的表达主要呈上调趋势,TLR4基因在皮肤中主要呈上调表达,在脾脏中则主要呈下调表达;TLR信号通路接头蛋白基因MyD88和TRIF的表达变化趋势明显不同,其中,MyD88基因的表达在感染后第1~3 d均呈显著上调趋势(P<0.05,下同),而TRIF基因的表达在整个试验过程中绝大多数时间点与对照组无显著差异(P>0.05);IRAK4和IRAK1在皮肤和脾脏中的表达也主要呈上调趋势,但在脾脏中IRAK4在感染后第1 d和IRAK1在感染后第6 h的表达呈显著下调趋势;IL-1β和TNF-α在绝大多数时间点均显著上调,但IFN的表达基本没有变化。【结论】草鱼TLR信号通路中的部分TLRs基因(TL1、TLR2、TLR4、TLR9、TLR20和TLR21)、接头蛋白基因(MyD88)、信号转导分子(IRAK4和IRAK1)及下游细胞因子(IL-1β和TNF-α)均参与防御多子小瓜虫感染的免疫反应,尤其是在感染早期和中期发挥关键作用。
关键词: 草鱼;多子小瓜虫;Toll样受体(TLR);信号通路;基因表达
中图分类号: S941.514 文献标志码: A 文章编号:2095-1191(2019)09-1885-08
Abstract:【Objective】The immune defense function of some genes in toll-like receptor(TLR) signaling pathway of grass carp(Ctenopharyngodon idella) against Ichthyophthirius multifiliis infection was clarified to provide theoretical reference for the effective prevention and control of I. multifiliis infection on fish. 【Method】After I. multifiliis infection on C. idella, the real-time fluorescent quantitative PCR was employed to examine and analyze the dynamics of gene expression profiles in the skin and spleen of the C. idella at different time points, including 6 h, 12 h, 1 d, 2 d, 3 d, 5 d, and 7 d. These tested genes contained several TLRs genes(TLR1, TLR2, TLR4, TLR9, TLR20, and TLR21), adaptor proteins genes(MyD88 and TRIF), signal transducing molecules(IRAK4 and IRAK1), and cytokines(IL-1β, TNF-α, and IFN). 【Result】Several TLRs, including TLR1, TLR2, TLR9, TLR20, and TLR21, were up-regulated in the skin and spleen at most time points after I. multifiliis infection. The expression of TLR4 was mostly up-regulated in the skin, but down-regulated in the spleen.The expression trends of two adaptor proteins genes(MyD88 and TRIF) were obviously different. MyD88 expression showed significant up-regulation from day 1 to day 3 after I. multifiliis infection(P<0.05, the same below), whereas the expression levels of TRIF showed no significant changes at most time points compared with control(P>0.05). The expressions of both IRAK4 and IRAK1 also were up-regulated in the skin and spleenat most time points. However, the expressions of IRAK4 at day 1 and IRAK1 at 6 h in the spleen were significantly down-regulated after infection, respectively. The expressions of IL-1β and TNF-α were significantly up-regulated at most time points after infection, but the expression of IFN remained substantially unchanged. 【Conclusion】The several genes in TLR signaling pathway of C. idella, including some TLRs genes(TLR1, TLR2, TLR4, TLR9, TLR20, and TLR21), one adaptor protein gene(MyD88), two signal transducing molecules(IRAK4 and IRAK1), and two downstream cytokines (IL-1β and TNF-α), are widely involved and play crucial roles in the immune defense against I. multifiliis infection, especially in the early and middle stages of the infection.
Key words: Ctenopharyngodon idella; Ichthyophthirius multifiliis; toll-like receptor(TLR); signaling pathway; gene expression
0 引言
【研究意义】Toll样受体(Toll-like receptor,TLR)属于I型跨膜蛋白,是一类重要的模式识别受体,能特异性识别病原相关分子模式(Pathogen-associated molecular patterns,PAMPs),并通過募集接头蛋白、转导信号及诱导炎性细胞因子等表达而发挥免疫防御作用,既是机体的第一道天然屏障,也是连接先天性免疫和获得性免疫的重要桥梁(何玉洁和潘建平,2017)。因此,研究TLR信号通路基因在病原感染过程中的表达动态,对揭示病原和鱼类间的免疫互作机制及制定有效的防控措施具有重要意义。【前人研究进展】依据接头蛋白的不同哺乳动物TLR信号通路可分为髓系分化因子88(Myeloid differentiation factor 88,MyD88)依赖型和β干扰素TIR结构域衔接蛋白(TIR domain-containing adaptor-inducing IFN-β,TRIF)依赖型(Yuk and Jo,2011)。TLRs在识别相应的PAMPs后,除TLR3外,其他TLRs均以MyD88为接头蛋白,然后招募白细胞介素-1受体相关激酶4(IL-1 receptor-associated kinase 4,IRAK4)和IRAK1,再将信号转导给肿瘤坏死因子受体相关因子6(Tumor necrosis factor receptor-associated factor 6,TRAF6),TRAF6与转化生长因子β活化激酶1(Transforming growth factor-β-activated kinase 1,TAK1)及其结合蛋白(TAK1-binding proteins,TABs)TAB1和TAB2组合成复合物,从而激活下游的NF-κB和AP-1等转录因子,诱导免疫因子表达,最终启动免疫防御反应(Jiménez-Dalmaroni et al.,2016)。其中,TLR2和TLR4识别细菌的脂肽和脂多糖等;TLR3识别病毒的双链RNA;TLR5识别细菌的鞭毛蛋白;TLR7和TLR8识别病毒的单链RNA;TLR9识别非甲基化的CpG-DNA(Tan and Kagan,2017)。目前,有关TLRs与寄生虫感染的相关性研究仍较少,仅发现TLR2或TLR4可识别利什曼原虫(Leishmania major)(Bec-ker et al.,2003)、刚地弓形虫(Toxoplasma gondii)(Debierre-Grockiego et al.,2007)和恶性疟原虫(Plasmodium falciparum)(Zhu et al.,2011)的糖基磷脂酰肌醇(Glycosylphosphatidylinositol,GPI)锚定蛋白;TLR9可识别克氏锥虫(Trypanosoma cruzi)非甲基化的DNA(Bafica et al.,2006);TLR11能识别刚地弓形虫的Profilin-like蛋白(Yaro-vinsky et al.,2005)等。至今,已在哺乳动物中发现15种TLRs,而从鱼类中至少鉴定出20种TLRs(范泽军等,2015)。针对鱼类的研究主要集中在TLRs与细菌或病毒感染的相关性方面(Liao et al.,2017)。Li等(2011a,2011b,2012,2016)研究发现,斜带石斑鱼(Epinephelus coioides)的TLR2、TLR9、TLR21、MyD88及IRAK1等广泛参与抵御刺激隐核虫(Cryptocaryon irritans)感染的免疫反应,表明鱼类TLR信号通路基因在防御寄生虫的感染过程中发挥重要作用。【本研究切入点】多子小瓜虫(Ichthyophthirius multifiliis)是一种广泛分布的纤毛类寄生性原虫,几乎可感染全部淡水鱼类,引起小瓜虫病(俗称白点病),导致鱼类死亡或引起细菌、病毒等继发性感染,而造成巨大的经济损失(宋飞彪等,2012;赵飞等,2012)。草鱼(Ctenopharyngodon idella)是我国最重要的水产养殖鱼类之一,约占淡水鱼总产量的20%,但草鱼养殖一直深受小瓜虫病困扰。早期研究发现,草鱼的TRAF6、TAK1、TAB1和TAB2及斑点叉尾鮰(Ictalurus punctatus)的TLR1、TLR2、TLR9和TLR21等TLR信号通路基因参与了抵御多子小瓜虫感染的免疫应答(Zhao et al.,2013a,2013b,2014),但草鱼TLR信号通路其他基因是否参与并发挥防御多子小瓜虫感染作用等机理尚不清楚。【拟解决的关键问题】以多子小瓜虫感染草鱼后通过实时荧光定量PCR检测分析草鱼的部分TLRs(TLR1、TLR2、TLR4、TLR9、TLR20和TLR21)、接头蛋白(MyD88和TRIF)、信号转导分子(IRAK4和IRAK1)及细胞因子(IL-1β、TNF-α和IFN)在其皮肤和脾脏中的表达动态变化,明确草鱼TLR信号通路基因在防御多子小瓜虫感染过程中的免疫作用,为有效防控鱼类多子小瓜虫感染提供理论参考。
1 材料与方法
1. 1 试验材料
草鱼购自广东省佛山市某养殖场,健康活泼,规格整齐,体重约50 g/尾,在养殖过程中未感染过多子小瓜虫。随机挑取10尾草鱼,镜检鱼鳃和体表均未发现多子小瓜虫或其他寄生虫。草鱼在实验室内的循环流水养殖箱中暂养2周,氧气充足,水温控制在(23±1)℃,每日定时投喂商品饲料2次。多子小瓜虫从患病草鱼上分离获得,采用农业农村部渔用药物创制重点实验室建立的以斑点叉尾鮰为宿主的室内传代系统进行保种传代(Zhao et al.,2013a,2013b,2014)。
1. 2 多子小瓜虫幼虫准备
在多子小瓜虫传代过程中将体表已显现白点的斑点叉尾鮰置于5 L的塑料烧杯中,发育成熟的包囊将从鱼体上自动脱落,分别用孔径250和75 μm的网筛过滤、收集包囊。将包囊轻轻洗净后转入1 L的玻璃烧杯中,添加少量无菌水,23 ℃孵化20 h即发育成幼虫,再以孔径40 μm的网筛过滤,得到活体幼虫滤液。取10份10 μL的幼虫滤液,显微镜下观察计数,换算出总滤液中的多子小瓜虫活体幼虫数量,用于后續的草鱼感染试验。
1. 3 感染试验
将120尾草鱼随机平均分成感染组和对照组。感染组的60尾草鱼置于60 L的水桶中,按1∶10000的感染剂量加入多子小瓜虫活体幼虫进行体表感染,感染2 h后将草鱼转至250 L的鱼缸中。采用相同方法处理对照组的60尾草鱼,但不添加多子小瓜虫幼虫。于感染后6 h、12 h、1 d、2 d、3 d、5 d和7 d时分别从感染组和对照组随机取样6尾草鱼。以灭菌刀片刮去草鱼背部中央的鳞片,使用尖头镊子剥离1.0 cm×1.5 cm大小的皮肤,轻轻刮除皮肤内侧肌肉以得到干净的背部皮肤,液氮速冻后-70 ℃保存备用。同时快速采集脾脏冻存备用。
1. 4 总RNA提取及cDNA合成
采用TRIzol试剂盒(Invitrogen公司)提取草鱼皮肤和脾脏组织的总RNA,以Nanodrop 1000微量紫外分光光度计(Thermo公司)和1.5%琼脂糖凝胶电泳检测总RNA质量。使用RNase-free DNase I(Fermentas公司)去除基因组DNA后,按ReverTra Ace@ Reverse Transcriptase试剂盒(TOYOBO公司)说明反转录合成cDNA,反应程序:42 ℃ 20 min;99 ℃ 5 min;4 ℃ 5 min。合成的cDNA置于-20 ℃冰箱保存备用。
1. 5 目的基因片段克隆及测序分析
采用Beacon Designer 8.0设计草鱼TLR信号通路基因的特异性引物(表1)。以草鱼脾脏cDNA为模板进行目的基因PCR扩增,反应体系25.00 μL:cDNA模板1.00 μL,上、下游引物(10 μmol/L)各1.00 μL,10×PCR Buffer(Mg2+)2.50 μL,dNTP Mixture(2.5 mmol/L)2.00 μL,rTaq DNA聚合酶0.25 μL,ddH2O 17.25 μL。扩增程序:95 ℃预变性2 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 20 s,进行35个循环;72 ℃延伸5 min。PCR扩增产物经1.0%琼脂糖凝胶电泳检测后,采用E.Z.N.A® Gel Extraction Kit(OMEGA公司)进行目的条带回收纯化,然后TA克隆至pMD18-T载体上,再转化大肠杆菌DH5α感受态细胞。取100.00 μL菌液凃布于含氨苄青霉素(100 μg/mL)的LB培养基上,37 ℃培养过夜,挑选3个菌落PCR验证呈阳性的克隆送至广州艾基生物技术有限公司测序。
1. 6 实时荧光定量PCR检测分析
采用实时荧光定量PCR检测感染多子小瓜虫后草鱼皮肤和脾脏组织中TLR信号通路基因的表达动态,以每个时间点各组织的cDNA为模板、β-action为内参基因,在Roche LightCycler480 Real-time PCR Detection System上进行定量检测分析。反应体系10.00 μL:cDNA模板0.40 μL,上、下游引物(10 μmol/L)各0.40 μL,SYBR Green Real-time PCR Master Mix 5.00 μL,ddH2O 3.80 μL。每个样品均设3个重复。扩增程序:95 ℃预变性30 s;95 ℃ 30 s,60 ℃ 15 s,72 ℃ 20 s,进行40个循环,每个循环结束时采集1次荧光信号。采用2-△△Ct法(Livak and Schmittgen,2001)计算目的基因的相对表达量,并以SPSS 22.0进行统计分析。
2 结果与分析
2. 1 感染多子小瓜虫后草鱼TLRs基因表达的动态变化
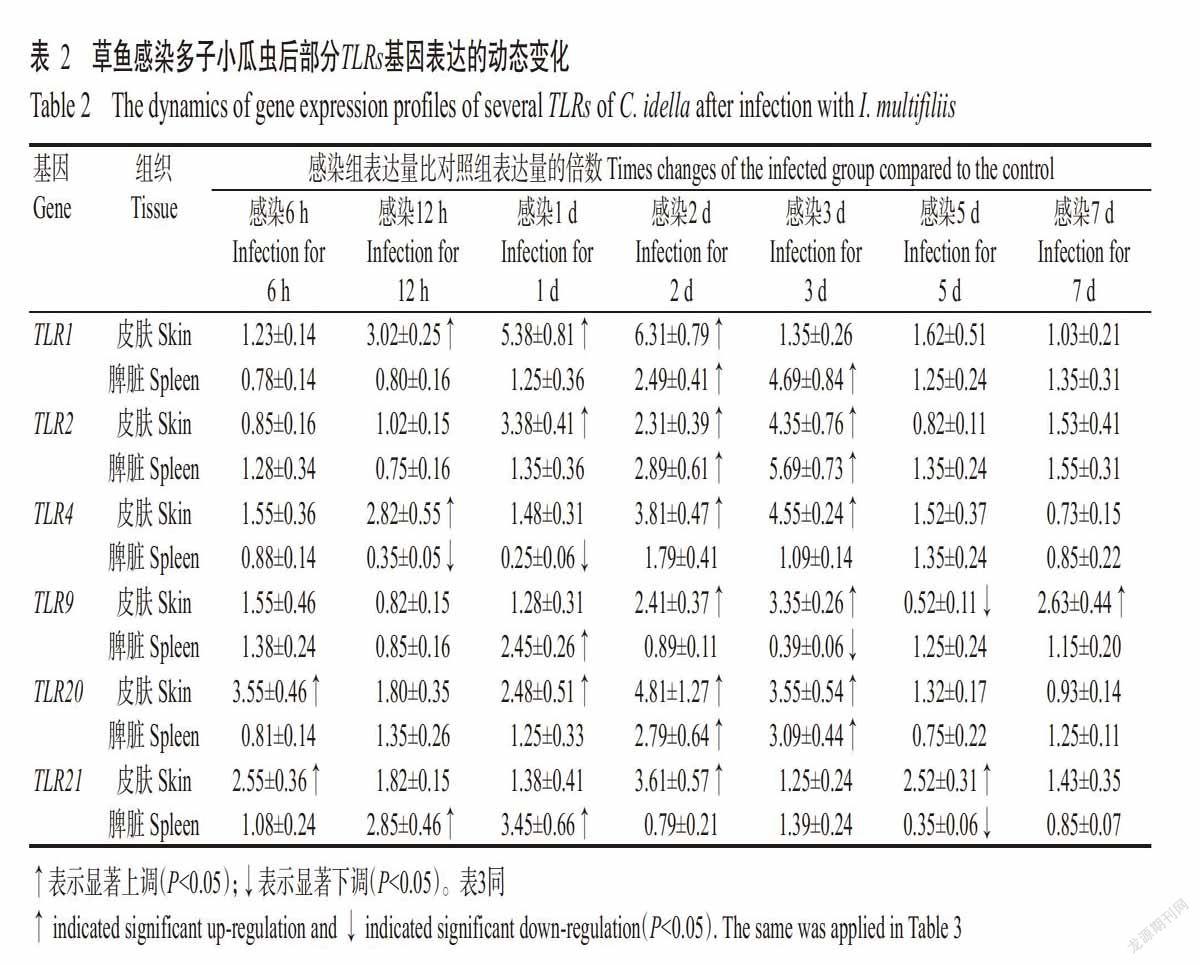
2. 1. 1 TLR1和TLR2基因的表达动态 草鱼感染多子小瓜虫后,其皮肤和脾脏的TLR1和TLR2基因表达主要呈上调趋势(表2)。在感染后第12 h,TLR1基因在皮肤中开始显著上调表达(P<0.05,下同),是对照组的3.02倍,至感染后第1和2 d持续上调至对照组的5.38和6.31倍;在脾脏中,TLR1基因在感染后第2和3 d时分别上调2.49和4.69倍,在其他时间点与对照组间无显著差异(P>0.05,下同)。TLR2与TLR1基因的表达变化相似,在皮肤中表现为感染后第1~3 d均显著上调,于感染后第3 d达峰值,为对照组的4.35倍;在脾脏中表现为感染后第2和3 d显著高于对照组,分别是对照组的2.89和5.69倍。
2. 1. 2 TLR4基因的表达动态 草鱼感染多子小瓜虫后,TLR4基因在其皮肤和脾脏中的表达变化趋势不同(表2)。在皮肤中,TLR4基因在感染后第12 h上调为对照组的2.82倍,但至感染后第1 d回落到对照组水平,随后其表达又逐渐上调,于感染第3 d达峰值(4.55倍)。而在脾脏中,TLR4基因在感染后第12 h和第1 d的表达量显著下调,仅为对照组的35%和25%;在其他时间点与对照组间均无显著差异。
2. 1. 3 TLR9基因的表达动态 草鱼感染多子小瓜虫后,其皮肤中的TLR9基因在感染后第2、3和7 d均呈显著上调表达,于感染后第3 d达峰值(3.35倍);而在脾脏中,TLR9基因除在感染第1 d显著上调2.45倍和感染后第3 d显著下调39%外,其他时间点与对照组间均无显著差异(表2)。
2. 1. 4 TLR20基因的表达动态 草鱼感染多子小瓜虫6 h后,其皮肤中的TLR20基因表达上调3.55倍,在感染后第12 h有所回落,然后又持续上调,于感染后第2 d达峰值(4.81倍),随后逐渐恢复到对照组水平(表2)。在脾脏中,TLR20基因只在感染后第2和3 d显著上调,分别是对照组的2.79和3.09倍。
2. 1. 5 TLR21基因的表达动态 多子小瓜虫感染诱导草鱼TLR21基因的表达变化规律见表2。在皮肤中,TLR21基因的表达在感染后第6 h(2.55倍)、第2 d(3.61倍)和第5 d(2.52倍)均显著高于对照组,在其他时间点也呈上调趋势,但差异不显著。在脾脏中,TLR21基因的表达在感染后第6 h~第1 d呈持续上调趋势,于感染后第1 d达峰值(3.45倍);除感染第5 d TLR21基因表达量仅为对照组的35%外,在其他时间点与对照组的表达水平基本一致。
2. 2 感染多子小瓜虫后草鱼接头蛋白基因表达的动态变化
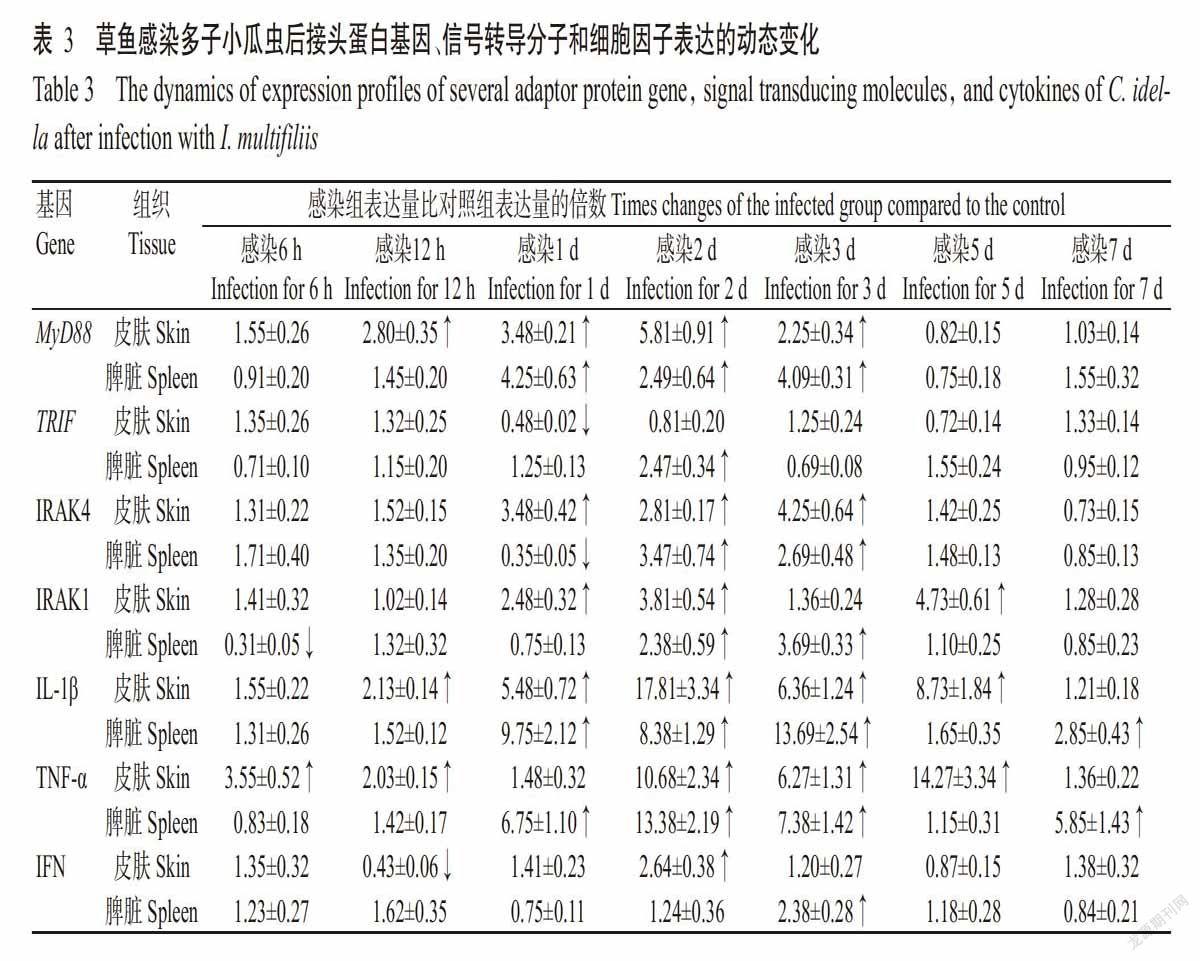
草鱼感染多子小瓜虫后,TLR信号通路接头蛋白基因MyD88和TRIF的表达变化趋势明显不同,其中,MyD88基因的表达在感染后第1~3 d均呈显著上调趋势,而TRIF基因的表达在整个试验过程中绝大多数时间点与对照组无显著差异(表3)。在感染后第6 h,皮肤中MyD88基因的表达略高于对照组,随后呈显著上调趋势,于感染后第2 d达峰值(5.81倍),感染后第3 d略有回落(2.25倍),最终恢复至对照组水平;脾脏中MyD88基因的表达在感染后第1~3 d均显著高于对照组。
2. 3 感染多子小瓜虫后草鱼信号转导分子表达的动态变化
草鱼感染多子小瓜虫后,皮肤中的IRAK4在感染后第1~3 d呈显著上调趋势,分别是对照组的3.48、2.81和4.25倍,在其他时间点的变化差异不显著。在脾脏中,IRAK4在感染后第6和12 h的表达量略高于对照组,但至感染后第1 d仅为对照组的35%,随后其表达迅速上调,至感染后第2和3 d分别为对照组的3.47和2.69倍,而后又下调恢复到对照组水平(表3)。IRAK1表达的动态变化表现为:皮肤中IRAK1的表达量在感染后第1、2和5 d显著高于对照组,分别是对照组的2.48、3.81和4.73倍,其他时间点也略高于对照组,但差异不显著。脾脏中的IRAK1在感染后第6 h显著下调表达,仅为对照组的31%,但感染后第2和3 d分别显著上调至对照组的2.38和3.69倍(表3)。
2. 4 感染多子小瓜虫后草鱼细胞因子表达的动态变化
草鱼感染多子小瓜虫后,其细胞因子IL-1β、TNF-α和IFN的分泌表达如表3所示。除感染后第6 h和第7 d外,皮肤中IL-1β的表达均显著高于对照组,且在感染后第2 d达峰值(17.81倍);在脾脏中,IL-1β的表达量也均高于对照组,其中在感染后第1、2、3和7 d显著高于对照组,分别是对照组的9.75、8.38、13.69和2.85倍,于感染后第3 d达峰值。草鱼感染多子小瓜虫后,TNF-α在其皮肤和脾脏中的表达表现为大多数时间点显著高于对照组,且分别在感染后第5 d(14.27倍)和第2 d(13.38倍)出现峰值。与TNF-α不同,草鱼感染多子小瓜虫后IFN的表达在大多数时间点无显著变化,在皮肤和脾脏中的表达峰值分别出现在感染后第2 d(2.64倍)和第3 d(2.38倍)。
3 讨论
哺乳动物的TLR2与TLR1通过形成异源二聚体而行使功能,可识别多种寄生虫的GPI锚定蛋白(Zhu et al.,2011),而多子小瓜虫体表纤毛上含有丰富的GPI锚定蛋白(Clark et al.,2001)。至今,关于鱼类TLRs抵御寄生虫感染的机理研究鲜见报道。本研究通过分析草鱼感染多子小瓜虫后TLR信号通路基因表达的动态变化,结果发现多子小瓜虫感染能诱导部分TLRs基因(TL1、TLR2、TLR4、TLR9、TLR20和TLR21)、接头蛋白基因(MyD88)、信号转导分子(IRAK4和IRAK1)及细胞因子(IL-1β和TNF-α)的表达,推测草鱼TLR1、TLR2、TLR4、TLR9、TLR20和TLR21可识别多子小瓜虫的某些成分,激活TLR信号通路而发挥免疫防御作用。草鱼感染多子小瓜虫后,TLR1和TLR2基因的表达动态变化基本一致,主要为上调表达,与多子小瓜虫感染斑点叉尾鮰(Zhao et al.,2013a)的结果相似,推测草鱼TLR2与TLR1形成二聚体而识别多子小瓜虫的GPI锚定蛋白。在哺乳动物的相关研究中,克氏锥虫和刚地弓形虫的GPI锚定蛋白可启动小鼠TLR4信号通路,并证实TLR4基因缺失型小鼠更易感染寄生虫(Oliveira et al.,2004;Debierre-Grockiego et al.,2007)。目前,主要在斑马鱼和草鱼等一些鲤科鱼类中鉴定获得TLR4,而大部分鱼类缺失TLR4(Huang et al.,2012)。Sepulcre等(2009)、Sullivan等(2009)研究表明,斑马鱼TLR4无法识别哺乳动物TLR4的配体LPS,即鱼类和哺乳类动物的TLR4功能存在差异。本研究结果表明,多子小瓜虫感染能诱导草鱼皮肤中的TLR4基因上调表达(感染第7 d除外),与Zhao等(2013a)研究发现多子小瓜虫感染斑点叉尾鮰后TLR4基因表达并未发生明显变化的结论不同,说明不同鱼类的TLR4功能可能也存在一定差异。
禽类TLR21与哺乳动物TLR9的功能相似,均能识别细菌或寄生虫的非甲基化DNA(Bafica et al.,2006;Brownlie et al.,2009;Hkima et al.,2009)。哺乳动物缺少TLR21,禽类缺少TLR9,但TLR9和TLR21共存于鱼类中。本研究结果表明,多子小瓜虫感染致使草鱼TLR9和TLR21基因在皮肤中上调表达,与刺激隐核虫感染石斑鱼后的结果(Li et al.,2012)相似,因此推测鱼类TLR9和TLR21與哺乳动物TLR9的功能相似。TLR20是鱼类特有的TLR,在草鱼、斑马鱼、鲤和斑点叉尾鮰等鱼类已有相关报道,系统发育进化分析结果显示,鱼类TLR20与小鼠TLR11的亲缘关系较近,根据小鼠TLR11能识别刚地弓形虫Profilin-like分子的结论(Yarovinsky et al.,2005),可推测鱼类TLR20具有识别原生动物寄生虫成分的功能作用(Pietretti et al.,2014)。
在哺乳動物中,除TLR3外,其他所有TLRs均可利用MyD88作为接头蛋白,即MyD88在一定程度上能反映TLRs的整体变化。由于寄生虫成分复杂,其宿主中可能存在多个TLRs同时发挥作用,识别相同或不同的寄生虫分子,如TLR2和TLR9分别识别克氏锥虫的GPI和DNA(Bafica et al.,2006),TLR2和TLR4可同时识别刚地弓形虫的GPI锚定蛋白(Debierre-Grockiego et al.,2007)。相对于单一的TLRs基因缺失,MyD88基因缺失对寄生虫的感染更敏感(Campos et al.,2004)。草鱼感染多子小瓜虫后,MyD88基因的表达在感染后第1~3 d均呈显著上调趋势,暗示多子小瓜虫感染激活了一种或多种TLRs。多子小瓜虫感染并未引起草鱼TRIF基因表达发生显著变化,其原因是TRIF为TLR3的接头蛋白,而TLR3主要识别病毒RNA分子(Jiménez-Dalmaroni et al.,2016)。
IRAK4和IRAK1是TLRs信号通路中的关键转导分子。IRAK4缺失导致小鼠对夏氏疟原虫(Plasmodium chabaudi)更易感(Finney et al.,2010);经刺激隐核虫感染后斜带石斑鱼IRAK4和IRAK1在感染位点和免疫器官中主要呈显著上调趋势,极少数时间点呈下调表达(Li et al.,2014,2016)。在本研究中,受多子小瓜虫感染后,草鱼IRAK4和IRAK1在皮肤和脾脏中的表达主要呈上调趋势,但在脾脏中IRAK4在感染后第1 d和IRAK1在感染后第6 h的表达呈显著下调趋势,提示IRAK4和IRAK1可能参与了鱼类防御寄生虫感染的免疫应答,但具体作用机制有待进一步研究证实。
TLRs在识别PAMPs后,可激发信号转导,调控细胞因子表达,最终对病原刺激作出响应。IL-1β、TNF-α、IFN是TLRs信号通路下游的3种重要细胞因子。IL-1β、TNF-α和IFN能广泛参与防御刚地弓形虫(Kalantari et al.,2016)、克氏锥虫(Guimarães-Pinto et al.,2018)等寄生虫感染免疫反应;IL-1β和TNF-α可参与多种鱼类寄生虫感染的防御反应(Zhi et al.,2018;Zhou et al.,2018)。在本研究中,草鱼感染多子小瓜虫后IL-1β和TNF-α在绝大多数时间点均显著上调,与刺激隐核虫感染诱导石斑鱼的结果(Li et al.,2011a)相似;但多子小瓜虫感染后草鱼IFN的表达基本没有变化,推测IFN并未参与抵御寄生虫感染的免疫反应。
4 结论
草鱼TLR信号通路中的部分TLRs基因(TL1、TLR2、TLR4、TLR9、TLR20和TLR21)、接头蛋白基因(MyD88)、信号转导分子(IRAK4和IRAK1)及下游细胞因子(IL-1β和TNF-α)均参与防御多子小瓜虫感染的免疫反应,尤其是在感染早期和中期发挥关键作用。
参考文献:
范泽军,邹鹏飞,姚翠鸾. 2015. 鱼类Toll样受体及其信号传导的研究进展[J]. 水生生物学报,39(1):173-184. [Fan Z J,Zou P F,Yao C L. 2015. Toll-like receptors(TLR) and its signaling pathway in teleost[J]. Acta Hydrobiologica Sinica,39(1):173-184.]
何玉洁,潘建平. 2017. 病原菌对NOD样受体及Toll样受体信号通路介导的固有免疫逃逸机制研究进展[J]. 浙江大学学报(医学版),46(2):218-224. [He Y J,Pan J P. 2017. Progress on mechanisms for pathogens to evade NOD-like receptor and Toll-like receptor signaling pathways[J]. Journal of Zhejiang University(Medical Sciences),46(2):218-224.]
宋飞彪,王伟洪,吴礼广,杨兵. 2012. 多子小瓜虫生态特性研究现状[J]. 河北渔业,(5):45-48. [Song F B,Wang W H,Wu L G,Yang B. 2012. The ecological property advanced research of Ichthyophthirius multifiliis[J]. Hebei Fishe-ries,(5):45-48.]
赵飞,韩刚,谭爱萍,姜兰. 2012. 过氧乙酸对小瓜虫幼虫和包囊的杀灭效果[J]. 广东农业科学,39(15):129-131. [Zhao F,Han G,Tan A P,Jiang L. 2012. Study of killing effects of peracetic acid to theronts and tomonts of Ichthyophthirius multifiliis[J]. Guangdong Agricultural Scien-ces,39(15):129-131.]
Bafica A,Santiago H C,Goldszmid R S,Ropert C,Gazzinelli R,Sher A. 2006. Cutting edge:TLR9 and TLR2 signa-ling together account for MyD88-dependent control of parasitemia in Trypanosoma cruzi infection[J]. The Journal of Immunology,177(6):3515-3519.
Becker I,Salaiza N,Aguirre M,Delgado J,Carrillo-Carrasco N,Kobeh L G,Ruiz A,Cervantes R,Torres A P,Cabrera N,González A,Maldonado C,Isibasi A. 2003. Leishmania lipophosphoglycan(LPG) activates NK cells through toll-like receptor-2[J]. Molecular and Biochemical Parasitology,130(2):65-74.
Brownlie R,Zhu J,Allan B,Mutwiri G K,Babiuk L A,Potter A,Griebel P. 2009. Chicken TLR21 acts as a functional homologue to mammalian TLR9 in the recognition of CpG oligodeoxynucleotides[J]. Molecular Immunology,46(15):3163-3170.
Campos M A,Closel M,Valente E P,Cardoso J E,Akira S,Alvarez-Leite J I,Ropert C,Gazzinelli R T. 2004. Impaired production of proinflammatory cytokines and host resistance to acute infection with Trypanosoma cruzi in mice lacking functional myeloid differentiation factor 88[J]. Journal of Immunology,172(3):1711-1718.
Clark T G,Gao Y,Gaertig J,Wang X,Cheng G. 2001. The I-antigens of Ichthyophthirius multifiliis are GPI-anchored proteins[J]. The Journal of Eukaryotic Microbiology,48(3):332-337.
Debierre-Grockiego F,Campos M A,Azzouz N,Schmidt J,Bieker U,Resende M G,Mansur D S,Weingart R,Schmidt R R,Golenbock D T,Gazzinelli R T,Schwarz R T. 2007. Activation of TLR2 and TLR4 by glycosylphosphatidylinositols derived from Toxoplasma gondii[J]. Journal of Immunology,179(2):1129-1137.
Finney C A,Lu Z,Hawkes M,Yeh W C,Liles W C,Kain K C. 2010. Divergent roles of IRAK4-mediated innate immune responses in two experimental models of severe malaria[J]. The American Journal of Tropical Medicine and Hygiene,83(1):69-74.
Guimarães-Pinto K,Nascimento D O,Corrêa-Ferreira A,Mo-rrot A,Freire-de-Lima C G,Lopes M F,DosReis G A,Filardy A A. 2018. Trypanosoma cruzi infection induces cellular stress response and senescence-like phenotype in murine fibroblasts[J]. Frontiers in Immunology,9:1569. doi:10.3389/fimmu.2018.01569.
Hkima A,Rachinel N,Klimczak M,Louis J,Doyen N. 2009. TLR9-dependent activation of dendritic cells by DNA from Leishmania major favors Th1 cell development and the resolution of lesions[J]. The Journal of Immunology,182(3):1386-1396.
Huang R,Dong F,Jang S,Liao L,Zhu Z,Wang Y. 2012. Isolation and analysis of a novel grass carp toll-like receptor 4(tlr4) gene cluster involved in the response to grass carp reovirus[J]. Developmental and Comparative Immunology,38(2):383-388.
Jiménez-Dalmaroni M J,Gerswhin M E,Adamopoulos I E. 2016. The critical role of toll-like receptors—From microbial recognition to autoimmunity:A comprehensive review[J]. Autoimmunity Reviews,15(1):1-8.
Kalantari N,Ghasemi M,Bayani M,Ghaffari S. 2016. Effect of honey on mRNA expression of TNF-α,IL-1β and IL-6 following acute toxoplasmosis in mice[J]. Cytokine,88:85-90.
Li Y W,Dan X M,Zhang T W,Luo X C,Li A X. 2011a. Immune-related genes expression profile in orange-spotted grouper during exposure to Cryptocaryon irritans[J]. Pa-rasite Immunology,33(12):679-687.
Li Y W,Luo X C,Dan X M,Huang X Z,Qiao W,Zhong Z P,Li A X. 2011b. Orange-spotted grouper(Epinephelus coioides)TLR2,MyD88 and IL-1β involved in anti- Cryptocaryon irritans response[J]. Fish & Shellfish Immunology,30(6):1230-1240.
Li Y W,Luo X C,Dan X M,Qiao W,Huang X Z,Li A X. 2012. Molecular cloning of orange-spotted grouper(Epinephelus coioides) TLR21 and expression analysis post Cryptocaryon irritans infection[J]. Fish & Shellfish Immunology,32(3):476-481.
Li Y W,Mo X B,Zhou L,Li X,Dan X M,Luo X C,Li A X. 2014. Identification of IRAK-4 in grouper(Epinephelus coioides) that impairs MyD88-dependent NF-κB activation[J]. Developmental and Comparative Immunology,45(1):190-197.
Li Y W,Zhao F,Mo Z Q,Luo X C,Li A X,Dan X M. 2016. Characterization,expression,and functional study of IRAK-1 from grouper,Epinephelus coioides[J]. Fish & Shellfish Immunology,56:374-381.
Liao Z,Wan Q,Su H,Wu C,Su J. 2017. Pattern recognition receptors in grass carp Ctenopharyngodon idella:I. Organization and expression analysis of TLRs and RLRs[J]. Developmental and Comparative Immunology,76:93-104.
Livak K J,Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2?ΔΔCT method[J]. Methods,25(4):402-408.
Oliveira A C,Peixoto J R,de Arruda L B,Campos M A,Gazzinelli R T,Golenbock D T,Akira S,Previato J O,Mendonca-Previato L,Nobrega A,Bellio M. 2004. Expression of functional TLR4 confers proinflammatory responsiveness to Trypanosama cruzi glycoinositolphospholipids and higher resistance to infection with T. cruzi[J]. Journal of Immunology,173(9):5688-5696.
Pietretti D,Scheer M,Fink I R,Taverne N,Savelkoul H F,Spaink H P,Forlenza M,Wiegertjes G F. 2014. Identification and functional characterization of nonmammalian Toll-like receptor 20[J]. Immunogenetics,66(2):123-141.
Sepulcre M P,Alcaraz-Pérez F,López-Muñoz A,Roca F J,Meseguer J,Cayuela M L,Mulero V. 2009. Evolution of lipopolysaccharide(LPS) recognition and signaling:Fish TLR4 does not recognize LPS and negatively regulates NF-κB activation[J]. Journal of Immunology,182(4):1836-1845.
Sullivan C,Charette J,Catchen J,Lage C R,Giasson G,Postlethwait J H,Millard P J,Kim C H. 2009. The gene history of zebrafish tlr4a and tlr4b is predictive of their divergent functions[J]. Journal of Immunology,183(9):5896-5908.
Tan Y,Kagan J C. 2017. Microbe-inducible trafficking pathways that control Toll-like receptor signaling[J]. Traffic,18(1):6-17.
Yarovinsky F,Zhang D K,Andersen J F,Bannenberg G L,Serhan C N,Hayden M S,Hieny S,Sutterwala F S,Flavell R A,Ghosh S,Sher A. 2005. TLR11 activation of dendritic cells by a protozoan profilin-like protein[J]. Science,308(5728):1626-1629.
Yuk J M,Jo E K. 2011. Toll-like receptors and innate immunity[J]. Journal of Bacteriology and Virology,41(4):225. doi:10.4167/jbv.2011.41.4.225.
Zhao F,Li Y W,Pan H J,Shi C B,Luo X C,Li A X,Wu S Q. 2013a. Expression profiles of toll-like receptors in channel catfish(Ictalurus punctatus) after infection with Ichthyophthirius multifiliis[J]. Fish & Shellfish Immuno-logy,35(3):993-997.
Zhao F,Li Y W,Pan H J,Shi C B,Luo X C,Li A X,Wu S Q. 2014. TAK1-binding proteins(TAB1 and TAB2) in grass carp(Ctenopharyngodon idella):Identification,cha-racterization,and expression analysis after infection with Ichthyophthirius multifiliis[J]. Fish & Shellfish Immuno-logy,38(2):389-399.
Zhao F,Li Y W,Pan H J,Wu S Q,Shi C B,Luo X C,Li A X. 2013b. Grass carp(Ctenopharyngodon idella) TRAF6 and TAK1:Molecular cloning and expression analysis after Ichthyophthirius multifiliis infection[J]. Fish & Shellfish Immunology,34(6):1514-1523.
Zhi T,Xu X,Chen J,Zheng Y,Zhang S,Peng J,Brown C L,Yang T. 2018. Expression of immune-related genes of Nile tilapia Oreochromis niloticus after Gyrodactylus cichlidarum and Cichlidogyrus sclerosus infections demonstra-ting immunosupression in coinfection[J]. Fish & Shellfish Immunology,80:397-404.
Zhou S,Li W X,Zou H,Zhang J,Wu S G,Li M,Wang G T. 2018. Expression analysis of immune genes in goldfish (Carassius auratus) infected with the monogenean parasite,Gyrodactylus kobayashii[J]. Fish & Shellfish Immunology,77:40-45.
Zhu J,Krishnegowda G,Li G,Gowda D C. 2011. Proinflammatory responses by glycosylphosphatidylinositols(GPIs) of Plasmodium falciparum are mainly mediated through the recognition of TLR2/TLR1[J]. Experimental Parasitology,128(3):205-211.
(責任编辑 兰宗宝)
