广东地区结核分枝杆菌吡嗪酰胺耐药的pncA、rpsA 、panD基因分型特征研究
2019-09-10关平
关 平
(广州市胸科医院检验科,广东广州 510095)
结核杆菌感染是结核病的病因,近年来,由于抗结核治疗不规范,多重耐药结核杆菌逐渐增多,给结核病的防治造成了很大的麻烦[1]。抗结核治疗中,吡嗪酰胺是必不可少的一种药物,但目前发现,有很多结核病患者分离出的菌株中存在吡嗪酰胺耐药[2]。既往研究提示,吡嗪酰胺耐药结核菌株与结核杆菌中某些基因的突变存在一定关系,如pncA、rpsA、panD等,但亦有研究指出上述基因突变存在一定的地域特征[3]。因此,笔者就广东地区结核分枝杆菌的基因分型特征进行研究,以期寻找适合广东地区吡嗪酰胺耐药结核菌治疗的研究方向。
1 资料与方法
1.1标本来源 收集2015年12月至2018年2月在本院就诊的327例结核病患者的痰液标本,并统计患者入院时一线药敏结果,其中多重耐药菌(MDR)94株,非MDR 233株。本次研究经本院医学伦理委员会审核通过。
1.2方法
1.2.1痰液样本收集 患者晨起后,用清水漱口,嘱患者用力咳出肺部深部的痰液,收集于无菌样本保存管中密封。若痰液标本为脓样、干酪样或脓性黏液样性质的痰液,痰液体积3.0~5.0 mL,则认为收集的痰液合格;若不合格,则第2天再次按上述方法收集痰液。所采集到的样本储存于4 ℃中,24 h内进行基因型检测。
1.2.2结核分枝杆菌核酸检测 采用由上海仁度生物科技有限公司提供的结核分枝杆菌核酸检测试剂盒(RNA恒温扩增)检测痰液标本中结核分枝杆菌的基因型。取收集的痰液1.5 mL,加入3.0 mL的4% NaOH,涡旋震荡1 min后,室温孵育15~20 min。取1.0 mL液化后的痰液标本于样品处理管内,以13 000 r/min离心5 min,弃上清。加入1 mL生理盐水重悬,再次离心弃上清,加入50 μL稀释液重悬后为待测样品。将2 μL阳性对照或阴性对照加入198 μL稀释液中,混匀备用。将50 μL待测样品或阴性、阳性对照,以300 W超声处理15 min,取2 μL处理后液体加入含有30 μL扩增检测的微量反应管中,将反应管置于热恒温器上60 ℃保温10 min,再将反应管移至恒温混匀仪42 ℃保温5 min后,将预热的10 μL酶液加入反应管内,以1 200 r/min震荡15 s混匀混合液。将反应管放入ABI7500实时荧光定量PCR仪(Applied Biosystems)。反应程序设定为:荧光素通道设定为FAM,42 ℃ 1 min,40个循环,每分钟收集1次荧光信号,共检测40次。实验结束后将反应管直接浸泡于10% 84消毒液中,严禁打开反应管,实验完成后需用10% 84消毒液清洁工作区和用具。当阴性对照dt值无数值或为40,而阳性对照dt≤35时,说明本批次实验质量可,所得结果可信。当检测样品dt≤35时为样品阳性,检测样品dt无数值或为40时为样品阴性;对样品dt>35~<40的样品进行重测,当检验结果dt<40,则样品阳性。
1.2.3吡嗪酰胺药敏测定 采用Bactectm MGIT 960 全自动分枝杆菌检测,按照标准操作手册,液体培养基为pH=5.9 Middlebrook 7H9,其中吡嗪酰胺含量为100 μg/mL,测定吡嗪酰胺药敏结果。
1.2.4结核分枝杆菌基因测序 采用由广州蓝吉生物技术有限公司提供的磁珠法痰液DNA提取试剂盒,根据公司提供的说明书,从患者痰液样品中提取DNA。将合格的DNA样品进行PCR,反应体系为KAPA HiFi Hot Start Ready Mix (Kapa Biosystems) 25 μL,DNA 模版1 μL,引物各1 μL(10 mmol/L),水23 μL。反应条件为95 ℃ 3 min;98 ℃ 20 s,62 ℃ 15 s,72 ℃ 2 min,30个循环;72 ℃ 5 min延伸。扩增pncA、rpsA、panD基因所用的引物序列见表1。PCR产物采用Cycle pure kit(Omega)进行纯化后送华大基因公司进行Sanger测序。测序结果采用Clustalx和DANstar进行分析。

表1 pncA、rpsA 、panD基因引物序列

2 结 果
2.1痰液结核分枝杆菌核酸检测情况及吡嗪酰胺耐药情况 本研究共收集327份结核患者痰液标本,经结核分枝杆菌核酸检测,317份痰液标本为阳性,阳性率为96.94%。根据吡嗪酰胺耐药结果,327株分离株中吡嗪酰胺耐药102株,吡嗪酰胺敏感225株,耐药率为31.19%。其中,MDR菌株的吡嗪酰胺耐药率为58.51%,而非MDR菌株的吡嗪酰胺耐药率为20.17%,MDR菌株的吡嗪酰胺耐药率显著高于非MDR菌株(P<0.05)。见表2。

表2 吡嗪酰胺药敏检测结果
2.2pncA突变情况分析 225株吡嗪酰胺敏感株中未发现pncA突变,102株吡嗪酰胺耐药株中有67株发现pncA基因突变,突变率为65.69%。55例吡嗪酰胺耐药的MDR菌株中,发现pnaA突变有45例,显著高于吡嗪酰胺耐药的非MDR菌株pncA基因突变率22/47(χ2=13.781,P=0.000)。见表3。

表3 吡嗪酰胺耐药的MDR菌株的pncA基因突变情况
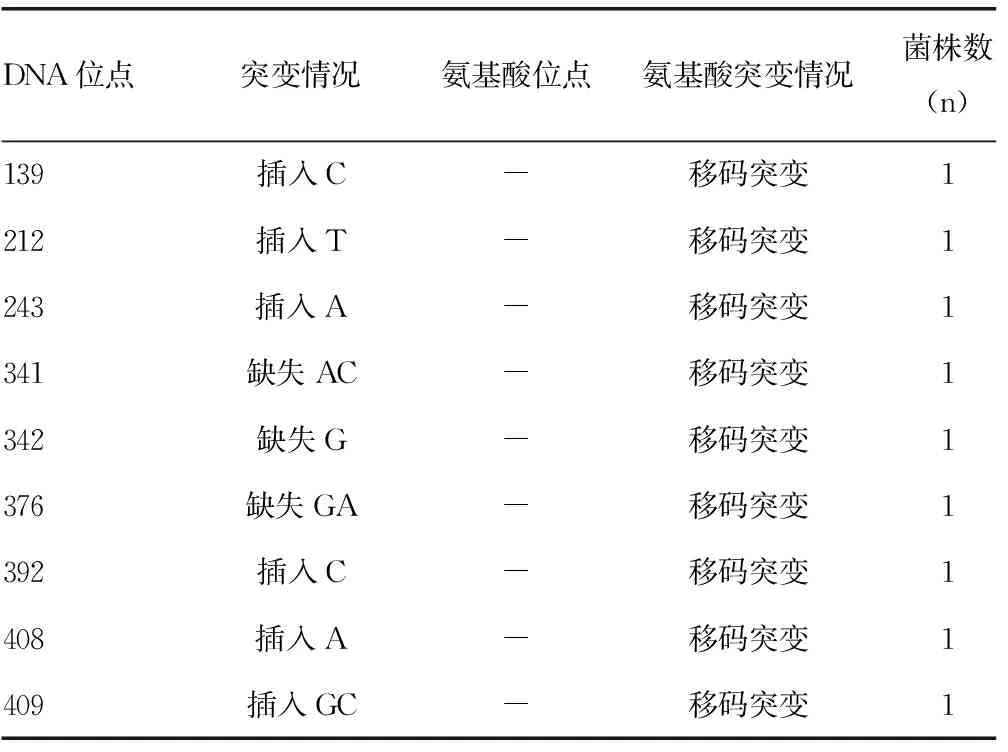
续表3 吡嗪酰胺耐药的MDR菌株的pncA基因突变情况
注:-表示无氨基酸位点
2.3rpsA突变情况分析 102株吡嗪酰胺耐药株中检测出5株rpsA突变,突变率为4.90%;225株吡嗪酰胺敏感株中检测出1株rpsA突变,突变率为0.44%。吡嗪酰胺耐药菌株的rpsA突变率显著高于吡嗪酰胺敏感菌株(χ2=7.476,P=0.006)。见表4。

表4 吡嗪酰胺耐药菌株的rpsA基因突变情况
注:-表示无氨基酸位点
2.4panD突变情况分析 105株吡嗪酰胺耐药株中检测到1株panD突变,为G419→A突变,突变率为0.95%。吡嗪酰胺敏感株中未检测到panD突变。
3 讨 论
结核分枝杆菌是引起结核病的病原菌,可侵犯全身各个器官,以肺结核最为常见。而我国的结核病患者例数位于全世界第2,结核病对国家卫生和社会经济都造成了严重的负担[4]。由于药物使用不规范或其他原因,近年来多重耐药性结核杆菌的发病率越来越高,增加了结核病的发病率和死亡率[5]。目前,检验科多采用细菌培养+药敏试验,耗时较长,无法让患者得到及时的治疗。因此,通过深入了解结核分枝杆菌基因组和耐药的分子机制,寻找更为快速的、准确的诊断结核分子杆菌和药敏检测的方式是十分必要和紧迫的。
吡嗪酰胺能够渗透入吞噬细胞后进入结核杆菌菌内,使其内在的酰胺酶脱去酰胺基,转化为吡嗪酸而发挥抗菌作用,此外,吡嗪酰胺还能取代烟酰胺阻止脱氢作用,妨碍结核杆菌对氧的利用,影响细菌的正常代谢,造成细菌死亡[6-7]。该药在抗结核治疗中起到了无可代替的作用。但近年来的研究显示,对MDR结核杆菌吡嗪酰胺的耐药率较高,显著高于非MDR结核杆菌的吡嗪酰胺耐药率[8],与本研究的结果相近。国内外的研究报道提示,吡嗪酰胺耐药性的产生与pncA突变造成吡嗪酰胺活性降低有关[9]。本研究收集广东地区结核病患者的样本进行分析,发现吡嗪酰胺耐药株中pncA的基因突变率为65.69%,略低于国内报道的80.00%左右的基因突变率[10],这一结果提示pncA基因突变存在一定的地区差异及在特定地区调查pncA基因突变的必要性。有研究指出,吡嗪酰胺耐药的pncA基因突变位点较为集中,与吡嗪酰胺二级结构的酶活性位点、结合位点等有关[11]。但本研究中,pncA基因突变位点未见明显的聚集,这提示吡嗪酰胺耐药可能存在未知的分子机制,或吡嗪酰胺存在未知的结构变化。
除了pncA基因,rpsA和panD基因也与吡嗪酰胺耐药存在很大的关系[12]。本研究中检测到5株rpsA基因突变和1株panD基因突变的吡嗪酰胺耐药菌株。本研究中检测到rpsA基因突变有部分位点与既往的报道相似,但也有部分位点与既往的报道不同,提示rpsA基因突变也可能存在地域特征[13-14]。而本研究中检测到1株panD基因突变,G419→A,与国内的报道相似[15],提示panD基因与panA、rpsA基因不同,panD基因的保守性更强,可能作为治疗结核杆菌,特别是吡嗪酰胺耐药性结核杆菌的治疗靶点。
4 结 论
本研究发现,在中国广东地区,结核分枝杆菌吡嗪酰胺耐药率较高,其中pncA基因突变较多,突变位点较为分散;而吡嗪酰胺耐药结核分枝杆菌中rpsA基因突变和panD基因突变均值得进一步关注。本研究揭示了我国广东地区结核分枝杆菌的基因分型特征,为临床治疗用药提供了参考依据。
