负负得正的癌症免疫疗法
2019-09-10陈辰李斌
陈辰 李斌
2018年度的诺贝尔生理学或医学奖授予美国免疫学家艾利森和日本免疫学家本庶佑.以表彰他们发现抑制免疫负调节的癌症疗法.从根本上改变了人们对癌症冶疗方式的看法。
2018年10月1日,2018年诺贝尔生理学或医学奖揭晓。美国免疫学家艾利森(J.P.Allison)教授与日本免疫学家本庶佑(T.Honjo)教授因在癌症免疫治疗领域的奠基性工作而摘得桂冠。艾利森是美国得克萨斯大学安德森癌症中心免疫学研究负责人,是分离出T细胞抗原复合物蛋白的第一人,他同时发现,如果暂时抑制T细胞表面的CTLA-4这一免疫系统分子“制动器”的活性,就能提高免疫系统对肿瘤细胞的攻击性,杀伤肿瘤,从而缩小肿瘤体积。他对T细胞的发育和激活,以及免疫系统“制动器”机理的卓越研究,为癌症治疗开创了全新思路。本庶佑现任京都大学高等研究院特别教授,他建立了免疫球蛋白类型转换的基本概念框架,提出了一个解释抗体基因在模式转换中变化的模型,首先鉴定PD-1为活化T细胞上的诱导型基因,这一发现为PD-1阻断建立癌症免疫治疗原理做出了重大贡献。
癌症的免疫治疗
癌症是由不受控制的细胞增殖和迁移所引起的一系列恶性病变的统称,从器官开始浸润相邻组织开始,最终通过血液或淋巴转移到其他器官,导致发病和死亡。癌症的病因和发病机制很复杂,其特征有的与调节分裂、死亡、代谢和迁移等内在的细胞过程有关,有的则体现为肿瘤微环境与形成血管、基质或免疫系统的细胞之间的相互作用[1]。各种特征受多种因素的影响,这些因素会因癌细胞基因的变化而变化,其中一些变化通过种系DNA遗传得到,而大部分变化则是在体细胞突变后发生。
目前治疗癌症有三大手段:手术切除,辐射消除,药物攻击。虽然在过去50多年里,癌症治疗有了很大的进展,但是平均来说,有超过2/3的癌症患者无法痊愈,很多癌症的治愈率维持在较低水平,全球每年有数百万人死于癌症。因此,对于新治疗方法和策略的需求十分迫切。
早在19世纪末20世紀初,人们意识到激活免疫系统可能是一种攻击肿瘤细胞的策略。纽约癌症医院(纪念斯隆一凯特琳癌症中心的前身)的外科医生科利(W.Coley)曾试图用已高温杀死的细菌刺激免疫系统来对抗恶性肿瘤。他发现一些在癌症手术后发生感染的患者,其存活的时间似乎更长,由此推测病原体在机体内激起的免疫反应可能会影响肿瘤。之后,对免疫系统的深入研究揭示了人体防御系统的分子组成、化学介质及精确控制该系统的分子开关,人们逐渐了解了免疫系统是如何动员起来的,进而发现可能引起严重感染的病原体,包括细菌和病毒。同样重要的是,人们对调节免疫系统抗癌应答机制和通路也有了深入了解,其中,免疫检查点(immune checkpoints)是大量分布在免疫系统中的抑制性通路,对维持机体自身的耐受、免疫应答的时间和强弱起着关键的调节作用,它们在免疫激活后开始参与反应,将免疫反应对周围组织可能造成的损伤减少到最小,避免正常组织受损。
免疫系统中的“加速器”和“制动器”
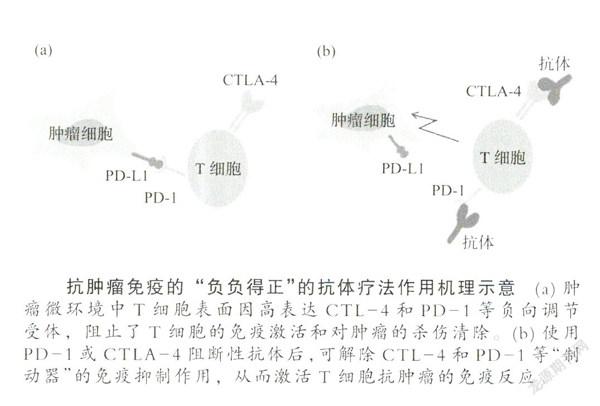
机体免疫系统的基本属性是能够区分“自我”和“非自我”,从而可以攻击和消除入侵的细菌、病毒等病原体及其他危险信号。第一道防线是机体的固有免疫系统,抗肿瘤免疫的“负负得正”的抗体疗法作用机理示意(a)肿瘤微环境中T细胞表面因高表达CTL-4和PD-1等负向调节受体,阻止了T细胞的免疫激活和对肿瘤的杀伤清除。(h)使用PD-1或CTLA-4阻断性抗体后,可解除CTL-4和PD-1等“制动器”的免疫抑制作用,从而激活T细胞抗肿瘤的免疫反应由白细胞(如中性粒细胞和单核细胞)负责协调,进行对细菌和病毒的非特异性免疫反应,专门识别细菌或病毒中常见的分子结构,如部分表面结构,或有别于高等生物的DNA和RNA分子,尽管这些白细胞并不能特异性地识别并攻击某些蛋白结构,却能抵挡许多微生物的人侵,将其分解成小分子片段,即所谓的抗原。之后,免疫系统便会将抗原视为异物,予以消灭。第二道防线是适应性免疫系统,专门识别抗原,继而发动更精准的免疫攻击。如果攻击有效,机体就会产生对该种病原的“记忆”,一旦再遇相同的入侵病原体,便能轻易将其击溃,T细胞和B细胞是适应性免疫反应的核心角色。T细胞发源于胸腺,有多种类型,B细胞来自骨髓,能制造抗体。抗体分子与T细胞上一些特定的分子结构一样,能够附着在特定的抗原上,这样就可锁定目标,通过免疫反应消灭细菌和表面带有抗原的受感染细胞
肿瘤细胞是发生了遗传变异等病理变化的自体细胞,会表达异常的分子,这些分子对T细胞或B细胞来说就是异物,所以免疫系统能识别出肿瘤细胞。但是,在多种因素的作用下,机体对于肿瘤的免疫攻击并未产生显著效果。不懈的努力之下,科学家发现肿瘤细胞会与免疫系统的“制动器”协同作用,抑制机体针对肿瘤细胞的免疫反应,逃避了免疫系统的攻击,这一原理为癌症的免疫治疗开辟了一条新思路。
每个T细胞都有独特的受体,它们类似免疫系统的“加速器”,可以与被识别出的非自身抗原结合,激活免疫反应。但是,在肿瘤组织微环境下,由于杀伤性T细胞表面的负向调控受体蛋白(如PD-1)被肿瘤细胞表达的负向信号受体的配体蛋自(如PD-L1)结合,抑制了T细胞的激活,从而制动了抗肿瘤的免疫反应。现已确定了一批T细胞表达的具负向调控功能的表面受体蛋自,这些蛋白像“制动器”一样抑制免疫激活。机体通过控制加速器蛋白和制动器蛋白之间微妙的平衡,确保免疫系统充分参与对外来微生物的攻击,同时又避免过度激活带来的自身免疫性破坏。
许多T细胞都能表达CTLA-4蛋白,在细胞静息时它驻留在T细胞内部,当特定的T细胞识别出作用目标,同时接收到来自其他分子的启动信号时,该蛋白被激活。一旦激活,CTLA-4就与其他蛋白协同作用,于扰由T细胞受体和共刺激分子受体引发的正信号,成为一种T细胞活化的负调节因子,起到“制动器”的作用,防止过度活跃的免疫系统对机体自身造成破坏。如果CTLA-4蛋自永久性缺乏,将会引发灾难性的自身免疫反应。
肿瘤免疫检查点阻断技术
随着对肿瘤细胞逃避免疫系统识别和清除的机制了解得越来越清晰,人们可以通过重新“关闭”一些被肿瘤细胞激活的、会对免疫系统产生抑制功能的通路,释放机体的免疫抑制,达到阻止肿瘤细胞发生免疫逃逸、调动自身免疫系统功能来消除肿瘤的目的。这种被称为肿瘤免疫检查点阻断技术,已成为肿瘤免疫治疗的主要研究方向,相应的药物研发也成为国内外企业竞相角逐的市场)
针对CTLA-4蛋白的阻断
1994年底,艾利森提出假设:如果能暂时抑制CTLA-4这一分子“制动器”的活性,是否就能提高免疫系统对肿瘤细胞的攻击性,从而缩小肿瘤的体积。他用抗CTLA-4的单克隆抗体处理患有肿瘤的小鼠,结果抑癌效果相当显著。并发现这种针对免疫系统的疗法具有完全治愈荷瘤小鼠的潜力,阻断CTLA-4会增强T细胞的抗肿瘤反应,排斥反应后是持久的肿瘤免疫。这项工作象征了免疫疗法的诞生,具有重新释放机体对肿瘤反应能力的单克隆抗体则被称为免疫检查点抑制剂。
当时的制药业对于基于去除免疫应答制动的肿瘤免疫治疗并无太大兴趣,因为不知道哪些特异性抗原能在肿瘤细胞上被识别,也不符合当时普遍认为的应基于发现并激活肿瘤抗原的肿瘤治疗策略。而且,缺乏CTLA-4的小鼠会产生严重的自身免疫反应,这种不良反应有很大风险,使人望而却步。然而,通过坚持不懈的努力,艾利森与一家生物技术公司合作,成功地制备出可临床使用的抗CTLA-4人源化单克隆抗体1999年他们开发出名为MDX-010的抗CTLA-4 IgG l单克隆抗体,也就是后来的伊匹单抗[ipilimumab),并招募那些对其他疗法完全无应答的晚期癌症患者进行临床试验。第一次临床试验中就在一些黑色素瘤患者身上观察到响应。同年,在另一项黑色素瘤患者治疗试验中,结果显示黑色素瘤可完全消退,同时也观察到患者产生了严重的自身免疫反应,这些反应比采用化疗方式之后出现的更频繁。这种方法的疗效很难通过测量肿瘤体积来判断,因此,研究人员采用了一个既简单又重要的标准来评判伊匹单抗的疗效,这一标准就是“整体存活期”,即患者的生存时间。最新临床试验结果显示,伊匹单抗治疗后,20%以上的转移性黑色素瘤患者的病情在较长时间内得到了控制,治疗后存活时间达3年以上。而之前的转移性黑色素瘤患者的中位预期寿命僅为7~8个月。
针对PD-1蛋白的抑制
本庶佑小组在1990年代早期发现并克隆了PD-1,其功能多年来一直难以捉摸,通过十多年对缺乏这种分子的基因敲除小鼠的研究发现,敲除了PD-1的小鼠类似于敲除了CTLA-4的小鼠,会发生T细胞驱动的自身免疫综合征。本庶佑由此得出结论,PD-I与CTLA-4类似,对免疫反应起负调节作用,并发现了它的配体PD-L1,不久又确定了PD-1的第二种配体PD-L2。
PD-I/PD-L1途径可能参与肿瘤免疫反应的假设,最早在2002年发表的两项研究中得以测试证实,该配体(PD-L1)的表达可保护转化细胞免受体内免疫系统攻击,并可通过针对PD-L1的抗体逆转结果[2,3]。现在已经了解PD-1 /PD-L1途径在肿瘤免疫过程中的作用。
2005年本庶佑发表了用于治疗小鼠肿瘤模型的PD-1抗体的工作,提出现今仍可用来预测临床疗效的结论:抗PD-1治疗可诱导免疫反应,甚至对不表达PD-L1或PD-L2的肿瘤也能诱导出免疫反应;在肿瘤治疗上比CTLA-4更有效;产生的自身免疫不良反应没有CTLA-4的严重。这一进展促进了基于PD-1抑制的临床研究,已开发出针对PD-1的临床级抗体,2006年开始的第一阶段临床研究表明,该药具良好的耐受性[4]。两年后报道在一期临床研究中,296名患者使用抗PD-I抗体的结果显示,该抗体在治疗黑色素瘤等多种实体瘤方面效果显著。
癌症免疫疗法的愿景
免疫检查点治疗法从根本上改变了某些晚期癌症患者的生存状况。虽然与其他癌症疗法相比,不良反应依然可见,有些甚至会严重到危及生命,但是,它已经从根本上改变了人类对癌症治疗方式的看法,科学家将会不懈地研究,去改善治疗方法和减少不良反应。
肿瘤免疫检查点阻断技术的研究主要集中在CTLA-4、PD1、PD-L1只个分子上。CTLA-4阻断疗法的主要弱点在于免疫毒性作用的高速率,接受抗CTLA-4治疗的患者会发生许多不良反应,从而限制了它的广泛应用。而PDl/PD-L1这一对免疫检查点的表达更具选择性,不会在正常炎性组织中过度表达,应用更安全,不良反应更小。
在临床治疗策略方面,针对PD-1检查点治疗被证明更为有效,它在包括肺癌、肾癌、淋巴瘤和黑色素瘤在内的多种癌症治疗中都有显著效果。更进一步,新的临床研究表明,针对CTLA-4和PD-I的联合治疗可能更为有效。艾利森和本庶佑也鼓励人们努力结合不同的策略来激发免疫系统的反应,以便更有效地消除肿瘤细胞。期待在科学家、医生、患者及其家庭、制药企业和政府管理者等各方面的密切合作下,抗肿瘤免疫疗法将会不断得到改进,从而治愈更多癌症患者,造福社会大众。
[1]Bailey M H,Tokheim C,Porta-Pardo E,et al.Comprehensivecharacterization of cancer driver genes and mutations.Cell,2018,173(2):371-385.e18.
[2]Agata Y,Kawasaki A,Nishimura H,et al.Expression of the PD-1antigen on the surface of stimulated mouse T and B lymphocytes.IntImmunol,1996,8(5):765-72.
[3]Ansell S M,Lesokhin A M,Borrello I,et al.PD-I blockade withnivolumab in relapsed or refractory Hodgkin's lymphoma.N Engl JMed,2015,372(4):311-9
[4]Brahmer J R,Drake C G,Wollner I,et al.Phase I study of single-agent anti-programmed death-1(MDX-1106) in refractory solidtumors:safety,clinical activity,pharmacodynamics,and immunologiccorrelates.J Clin Oncol,2010,28(19):3167-75.
关键词:诺贝尔生理学或医学奖 癌症 免疫疗法 CTLA-4PD-1
