基于多模态影像学检查对小肠病变的研究
2019-09-10韦明炯赵宇新温界玉马党捐康彦智张林凤刘雨峰杜苗娜
韦明炯 赵宇新 温界玉 马党捐 康彦智 张林凤 刘雨峰 杜苗娜



通訊作者:韦明炯,1976年11月,汉,陕西澄城人,主治医师,学士。研究方向:胸腹部疾病的综合影像诊断。
摘要:目的:探讨多模态影像学CT和MRI小肠检查对于小肠病变诊断的临床意义,以提高小肠病变的诊断与鉴别诊断水平。材料与方法:研究收集初治小肠病变患者60例,所有患者均接受CT和MRI多模态影像学口服小肠造影检查。观察分析CT和MRI两种图像显示的小肠病变部位、范围、累及肠管的形态、肠腔的变化、肠管周围脂肪间隙、病变近段以及远段肠管的情况。以小肠镜或者手术病理结果为金标准,对比分析两种影像学检查方式的准确率、敏感性以及特异性。两组间比较采用t检验。最后评估多模态影像学检查CT以及MRI诊断小肠病变中的意义。结果:① 小肠镜或者手术病理结果显示,所选60例小肠病变,其中22例小肠腺癌,19例间质瘤,7例淋巴瘤,9例小肠炎性病变以及3例脂肪瘤。病变部位的分布为:9例位于十二指肠,32例位于空肠以及19例位于回肠;② CT、MRI表现:小肠腺癌病变较为局限,密度/信号不均匀,增强扫描不均匀强化,肠壁不均匀增厚、僵硬,肠腔变窄,周围脂肪间隙不清、部分可见小淋巴结,部分患者近段小肠管腔扩张。小肠间质瘤病变局限,部分可有溃疡形成与肠腔相通,可位于小肠或小肠外,增强扫描延迟强化。淋巴瘤呈现没有坏死、钙化灶的均匀密度/信号,边界清楚,浸润型呈肠壁增厚,约1.0-3.2cm,没有结节形成,无胃肠黏膜破坏。溃疡型以及肿块型粘膜受到破坏。增强扫描中度均匀强化,黏膜明显强化,肠壁柔软呈同心圆征。炎性病变表现为肠壁局部增厚,周围多发渗出,肠管没有狭窄或扩张。脂肪瘤表现为肠壁局限性脂肪密度/信号,增强扫描没有强化;③ 多模态影像学CT、MRI造影检查对于小肠病变的发现率分别为:95.0%(57/60)以及96.7%(58/60)。诊断小肠病变的准确率为93.3%与95.0%,敏感性为95.0%与96.7%,特异性为100.0%与100.0%,以上差异均无统计学意义,P > 0.05。结论:多模态影像学CT与MRI小肠造影创伤小,对小肠病变的诊断准确率高,具有很高的临床价值,都是小肠病变的有效检查措施。
关键词:多模态CT;多模态MRI;小肠病变;诊断研究
Abstract:Objective: To explore the clinical significance of multi-modality CT and MRI in the diagnosis of small intestinal lesions in order to improve the diagnosis and differential diagnosis of small intestinal lesions. Methods: A total of 60 patients with newly treated small intestinal diseases were studied. All patients underwent CT and MRI multimodal imaging and oral small intestinal contrast examination. The location, extent, shape of intestinal tract involved, changes of intestinal cavity, fat space around intestinal tract, proximal and distal intestinal tract were observed and analyzed on CT and MRI images. The accuracy, sensitivity and specificity of the two imaging methods were compared and analyzed based on the results of enteroscopy or surgery and pathology as the gold standard. T-test was used for comparison between the two groups. Finally, the significance of multimodal imaging in the diagnosis of small intestinal lesions by CT and MRI was evaluated. Results: ① The results of enteroscopy or surgical pathology showed that 22 cases of small intestinal adenocarcinoma, 19 cases of stromal tumors, 7 cases of lymphoma, 9 cases of small intestinal inflammatory lesions and 3 cases of lipoma were selected. Distribution of lesions was as follows: 9 cases were located in duodenum, 32 cases in jejunum and 19 cases in ileum. ② CT and MRI manifestations: small intestinal adenocarcinoma lesions are relatively limited, density/signal heterogeneity, uneven enhancement, uneven thickening and stiffness of intestinal wall, narrowing of intestinal cavity, ambiguous fat gap around, some lymph nodes can be seen, and some patients with proximal small intestinal lumen dilatation. The lesions of small intestinal stromal tumors are limited. Some of them may have ulceration which is connected with the intestinal cavity. They may be located in the small intestine or outside the small intestine. On enhanced scanning, it shows that delayed enhancement. Lymphomas were homogeneous density/signal without necrosis or calcification, with clear boundary and infiltrating gastrointestinal wall thickening, about 1.0-3.2cm, without nodule formation and mucosal destruction. Ulcerative mucosa and mass mucosa were destroyed, moderately homogeneous enhancement, mucosa was obviously enhanced, intestinal wall was soft with concentric circle sign. Inflammatory lesions are characterized by localized thickening of the intestinal wall, multiple exudations around it, and no stricture or dilation of the intestinal tract. Lipoma manifested as localized adipose density/signal in intestinal wall without enhancement on enhanced scan. ③ The detection rates of small intestinal lesions by multi-modality CT and MRI were 95.0%(57/60) and 96.7%(58/60). The diagnostic accuracy and sensitivity of these methods were 93.3% and 95.0%, 95.0% and 96.7%, 100.0% and 100.0%. There was no significant difference between the two methods, P > 0.05. Conclusion: Multimodal imaging CT and MRI enterography are minimally invasive and have diagnostic accuracy for small intestinal lesions. They are both effective measures for small intestinal lesions.
Keywords: Multimodal imaging CT; multimodal imaging MRI; small intestinal lesions; diagnostic study
一、引言
小肠是腹腔内部食物消化吸收最为重要的场所。小肠结构冗长迂曲,互相重叠而且不断蠕动,所以小肠病变的诊断不论对于临床医生还是影像科医生都是一大难题[1]。临床上小肠病变的早期临床特征没有特异性,而且缺乏有效的诊断手段[2]。临床医生常常将开腹探查手术病理作为小肠病变诊断的金标准[3],然而开腹创伤大,并且不利于患者小肠疾病的预后[4]。
传统的小肠影像学成像方法是气钡双重造影检查,然而其对患者的身体有一定影响,且诊断要求高。目前影像学检查方法不断发展,对于小肠病变的有效检查方法需要没有创伤、没有电离辐射,同时可以清晰地显示小肠肠腔以及肠壁的情况。计算机断层扫描(CT)、磁共振成像(MRI)是理想的诊断方法,在小肠病变的诊断中地位及其重要。两者操作简单,成像时间快,空间分辨率高,可以清晰的区别小肠肠壁以及肠腔内外的组织[5-6]。同时随着多模态影像学的不断发展,CT和MRI在腹部疾病尤其是小肠病变的检查中日益重要[7-8]。目前临床上多模态fMRI已经广泛应用在阿尔茨海默病(Alzheimer’s disease, AD)、脑梗塞、癫痫等脑功能异常的病变中[9-10]。同时,随着双源CT分辨率的不断提高,在心脏检测中的优势也在不断显现[11]。
当前,对于多模态CT、MRI在小肠病变的检查效果以及诊断水平,各个研究机构意见不一。为此,本研究将对可疑小肠病变的患者进行CT、MRI小肠造影检查,观察分析两种检查方式优点与不足,以便提高临床人们的认识,更好地普及与规范,在临床小肠病变的诊断中进行更好的推广应用。
二、资料与方法
(一)临床资料
2016年5月-2018年5月我院消化科收治的小肠病变初治患者60例,男34例,女26例;平均年龄(54.7±10.8)岁。临床症状主要有发热、腹胀、腹痛、黑便等。纳入标准:① 临床表现、实验室检查可疑小肠病变患者;② 没有小肠造影禁忌症患者;③ 没有急性消化道出血患者;④ 一般情况良好,不伴有肝肾功能异常。本研究经我院伦理委员会审批同意执行,患者入组时详细向其及家属交代实验相关内容及研究目的,并签署知情同意书。所有入选患者都经过小肠镜病理活检或者手术病理检查进行确诊。
(二)检查方法
1. 扫描前准备
患者检查前禁饮、禁食12小时,检查前12小时患者进行碘过敏试验,提前告知患者碘造影剂注射后会出现的感受,叮嘱患者扫描过程中如果有不适情况要及时示意。采用等渗甘露醇溶液作为扩张肠道的阴性对比剂。扫描前45分钟内分4-5次均匀服用2.5%等渗甘露醇溶液2000mL(1750mL生理盐水与250mL甘露醇溶液配制而成)。合并肠梗阻患者可根据患者不同梗阻程度适量减小或者不服用等渗甘露醇溶液。为减少扫描过程中呼吸运动造成的呼吸伪影,扫描前严格对每位进行呼吸训练。
2. 扫描方法
多模态CT扫描采用日本东芝公司Aquilion64排128层螺旋扫描机器。扫描范围为膈顶至耻骨联合下缘。经肘静脉高压注入对比剂300mL碘海醇(300mg/mL),速度为3.0-4.0mL/s,进行多期增强扫描,分别为25秒为动脉期,60秒为门脉期,3分钟为平衡期以及5分钟延迟扫描。扫描参数:管电压120kV,管电流180mAs,床移动速度为24mm/s,螺距为0.986:1。扫描后数据传至飞利浦工作站进行图像的后处理,如多平面重建(MPR)、最大密度投影(MIP)。层厚1.2mm,层间距0.6mm。
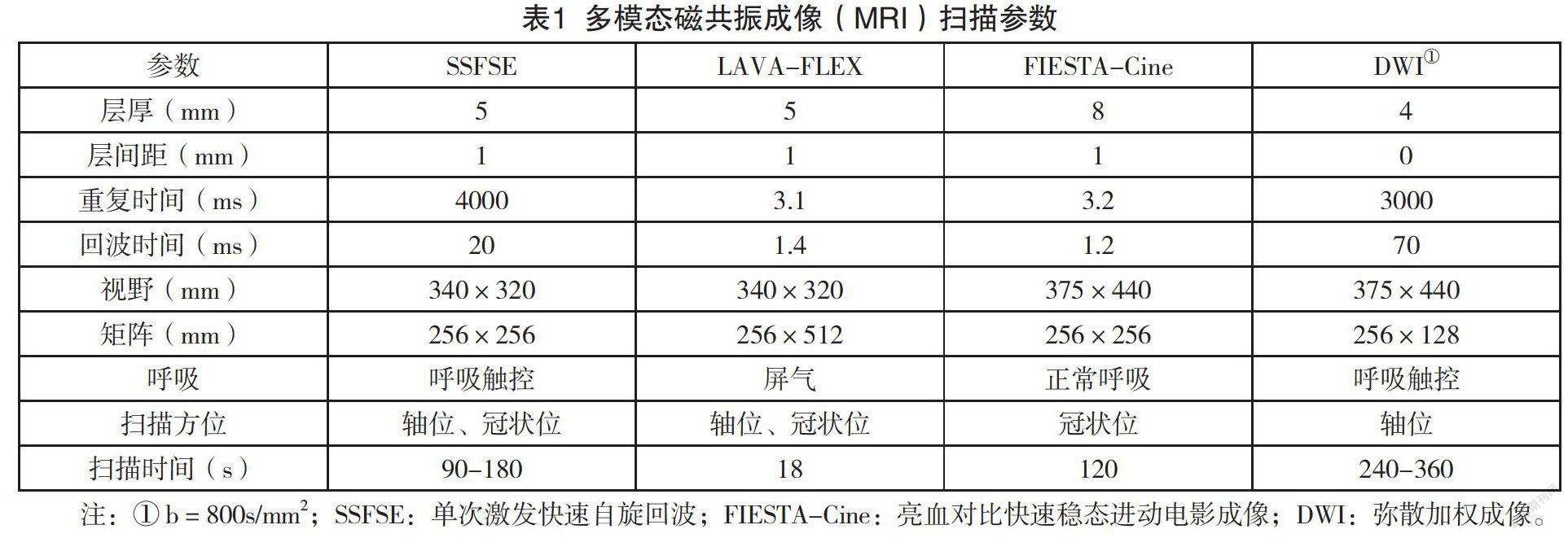
多模态MRI扫描采用美国GE公司 Signal 1.5T MRI进行检查。经肘静脉高压注入对比剂15-30ml马根维显,进行多期增强扫描,分别为25秒為动脉期,60秒为门脉期,3分钟为平衡期以及5分钟延迟扫描。扫描参数见表1。
3. 图像处理
所有CT和MRI检查图像均由两位高年资有放射科诊断经验的医生共同对图像进行观察与分析。扫描后数据传至Vitrea Workstaion工作站后处理图像,包括多平面重建(MPR)以及容积再现(VR)。扫描所得的图像全部纳入研究以保障图像的真实性,没有去除伴有伪影干扰的质量差的图像。观察病变部位(十二指肠、空肠近段、空肠远段、回肠近段、回肠远段)、病变大小、侵犯深度、黏膜与浆膜层情况、强化特征以及淋巴结情况等多模态CT、MRI影像学征象。对其进行记录,与手术病理或小肠镜病理检查结果进行比较。
4. 统计学分析
应用SPSS 18.0统计学软件行数据处理。计量资料呈正态分布,以x±s表示,采用两组独立样本t检验,P<0.05为差异有统计学意义。计数资料用率表示,采用χ2检验。根据敏感性=真阳性/(真阳性+假阴性)x100%。特异性=假阳性/(假阳性+真阴性)x100%。预测阳性值(PPV)=真阳性/(真阳性+假阳性)x100%。预测阴性值(NPV)=假阳性/(假阳性+真阴性)x100%。准确率=(真阳性+真阴性)/(真阳性+假阳性+真阴性+假阴性)x100%。对比分析多模态CT、MRI小肠造影诊断小肠病变的的敏感度、特异度、PPV、NPV和正确率。
三、结果
(一)病理诊断结果
本次研究中,小肠镜或者手术病理结果显示,60例小肠病变中:9例位于十二指肠,17例位于空肠近段,15例位于空肠远段,14例位于回肠近段以及5例位于回肠远段。60例患者均有小肠病变,其中22例小肠腺癌,19例间质瘤,7例淋巴瘤,9例小肠炎性病变以及3例脂肪瘤。见表2。
(二)多模态CT、MRI表现
小肠腺癌病变较为局限,密度/信号不均匀,增强扫描不均匀强化,腸壁不均匀增厚、僵硬,肠腔变窄,周围脂肪间隙不清、部分可见小淋巴结,部分患者近段小肠管腔扩张。小肠间质瘤病变局限,部分可有溃疡形成与肠腔相通,可位于小肠或小肠外,增强扫描延迟强化。淋巴瘤呈现没有坏死、钙化灶的均匀密度/信号,边界清楚,浸润型呈肠壁增厚,约1.0-3.2cm,没有结节形成,无胃肠黏膜破坏。溃疡型以及肿块型粘膜受到破坏。增强扫描中度均匀强化,黏膜明显强化,肠壁柔软呈同心圆征。炎性病变表现为肠壁局部增厚,周围多发渗出,肠管没有狭窄或扩张。脂肪瘤表现为肠壁局限性脂肪密度/信号,增强扫描没有强化。见图1、图2。
(三)多模态影像学CT、MRI小肠造影对于小肠病变的诊断效能
多模态影像学CT、MRI造影检查对于小肠病变的发现率分别为:95.0%(57/60)以及96.7%(58/60)。诊断小肠病变的准确率为93.3%与95.0%,敏感性为95.0%与96.7%,特异性为100.0%与100.0%,以上差异均无统计学意义,P > 0.05。见表3。
四、讨论
随着近几年来科学技术的不断发展,影像学检查更是如此,而小肠的影像学检查在近20年才逐渐发生了明显的变化,得到了广泛的应用,尤其是CT、MRI可以清楚地显示小肠肠壁、肠腔以及周围脂肪间隙的病变,也为小肠病变的诊断提供了新的方式[12],也逐渐代替了小肠钡餐造影。CT、MRI扫描时间短,64层以上CT扫描腹部+盆腔共需要12s,MRI需要20min,MRI扫描层厚若过薄,信噪比就过低,然而MRI软组织分辨率高,可以对小肠病变进行更好的定性。同时MRI没有电离辐射,更是适合各个群体反复检查[13-14]。
国外学者研究表明,CT图像部分间质瘤密度较低,增强扫描强化不明显,容易与肠腔内容物相混淆。而MRI则会清晰地显示[15]。多模态CT、PET-CT已经在小细胞肺癌(small cell lung cancer, SCLC)的诊断有了极大的进展。中央型SCLC肿块包绕支气管向支气管外生长[16]。PET-CT可以显示病变的代谢以及功能[17],还可以为病变定位,定性,而且可以检测疗效以及预后[18]。PET、PET-CT在颅内肿瘤、AD等病变的诊断方面有重要的作用[19-20]。以上所述,多模态CT、MRI已经得到了广泛的应用。
尽管本研究经过严格的实验设计,但是实验的样本量仍较少,尤其是小肠炎性病变患者。另外,针对各亚型小肠肿瘤的研究尚属探索阶段,有待于未来更大样本、更细致的进一步研究。综上所述,多模态影像学CT与MRI小肠造影创伤小,对小肠病变的诊断准确率高,具有很高的临床价值,是小肠病变的有效检查措施,其在临床诊断及疗效评价等方面均有很高的应用价值。
参考文献
[1] Urabe M, Yamaga Y, Aikou S, et al. Solitary fibrous of tumors of the greater omentum, mimicking gastrointestinal stromal tumor of the small intestine: a case report[J]. Int Surg, 2015,100(5):836-840.
[2] 符莉莉,李长清,周洁,等.多模态MR小肠口服造影法与CT小肠造影在小肠肿瘤性病变诊断中的对比[J].中国老年学杂志, 2016,36(11):2741-2743.
[3] 左影,王鹏,黄伟,等.克罗恩病CT与MR小肠成像诊断技术的比较[J].中国医学计算机成像杂志, 2016,22(4):321-326.
[4] 李坚,黄楠,肖泽彬,等.小肠淋巴瘤的CT和MRI表现[J].临床放射学杂志, 2015,34(11):1784-1789.
[5] 王守安,吴晶涛,陈文新,等.胃肠道恶性淋巴瘤的CT/MRI诊断[J].医学影像学杂志, 2012,22(7):1110-1112.
[6] Liu EH, Solorzano CC, Katznelson L, et al. Aace/Ace disease state clinical review: diagnosis and management of midgut carcinoids[J]. Endocr Pract, 2015,21(5):534-545.
[7] 严福华.小肠病变的影像学诊断[J].中华胃肠外科杂志, 2015,18(3):213-215.
[8] 杨永贵,刘娟,吴连伟,等.腹部磁共振规范化扫描方案的应用初探[J].医学影像学杂志, 2014,10:1790-1794.
[9] 吴光耀,林琳,伍建林.2型糖尿病患者静息态功能磁共振自发性脑活动改变的Meta分析[J].中国医学影像技术, 2016,32(12):1852-1856.
[10] Teghipco A, Hussain A, Tivarus ME, et al. Disrupted functional connectivity affects resting state based language lateralization[J]. Neuroimage Clin. 2016,24(12):910-927.
[11] 程巍,兰斌,张静,等.双源CT大螺距扫描技术在小儿先天性心脏病诊断的临床应用[J].四川大学学报(医学版), 2015,46(2):307-310.
[12] Kinner S, Hahnemann ML, Forsting M, et al. Magnetic resonance imaging of the bowel: today and tomorrow[J]. Rofo, 2015,187(3):160-167.
[13] 馬邦程,陈旺强.多模态MR小肠口服造影法对小肠肿瘤疾病的诊断价值分析[J].医学影像学杂志, 2016,26(9):1738-1741.
[14] 柳治,陈伟彬,杨冬生,等.256层螺旋CT仿真内镜及气钡双重对比造影检查诊断小肠肿瘤隆起性病变的实验研究[J].医学美学美容(中旬刊), 2015,24(6):12-15.
[15] Kang TW, Kim SH, Jiang KM, et al.Gastrointestinal stromal tumors: correlation of modified NIH risk stratification with diffusion-weighted MR imaging as an imaging biomarker[J]. Eur J Radiol, 2015,84(1):33-40.
[16] Zer A, Domachevsk L, Rapson Y, et al. The role of 18F-FDG PET/CT on staging and prognosis in patients with small cell lung cancer[J]. Eur Radiol, 2016,26:659-662.
[17] Soyeon Park, Eunsub Lee, Seunghong Rhee, et al. Correlation between semi-quantitative 18F-FDG PET/CT parameter and Ki-67 expression in small cell lung cancer[J]. Nucl Med Mol Imaging, 2016,50:24-30.
[18] Leonard T, Ong Mark Dunphy, Amanda Foster, et al. Prognostic value of preradiotherapy 18F-FDG PET/CT volumetrics in limited-stage small-cell lung cancer[J]. Clinical Lung Cancer, 2015,17(3):184-188.
[19] Meles SK, Teune L, De Jong BM, et al. Metabolic imaging in Parkinson disease[J]. J Nucl Med, 2017,58(1):23-28.
[20] Herholz K. Brain tumors: an update on clinical PET research in gliomas[J]. Semin Nucl Med, 2017,47(1):5-17.
