三江并流区金沙江流域云南核桃种质资源遗传多样性及分布特征
2019-09-10陈少瑜吴涛肖良俊
陈少瑜 吴涛 肖良俊
摘要:【目的】揭示三江并流區金沙江流域云南核桃种质资源的遗传多样性及分布特征,为该区域核桃资源的合理开发利用及科学保护提供参考依据。【方法】沿金沙江流域采集153份云南核桃资源,根据乡(镇)行政区划及资源分布情况将其划分成5个群体(YL、DQ、QZ、PTG和YC),采用微卫星(SSR)分子标记进行等位片段检测;运用GenAIEx 6.5计算等位片段数,并以POPGENE version 1.32分析群体的遗传多样性。【结果】19对SSR引物共检测到130个等位片段,各片段在153份样本中的出现频率各不相同,其中片段A122出现的频率最高,达0.8301;有14个片段频率最低(稀有等位片段),仅0.0033。5个群体等位片段数量占总数的比例在70.70%~85.38%,Nei’基因多样性指数(H)平均为0.6046,Shannon’s信息指数(I)平均为1.1709,期望杂合度(He)平均为0.6165。5个群体遗传多样性的分布排序依次为QZ>YL>PTG>YC>TD。其中,TD群体高频率等位片段频率达0.9062,稀有等位片段占总稀有等位片段的比例为21.43%;PTG群体稀有等位片段占总稀有等位片段的比例达42.86%。【结论】三江并流区金沙江流域云南核桃种质资源的遗传多样性属于中等水平,应采取积极措施进行保护和利用,尤其应加强对野生核桃资源的保护和利用。开展品种选育及种质资源保护工作时,在选择遗传多样性高的群体基础上,应结合表型性状及稀有等位片段频率的分布特征,侧重于群体内单株的选择。
关键词: 云南核桃;种质资源;SSR标记;遗传多样性;分布特征;三江并流区金沙江流域
中图分类号: S664.1 文献标志码: A 文章编号:2095-1191(2019)12-2656-09
Genetic diversity and distribution characteristic of Juglans sigillata resources along Jinsha River in Three Parallel
Rivers Belt of Yunnan
CHEN Shao-yu1,2, WU Tao1,2, XIAO Liang-jun3
(1Yunnan Academy of Forestry and Grassland,Kunming 650201, China; 2Laboratory for Conservation and Breeding for Rare, Endangered and Endemic Forest Plants of State Forestry Administration/Yunnan Provincial Key Laboratory for Cultivation and Utilization of Forest Plants,Kunming 650201, China; 3Institute of Economic Forest Trees, Yunnan Academy of Forestry and Grassland, Kunming 650201, China)
Abstract:【Objective】In order to provide scientific information for utilization and protection of walnut resource in the area,genetic diversity and distribution characteristic of Juglans sigillata populations along Jinsha River in Three Parallel Rivers Belt of Yunnan was revealed. 【Method】A total of 153 walnut individuals were sampled along Jinsha River. Based on administrative division and distribution characteristic of resources, they were divided into five populations (YL, DQ, QZ, PTG and YC). Simple sequence repeat(SSR) molecular technique was used to detect allelic fragments. GenAIEx 6.5 was used to calculate number of allelic fragments and POPGENE version 1.32 was used to analyze diversity of populations. 【Result】130 allelic fragments were detected by 19 pairs of primers. The frequency of each allele in 153 samples was different,among which allelic fragment A122 showed the highest frequency with 0.8301,while there were 14 allelic fragments(rare allelic fragments) showed the lowest frequency with only 0.0033. The allele percentage in total of five populations was from 70.70% to 85.38%. The average Nei’s gene diversity was 0.6046 and average Shannon’s information index was 1.1709. The average expected heterozygosity(He) was 0.6165. The order of genetic diversity from high to low of the five populations was QZ,YL,PTG,YC and TD. It was worth noticing that TD population,of which high frequency allelic fragments reached 0.9062,and the proportion of rare allelic fragments was 21.43%. Another population,PTG population,showed the highest rare allelic fragments proportion of 42.86%. 【Conclusion】The J. sigillata genetic diversity in the area is of medium level,which should be protected and utilized reasonably. During the work of breeding and conservation,based on selecting population with high genetic diversity,individuals within populations should be put particular emphasis on while combining phenotypic characters and distribution characteristic of rare allelic fragments.
Key words: Juglans sigillata; germplasm; SSR markers; genetic diversity; distribution characteristic; Jinsha River in Three Parallel Rivers Belt
0 引言
【研究意义】核桃(Juglans spp.)是世界著名的四大坚果之一,具有重要的经济价值及生态意义。全世界核桃共有23个种,我国有8个种,目前广泛栽培的是核桃(J. regia)和云南核桃(深纹核桃、铁核桃和泡核桃)(J. sigillata)2个种。其中,核桃适应性强,广泛分布于我国北方地区,云南核桃则是我国的特有种,云南的主要栽培种,主要分布于我国西南地区(王滑等,2009)。三江并流区是由高黎贡山、怒山、云岭及怒江、澜沧江、金沙江等构成的位于滇西北横断山区的一纵谷地,是世界上生物多样性最丰富的地区之一(欧光龙等,2013)。该区域核桃资源非常丰富,亦是云南核桃的自然分布区,但目前对这些资源尚缺乏系统了解,尤其缺乏对其遗传背景的系统研究。遗传多样性决定了植物种质对环境的适应能力和利用潜力,因此遗传多样性研究不仅关系到种质资源的有效收集、保护和利用,还对植物新品种选育具有重要的指导意义。【前人研究进展】DNA分子标记技术已成为当前遗传多样性评价的一项有力工具,广泛应用于各种植物的多样性研究中(Agarwal et al.,2008)。其中,简单重复序列(Simple sequence repeat,SSR)分子标记是基于PCR的核酸多态检测技术,因具有高灵敏性、高通用性、共显性及高重复性等优点(Kelkar et al.,2010;Guichoux et al.,2011),在植物的指纹分析、亲子鉴定、基因作图和遗传结构分析中得到广泛应用(Jones et al.,2010),在核桃种质资源遗传多样性的研究中也有应用(Chen et al.,2014)。Dangel等(2005)分析了欧美48份核桃种质资源的遗传多样性,同时采用SSR分子标记鉴定不同的核桃品种,结果显示这些种质资源具有较丰富的遗传多样性,筛选出的14个微卫星分子标记可有效用于核桃品种鉴定。Victory等(2006)对美国阔叶树分布中心区域43个黑核桃(J. nigra)群体的遗传多样性进行研究,结果显示研究群体具有较丰富的遗传多样性,仅轻度偏离哈迪温伯格比例,认为在分析的样品范围内,黑核桃具有显著的遗传同质性。郝艳宾等(2007)对核桃组(Sect. Juglans)种质资源中的29份核桃(J. regia L.)样品、2份铁核桃(J. sigillata D.)样品、4份J. sigillata D.× J. regia L.样品进行SSR標记分析,结果表明核桃组内样品的杂合度较低,聚类分析结果显示秦巴山地核桃应分别属于华北和新疆2个地理生态型,且认为铁核桃和西藏核桃作为核桃种下的一个生态类型更合适。王滑等(2007)对中国核桃8个天然居群的遗传多样性进行分析,结果发现居群的遗传多样性及居群间的遗传分化皆处于较高水平,佐证了核桃和云南核桃为同一个种不同生态型的观点。刘晓丽等(2008)对新疆地区3个核桃群体进行SSR分子标记的遗传多样性分析,探讨伊犁野核桃、喀什实生核桃和栽培品种间的亲缘演化关系,结果表明,3个核桃群体均具有较高的遗传多样性水平,核桃群体间存在基因渗透和基因交流,进一步从分子层面证明了我国是世界栽培核桃的起源中心之一的论断。徐永杰等(2016)对大巴山区12个实生居群的386个实生单株的坚果表型和SSR分子标记的遗传多样性进行分析,发现该区域核桃坚果表型和遗传多样性均较丰富,大巴山区核桃在长期的实生繁殖和多样立地环境中形成了丰富的坚果表型和遗传变异,是我国重要的核桃资源多样性分布区。彭少兵等(2017)利用SSR分子标记对安康串状核桃及同属的其他核桃品种进行亲缘关系分析,结果显示串状核桃和西洛3号的亲缘关系最近。Wang等(2015b)对西藏86份核桃种质资源表型和SSR分子标记遗传多样性及遗传结构进行研究,结果表明86份资源具有中等水平的遗传多样性,表型聚类和遗传距离聚类结果显示86份资源未按地理起源聚类。【本研究切入点】三江并流区复杂的地形地貌和多样的气候蕴育了丰富的核桃种质资源,但这些资源尚未得到系统研究,更未得到充分的开发和利用,尤其是分布在偏僻山区、高山沟壑的野生资源,亟待进一步保护和开发利用。【拟解决的关键问题】在云南省核桃种质资源调查及深纹核桃分子SSR标记开发的基础上,开展基于SSR分子标记的三江并流区金沙江流域核桃资源多样性研究,阐明其遗传多样性及分布特征,为该区域核桃种质资源的保护和利用提供科学依据。
1 材料与方法
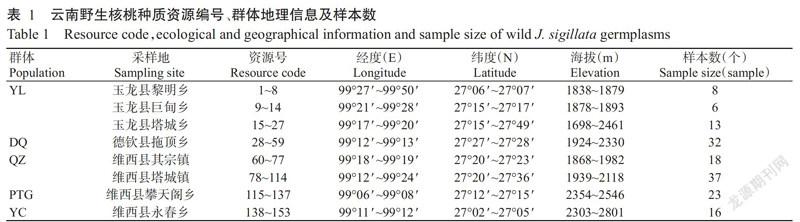
1. 1 试验材料
供试的153份样品均为当地天然生长的野生核桃资源,树龄大于50年,资源间隔100 m以上,记录资源的海拔、经纬度及生境状况,以采集的单株叶片为1个样本,置于自封袋中,带回提取DNA。资源分别采自3个县8个乡(镇),玉龙县(黎明乡、巨甸乡和塔城乡)、德钦县(拖顶乡)和维西县(其宗镇、塔城镇、攀天阁乡和永春乡)。根据乡(镇)行政区划及资源的地理分布情况,将其划分成5个群体进行分析,其中玉龙县和德钦县各为1个群体(YL和DQ),维西县的4个乡(镇)主要按照地理距离和资源分布及数量情况划分成3个群体,其宗镇和塔城镇地理距离较小,划为1个群体(QZ),地理距离相对较大的攀天阁乡和永春乡分别各为1个群体(PTG和YC),资源和群体的相关信息列于表1。CTAB、TEMED、2×ES Taq Master Mix、DNA Marker、Loading Buffer、Taq Polymerase等DNA提取及PCR试剂购自北京康为世纪生物科技有限公司;引物委托昆明硕擎生物工程有限公司合成。主要仪器设备:Bio-Rad公司的PCR扩增仪和凝胶成像仪,Thermo NanoDrop 2000超微量分光光度计及低温高速离心机(Eppendorf A G)。
1. 2 试验方法
1. 2. 1 基因组DNA提取 采用杨恩等(2005)的方法提取核桃叶片DNA,分别以琼脂糖凝胶电泳和紫外分光光度计检测DNA样品的浓度和纯度,将符合纯度要求的样品稀释至20 ng/μL,-20 ℃保存备用。
1. 2. 2 PCR扩增及产物检测 SSR-PCR反应体系参照陈少瑜等(2017)的方法,用筛选出的19对SSR引物进行SSR扩增,引物信息参见肖良俊等(2018)。毛细管电泳参照Chen等(2014)的方法。
1. 3 统计分析
根据扩增片段大小将每对引物的电泳结果依次记为A1~Ai,Ai为第i个等位片段,用Excel 2007统计分析各引物扩增的等位片段种类和数量、Ai的百分率及Ai在各群体中的分布频率。
用GenAIEx 6.5计算等位基因数;用POPGENE version 1.32(Yeh et al.,1997)计算各群体多态位点百分率(PPB)、观察等位基因数(Na)、有效等位基因数(Ne)、观察杂合度(Ho)、期望杂合度(He)、Shannon’s信息指数(I)和Nei’s基因多样性指数(H)。
2 结果与分析
2. 1 SSR扩增产物的多态性
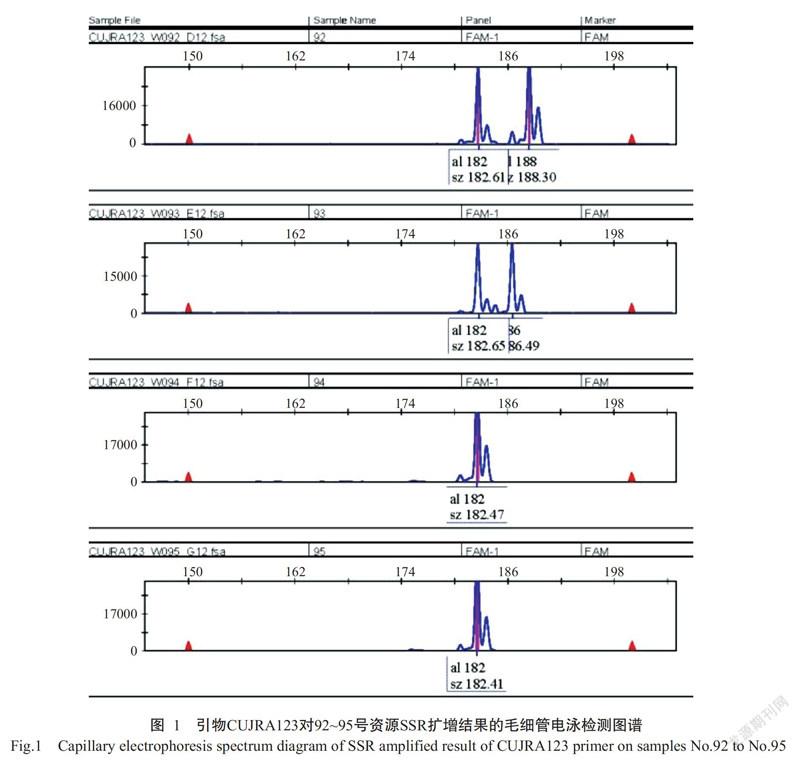
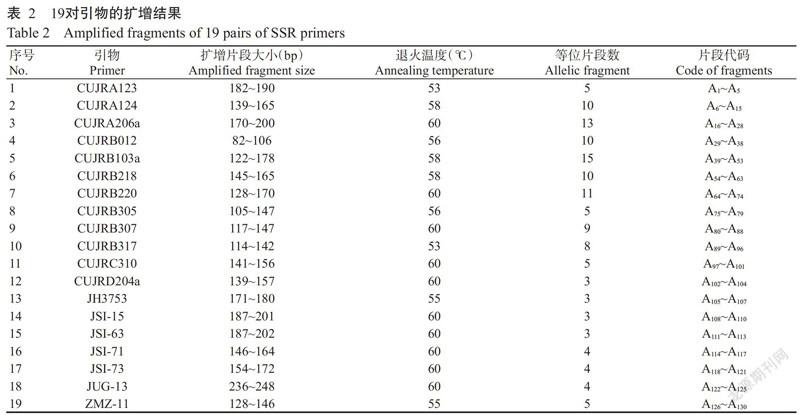
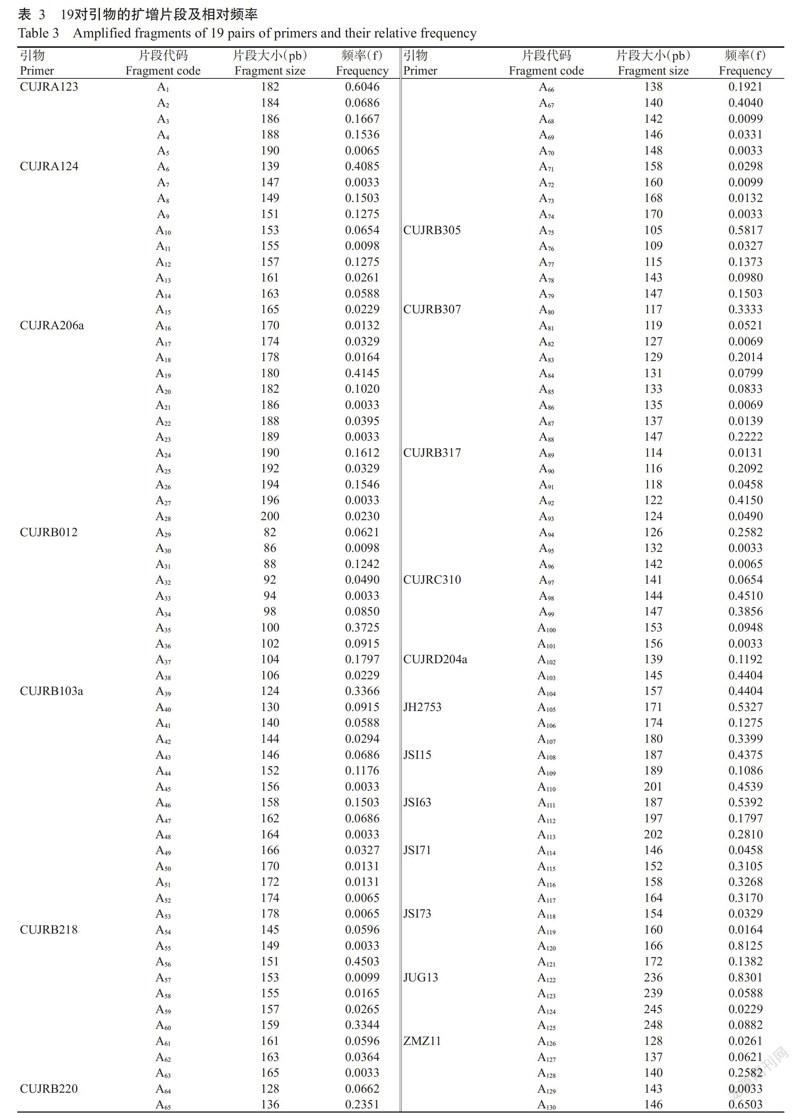
图1为引物CUJRA123对92~95号资源扩增产物的毛细管电泳图谱。由表2可知,19对引物共检测到130个等位片段,每对引物平均扩增6.84个,片段大小在82~248 bp。19对引物扩增的等位片段数存在差异,其中扩增出的等位片段数最多(15个)的引物为CUJRB103a,其次是引物CUJRA206a(13个),CUJRD204a、JH3753、JSI-15和JSI-63等4对引物扩增的等位片段数最少(各3个)。由表3还可看出,130个等位片段在153份样本中出现的频率各不相同,其中片段A122出现的频率最高,达0.8301,其次是A120,为0.8125;频率最低的仅为0.0033,共有14个,占总数的10.77%。
2. 2 等位片段的分布特征
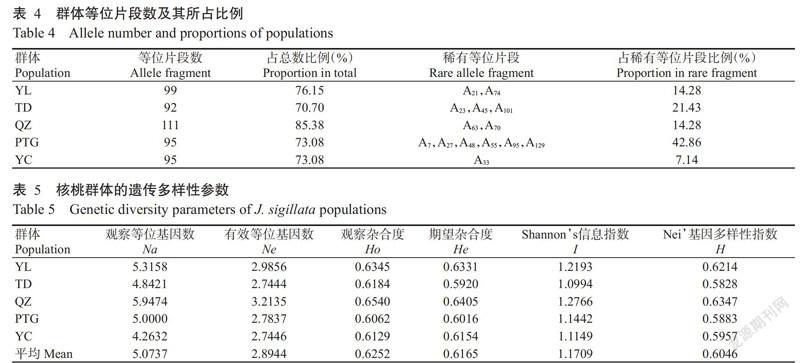
2. 2. 1 各群体等位片段的总体状况 由表4可见,QZ群体的等位片段数量最多(共111个),占总数的85.38%;其次是YL群体(99个),占总数的76.15%;TD群体的等位片段数量最少(92个),占总数的70.70%。14个稀有片段中有6个出现在PTG群体中,占稀有等位片段比例最高(42.86%),其次是TD群体中出现3个,占稀有等位片段比例为21.43%,YC群体出现1个,仅占7.14%。
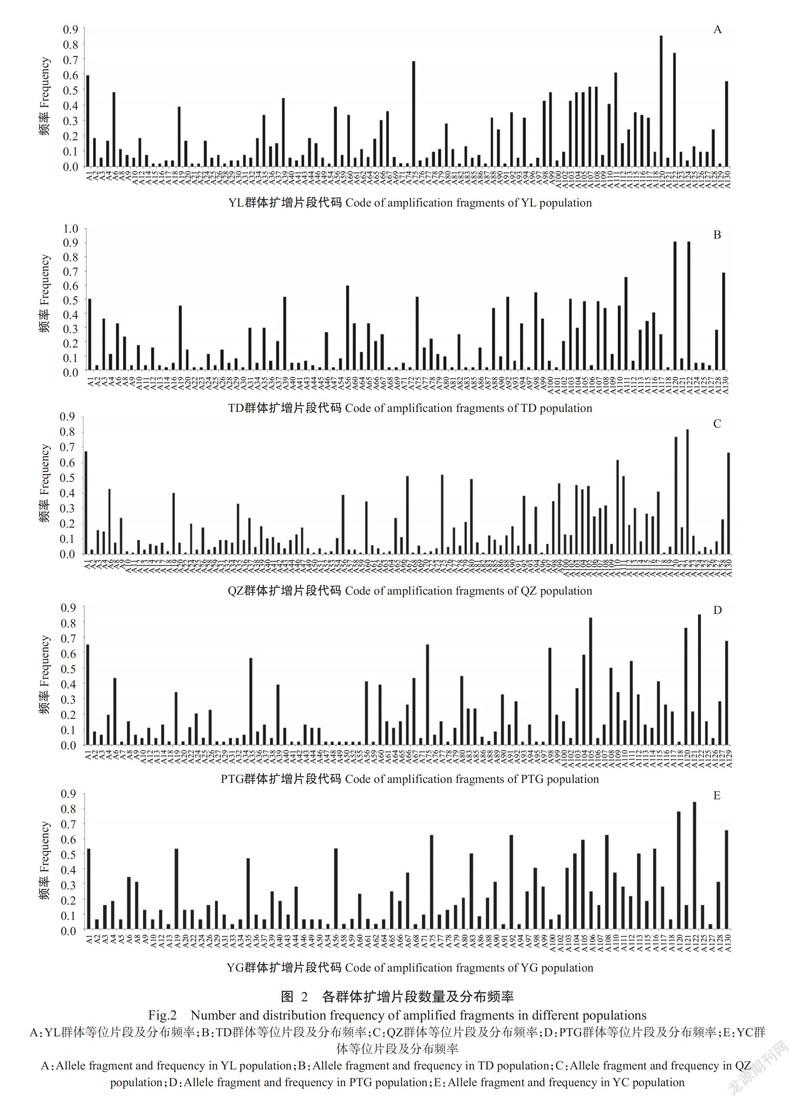
2. 2. 2 等位片段在5个群体中的分布及频率 130个等位片段在5个群体中的分布及频率各不相同(图2)。总体上,5个群体中高频率片段主要出现在A75~A130,其中5个群体出现频率皆大于0.5000的片段有4个(A1、A75、A120和A122)。值得关注的是A120和A122在5个群体中的分布频率分别高于0.7600和0.7400,两个等位片段在TD群体中高达0.9062。
2. 3 群体遗传多样性状况
表5为5个群体的遗传多样性参数及总体水平。由表5可看出,5个群体的Ne、He、I和H的平均值分别为2.8944、0.6165、1.1709和0.6046。5个群体的遗传多样性参数各不相同,其中QZ群体的Ne、He、I和H在5个群体中最高(分别为3.2135、0.6405、1.2766和0.6347);TD群体的以上各参数最低(分别为2.7444、0.5920、1.0994和0.5828)。说明三江并流区金沙江流域5个核桃群体中QZ群体的遗传多样性相对较高,TD群体的遗传多样性相对较低。
3 讨论
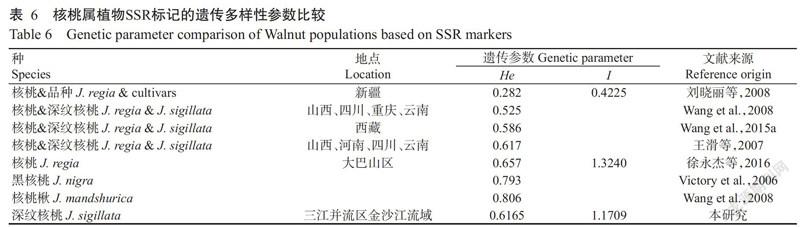
位点多态性能反映群体的遗传多样性或基因库的丰富程度。H、I和He是反映群体遗传多样性的重要指标,其中He不仅可衡量群体的遗传多样性状况,还能反映群体中等位基因的丰富度和均匀度(王滑等,2007;黄勇,2013)。本研究中,153份资源扩增出的等位片段总数为130个,5个群体扩增片段的数量占扩增片段总数的比例在70.70%~85.38%;H、I和He 3个遗传参数的平均值分别为0.6046、1.1709和0.6165,与采用SSR分子标记对核桃的相关研究(表6)进行比较,结果发现三江并流区金沙江流域核桃种质资源的遗传多样性属于中等水平。
对于某一树种的基因保存和优树选择来说,准确估算其在分布区的遗传多样性具有重要意义(廖柏勇等,2016),因此非常有必要掌握多样性在区域内的分布格局及分布特征。本研究中的5个核桃群体,其遗传多样性分布排序依次为QZ>YL>PTG>YC>TD,其中QZ群体的遗传多样性最高,可能与该群体的地理位置、样品数量、样品分布范围(涵盖其宗镇和塔城镇)、人为影响的程度相关,在遗传资源保存和选育时应给予注重。
遗传多样性水平及其分布格局受繁育系统、遗传漂变、基因突变、基因流等内因及环境变化和人为干扰造成的群体隔离、生境片段化等外因的影响(文亚峰等,2010)。研究区域复杂的地形地貌和多样气候环境是维持该区域核桃种质资源多样性的主要原因,而核桃特有的繁育系统(同株异花、雌雄异熟的风媒传粉)及长期的自然杂交导致核桃群体高度杂合是桃种质资源遗传多样性较丰富的另一个主要原因。然而,核桃的风媒传粉距离有限、野生资源砍伐及生境破坏形成的片段化导致其多样性降低。在资源调查中发现,许多核桃野生资源由于土地的开发被砍伐,其生境因人为活动被破坏。综合因素的作用导致研究区域核桃种质资源遗传多样性仅处于中等水平。
对等位片段及频率分布特征的分析结果显示,130个等位片段中A120和A122出现的頻率较高(大于0.7000)、频率很低的稀有片段(仅0.0033)有14个,且每个稀有片段为各群体所特有。其中值得关注的是TD群体,尽管此群体的遗传多样性在5个群体中最低,但其A120和A122片段的频率高达0.9062,稀有片段占稀有片段总数的比例也达21.43%,其次是PTG群体,稀有片段占稀有片段总数的42.86%。等位片段的多态性及频率分布特征,不仅能反映群体的遗传多样性状况,还可为进一步探索片段差异与相应表型多态性的关系打下基础。因此,本研究获得的结果,尤其以上16个等位片段及分布特征将为进一步开展片段差异与表型多态性关系的研究及特异分子标记的开发、优异资源的挖掘和鉴定提供有益信息。
4 结论
本研究以19对SSR引物检测三江并流区金沙江流域5个群体共153份云南核桃种质资源的遗传多样性,结果表明种质资源的遗传多样性整体上处于中等水平,其中QZ群体的多样性最高,TD群体最低;在130个等位片段中有2个片段频率较高、14个片段的频率很低。应采取积极的措施加强对该区域核桃资源的保护和开发利用,尤其是对于野生资源的保护和利用。在优先保护现有群体的基础上,加强对遗传多样性高的群体(QZ群体)的保护和选择,尤其应结合表型性状及稀有片段频率的分布特征(TD和PTG群体),侧重于群体内单株的选择,以更有助于保存和利用该区域核桃种质资源的多样性和特异性。
参考文献:
陈少瑜,宁德鲁,吴涛,肖良俊,林红丁,朱云凤,贺娜,潘莉. 2017. 泡核桃SSR标记开发及在遗传多样性研究中的应用[J]. 西北林学院学报,32(3):91-96. [Chen S Y,Ning D L,Wu T,Xiao L J,Lin H D,Zhu Y F,He N,Pan L. 2017. Development of SSR markers in Juglans sigillata and its application in genetic analysis[J]. Journal of Northwest Forestry University,32(3):91-96.]
郝艳宾,黄武刚,王克建,齐建勋,续九如. 2007. 我国核桃组(Sect. Juglans)种质资源的SSR标记分析[J]. 果树学报,24(5):620-625. [Hao Y B,Huang W G,Wang K J,Qi J X,Xu J R. 2007. Analysis of Sect. Juglans germplasm in China by using SSR marker[J]. Journal of Fruit Science,24(5):620-625.]
黄勇. 2013. 基于SRAP分子标记的小果油茶遗传多样性分析[J]. 林业科学,49(3):43-50. [Huang Y. 2013. Analysis of Camellia meiocarpa genetic diversity based on SRAP markers[J]. Scientia Silvae Sinicae,49(3):43-50.]
廖柏勇,王芳,陳丽君,刘明骞,欧阳昆唏,阙青敏,惠文凯,李培,陈晓阳. 2016. 基于SRAP分子标记的苦楝种质资源遗传多样性分析[J]. 林业科学,52(4):48-58. [Liao B Y,Wang F,Chen L J,Liu M Q,Ouyang K X,Que Q M,Hui W K,Li P,Chen X Y. 2016. Genetic diversity of germplasm resources of Melia azedarach revealed by SRAP markers[J]. Scientia Silvae Sinicae,52(4):48-58.]
刘晓丽,陈学森,张美勇,陈晓流,何天明,张立杰,张春雨. 2008. 普通核桃(Juglans regia)3个群体遗传结构的SSR分析[J]. 果树学报,25(4):526-530. [Liu X L,Chen X S,Zhang M Y,Chen X L,He T M,Zhang L J,Zhang C Y. 2008. Population genetic structure analysis of Juglans regia using SSR markers[J]. Journal of Fruit Science,25(4):526-530.]
欧光龙,彭明春,王崇云,向伶. 2013. 三江并流区云南贡山片植被景观类型分布特征[J] . 山地学报,31((4):464-472. [Ou G L,Peng M C,Wang C Y,Xiang L. 2013. Distribution of vegetation landscape in Gongshan County of Yunnan Province,the core area of the Three Parallel rivers Belt[J]. Journal of Mountain Science,31(4):464-472.]
彭少兵,张贝贝,王娟,李生萍,强虹. 2017. 利用SSR技术对安康串状核桃亲缘关系分析研究[J]. 西北林学院学报,32(1):126-130. [Peng S B,Zhang B B,Wang J,Li S P,Qiang H. 2017. Genetic relationship of a Juglans regia cultivar ‘Ankangchuan’ with SSR technique[J]. Journal of Northwest Forestry University,32(1):126-130.]
王滑,郝俊民,王宝庆,裴东. 2007. 中国核桃8个天然居群遗传多样性分析[J]. 林业科学,43(7):120-124. [Wang H,Hao J M,Wang B Q,Pei D. 2007. SSR analysis of genetic diversity of eight natural walnut populations in China[J]. Scientia Silvae Sinieae,43(7):120-124.]
王滑,阎亚波,张俊佩,裴东. 2009. 应用ITS序列及SSR标记分析核桃与铁核桃亲缘关系[J]. 南京林业大学学报(自然科学版),33(6):35-38. [Wang H,Yan Y B,Zhang J P,Pei D. 2009. Application of ITS sequence and SSR mar-kers to study the relationship between Juglans regia and Juglans sigillata[J]. Journal of Nanjing Forestry University(Natural Science Edition),33(6):35-38.]
文亚峰,韩文军,吴顺. 2010. 植物遗传多样性及其影响因素[J]. 中南林业科技大学学报,30(12):80-87. [Wen Y F,Han W J,Wu S. 2010. Plant genetic diversity and its influencing factors[J]. Journal of Central South University of Forestry & Technology,30 (12):80-87.]
肖良俊,陈少瑜,宁德鲁,吴涛,贺娜. 2018. 滇西北深纹核桃(Juglans sigillata)种质资源遗传多样性研究[J]. 云南农业大学学报(自然科学),33(4):597-604. [Xiao L J,Chen S Y,Ning D L,Wu T,He N. 2018. Study on the genetic diversity of germplasm resources of Juglans sigillata in Northwest Yunnan[J]. Journal of Yunnan Agricultural University (Natural Science),33(4):597-604.]
徐永杰,韩华柏,王滑,陈凌娜,马庆国,裴东. 2016. 大巴山区核桃实生居群的坚果表型和遗传多样性[J]. 林业科学,52(5):111-118. [Xu Y J,Han H B,Wang H,Chen L N,Ma Q G,Pei D. 2016. Phenotypic and genetic diversities of nuts of Walnut(Juglans regia)populations originated from seedlings in Daba Mountains[J]. Scientia Silvae Sinicae,52(5):111-118.]
杨恩,陈少瑜,张雨,范志远,习学良. 2005. 漾濞核桃叶片基因组DNA的两种提取方法效果比较[J]. 西部林业科学,34(4):72-75. [Yang E,Chen S Y,Zhang Y,Fan Z Y,Xi X L. 2005. Comparison on effect between two methods of DNA extraction from leaves of Juglans sigillata[J]. Journal of West China Forestry Science,34(4):72-75.]
Agarwal M,Shrivatava N,Padh H. 2008. Advances in mole-cular marker techniques and their applications in plant sciences[J]. Plant Cell Reports,27(4):617-631.
Chen L N,Ma Q G,Chen Y K,Wang B Q,Pei D. 2014. Identification of major walnut cultivars grown in China based on nut phenotypes and SSR markers[J]. Scientia Horticulturae,168:240-248.
Dangel G S,Woeste K,Aradhya M K,Koehmstedt A,Simon C,Potter D,Leslie C A,McGranahan G. 2005. Characte-rization of 14 microsatellite markers for genetic analysis and cultivar identification of walnut[J]. Journal of Ame-rican Society for Horticultural Science,130(3):348-354.
Guichoux E,Lagache L,Wagner S,Chaumeil P,Leger P,Lepais O,Lepoittevin C,Malausa T,Revardel E,Salin F,Petit R J. 2011. Current trends in microsatellite genotyping[J]. Molecular Ecology Resources,11(4):591-611.
Jones A G,Small C M,Paczolt K A ,Ratterman N L. 2010. A practical guide to methods of parentage analysis[J]. Molecular Ecology Resources,10(1):6-30.
Kelkar Y D,Strubczewski N,Hile S E,Chiaromonte F,Eckert K A,Makova K D. 2010. What is a microsatellite:A computational and experimental definition based upon repeat mutational behavior at A/T and GT/AC repeats[J]. Genome Biology and Evolution,2:620-635.
Victory E R,Glaubitz J C,Rhodes O E,Woeste K E. 2006. Genetic homogeneity in Juglans nigra(Juglandaceae)at nuclear microsatellites[J]. American Journal of Botany,93(1):118-126.
Wang H,Pan G,Ma Q G,Zhang J P,Pei D. 2015a. The genetic diversity and introgression of Juglans regia and Juglans sigillata in Tibet as revealed by SSR markers[J]. Tree Genetics & Genomes,11(1):1-11.
Wang H,Pei D,Gu R S,Wang B Q. 2008. Genetic diversity and structure of Walnut populations in central and southwestern China revealed by microsatellite markers[J]. Journal of the American Society for Horticultural Science,133(2):197-203.
Wang H,Wu W B,Pan G,Pei D. 2015b. Analysis of genetic diversity and relationships among 86 Persian walnut (Juglans regia L.)genotypes in Tibet using morphological traits and SSR markers[J]. The Journal of Horticultural Science and Biotechnology,90 (5):563-570.
Yeh F C,Yang R C,Boyle T,Ye Z H,Mao J X. 1997. POPGENE,the user-friendly shareware for population genetic analysis[M]. Molecular Biology and Biotechnology Center,Canada:University of Alberta.
(責任编辑 王 晖)
