双单杂交技术选育长根菇高品质抗病新菌株
2019-09-10于浩葛志豪徐丽丽郭立忠
于浩 葛志豪 徐丽丽 郭立忠
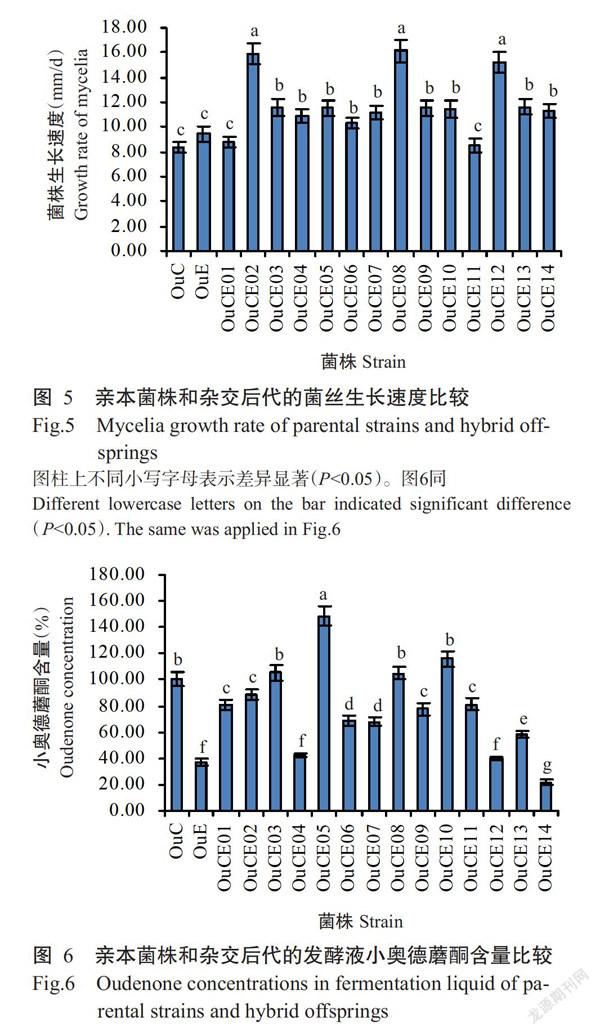
摘要:【目的】利用雙单杂交育种技术选育长根菇新菌株,并建立双单杂交后代的快速准确鉴定方法,以获得活性成分含量高、抗病性强的长根菇优质菌株。【方法】利用双单杂交技术进行长根菇杂交育种,通过拮抗试验、细胞核染色观察和SNP位点分析对双单杂交后代进行鉴别,以液体深层发酵和比色法测定杂合菌株的小奥德蘑酮产量,并通过对峙培养鉴定杂合菌株的木霉抗性。【结果】通过对长根菇亲本菌株OuE进行单孢分离,获得14株单核菌丝后代,编号依次为OuE01~OuE14。将获得的单核菌丝后代与亲本双核体菌株OuC进行双单杂交,经拮抗试验和SNP位点分析共筛选获得14株双单杂交后代。经过与两个亲本菌株(OuC和OuE)比较发现,杂交后代OuCE02、OuCE08和OuCE12的菌丝平均生长速度分别为16.00、16.10和15.30 mm/d,均显著高于两个亲本菌株(P<0.05);杂交后代OuCE03、OuCE05、OuCE08和OuCE10的菌丝发酵液小奥德蘑酮含量较亲本菌株OuC分别提高6.07%、47.66%、4.67%和15.42%;杂交后代OuCE01和OuCE08显示出较亲本菌株更强的木霉抗性。其中,杂交后代OuCE08在菌丝生长速度、小奥德蘑酮产量和木霉抗性方面均优于两个亲本菌株。【结论】双单杂交是一种快速有效获得食用菌新菌株的遗传育种方法,通过该方法筛选出一株高产小奥德蘑酮、高抗木霉的长根菇新菌株OuCE08。长根菇双单杂交后代快速、准确的检测鉴定可先采用拮抗试验作为初筛手段,再利用SNP位点分析进行复筛。
关键词: 长根菇;双单杂交;小奥德蘑酮;木霉抗病性;SNP位点分析
中图分类号: S646.19 文献标志码: A 文章编号:2095-1191(2019)12-2621-08
Breeding of high oudenone production and Trichoderma resistant Oudemansiella raphanipes strain by dikaryon-monokaryon mating
YU Hao, GE Zhi-hao, XU Li-li, GUO Li-zhong*
(Shandong Province Key Laboratory of Applied Mycology/College of Life Science, Qingdao Agriculture University, Qingdao, Shandong 266109, China)
Abstract:【Objective】To breed new Oudemansiella raphanipes(also known as Hymenopellis raphanipes or O. radicata) strain by dikaryon-monokaryon mating, construct fast and accurate hybrid offspring identification methods, and produce high oudenone yield and high Trichoderma resistant cultivar. 【Method】Dikaryon-monokaryon mating was used to perform genetic breeding of O. raphanipes. Hybrid offsprings were identified by antagonism test, nucleus fluorescence microscope observation and single nucleotide polymorphism(SNP) analysis. Oudenone yield of heterozygous strains were detected by submerged fermentation and colorimetry, the resistance to Trichoderma was determined using plate confrontation test. 【Result】In this study, 14 monokaryotic strains were isolated from the basidiospores of dikaryotic strain OuE,and their numbers were OuE01-OuE14. Dikaryon-monokaryon matings were performed between monokaryotic strains and dikaryotic strain OuC. Fourteen hybrid dikaryon offsprings were identified by plate antagonism test and single nucleotide polymorphisms analysis. Among them, the average growth rates of hypha of OuCE02, OuCE08 and OuCE12 were 16.00, 16.10 and 15.30 mm/d, respectively, which were significantly higher than those of the parental strains(P<0.05). The oudenone yield of hybrid offsprings OuCE03, OuCE05, OuCE08 and OuCE10 increased 6.07%, 47.66%, 4.67% and 15.42%, respectively, compared with parental strain OuC. OuCE01 and OuCE08 showed higher Trichoderma resistance than both parental strains. The growth rate, oudenone yield and Trichoderma resistance of OuCE08 were all better than the two parental strains. 【Conclusion】The rapid and accurate methods to identify dikaryon-monokaryon mating offsprings are constructed. A new O. raphanipes strain, OuCE08, is obtained, which grows fast, produces high yield of oudenone and has high Trichoderma resistance. This study proves that dikaryon-monokaryon mating offsprings can be firstly selec-ted by antagonism test and then verified by SNP analysis. This study provides a high quality cultivar for O. raphanipes production.
Key words: Oudemansiella raphanipes; dikaryon-monokaryon mating; oudenone; Trichoderma resistance; SNP loci analysis
0 引言
【研究意义】长根菇(Oudemansiella raphanipes)属于白蘑科(Tricholomataceae)小奥德蘑属(Oudemansiella)食用真菌,其肉质细嫩、柄脆可口、营养丰富,是一种可人工栽培的中高温出菇型食用菌(杨祝良和臧穆,1993)。长根菇在夏季出菇,耐保存,可弥补夏季食用菌供应短缺,因此已成为当前食用菌市场最受青睐的品种(戴玉成等,2010;Hao et al.,2016;Wang et al.,2018)。长根菇含有多种生物活性物质,其中小奥德蘑酮(Oudenone)为小奥德蘑属真菌所特有,具有显著的降血压功效(Koizumi et al.,1982;Acharya et al.,2019;Gao et al.,2019)。长根菇菌丝生长速度较慢、栽培周期较长,且生长过程易受杂菌污染。木霉是长根菇栽培过程中的主要竞争性病原微生物,因其生长迅速(朱兆香和庄文颖,2014),一旦污染即造成长根菇产量严重下降。因此,培育生长迅速、高产小奥德蘑酮、抗木霉能力强的长根菇优质新品种对促进其产业持续健康发展具有重要意义。【前人研究进展】与其他大宗食用菌相比,针对长根菇的研究报道相对较少,且主要集中在培养基优化和高产栽培技术等方面。唐利华等(2010)、陈林香(2018)对长根菇覆土栽培的技术要点进行探究;方少钦等(2015)研究表明,在我国蚕区利用桑枝资源栽培食用菌,特别是夏季栽培长根菇具有良好的应用前景;钟祝烂和益志能(2017)对长根菇的工厂化栽培技术进行研究;张磊等(2018)对长根菇的菌种进行鉴定,并优化其培养基;万鲁长等(2019)总结出北方地区长根菇大棚地栽周年生产标准化技术。目前,有关长根菇的育种研究在国内外鲜见报道。杂交育种是食用菌育种的重要手段之一,分为单单杂交和双单杂交。其中,双单杂交技术因可迅速产生遗传多样性丰富的杂交后代而受到广泛关注(Pilotti et al.,2002)。自1999年以来,我国开展了一系列食用菌双单杂交育种工作,阐明了双单杂交的基本遗传学现象(叶明等,2007),并获得一系列食用菌新菌株(谭琦等,2000;王波等,2012;孙艳颖,2013)。杂交后代鉴定是双单杂交技术的关键步骤,常用的鉴定方法有酯酶同工酶技术(Eiji et al.,1994)、限制性内切酶片段长度多态性(Restriction fragment length polymorphism,RFLP)分析(Carvalho et al.,1995)、單核苷酸多态性(Single nucleotide polymorphisms,SNP)分析(Mah et al.,2011)、随机扩增多态性DNA标记(Random amplified polymorphic DNA,RAPD)分析(王春晖等,2013)及拮抗试验分析等。虽然双单杂交后代鉴定方法有很多,但不同方法间的优劣性尚缺乏系统研究,进而影响双单杂交工作的有效开展。【本研究切入点】长根菇是一种重要的中高温食用菌品种,其栽培规模持续扩大,育种研究尚存在很大空白。双单杂交是有效的食用菌遗传育种手段,但至今国内外尚无利用双单杂交技术进行长根菇遗传育种的研究报道。【拟解决的关键问题】利用双单杂交育种技术选育长根菇新菌株,并建立双单杂交后代的快速准确鉴定方法,旨在获得活性成分含量高、抗病性强的长根菇优质新菌株。
1 材料与方法
1. 1 试验材料
供试长根菇亲本菌株OuC来源于广东市售长根菇,菌株OuE来源于北京市售长根菇。经检测,菌株OuE菌丝体在培养基上生长速度较快,而菌株OuC菌丝体发酵液中小奥德蘑酮含量较高,且其木霉抗性强于菌株OuE。木霉分离自污染的长根菇栽培菌包,分离后通过形态观察和ITS分析(田慧敏等,2014)确定为木霉。葡萄糖、磷酸二氢钾(K2HPO4)和硫酸镁(MgSO4)购自莱阳市康德化工有限公司,琼脂粉、PCR试剂、异丙醇和无水乙醇购自生工生物工程(上海)股份有限公司,E.Z.N.A.TM Fungal DNA Mini Kit柱式试剂盒购自OMEGA公司,马铃薯购自当地农贸市场。主要仪器设备:电热恒温培养箱DRD-9082(上海森信实验仪器有限公司),荧光显微镜XSP-BM21AY(上海光学仪器厂),高速冷冻离心机GTR22-1(北京时代北利离心机有限公司)。
PDA液体培养基(1 L):马铃薯200.0 g,葡萄糖20.0 g,pH自然。PDA固体培养基(1 L):在PDA液体培养基中加入20.0 g琼脂粉。PDF固体培养基(1 L):黄豆12.5 g,葡萄糖20.0 g,酵母浸膏3.0 g,琼脂粉20.0 g,pH自然。CM固体培养基(1 L):葡萄糖20.0 g,蛋白胨5.0 g,MgSO4 0.5 g,K2HPO4 1.0 g,KH2PO4 0.46 g,琼脂粉20.0 g,pH自然。WA固体培养基(1 L):琼脂粉20.0 g,pH自然。YEA固体培养基(1 L):葡萄糖20.0 g,酵母浸膏20.0 g,蛋白胨1.0 g,琼脂粉20.0 g,pH自然。PBS缓冲液(1 L):NaCl 8.0 g,KCl 0.2 g,Na2HPO4 1.42 g,KH2PO4 0.27 g,pH 7.4。
1. 2 试验方法
1. 2. 1 菌丝生长测定 采用打孔法取直径0.8 cm的菌种块接种至新的PDA固体培养基上,置于25 ℃恒温培养箱避光静置培养5 d。测定菌落直径,计算菌丝生长速度,每组设3个平行。
1. 2. 2 菌株小奥德蘑酮含量测定 将供试菌株分别接种于250 mL三角瓶中进行液体发酵培养(PDA液体培养基),装瓶量100 mL,每瓶接种10块直径为0.8 cm的圆柱形菌种块,于25 ℃下160 r/min摇床恒温振荡培养25 d。发酵液经80目筛过滤后,4 ℃下8000 r/min离心2 min,收集上清液即为待测液。采用紫外分光光度计法测定待测液的小奥德蘑酮含量(李浩,2012)。
1. 2. 3 担孢子收集与单孢分离 选用菌株OuE进行担孢子收集和单孢分离。取长至八分熟的子实体,用75%酒精擦拭子实体表面,以无菌水冲洗3~4次。无菌条件下剪掉菌柄,将剩余子实体的菌褶朝下置于已灭菌且铺有牛皮纸的培养皿上,并盖上已灭菌的烧杯,每个培养皿中放置7个子实体。将收集到的担孢子置于培养皿中,用已过滤灭菌的链霉素(80 μg/mL)稀释制备成孢子悬液。利用稀释涂布法对制备好的孢子悬液进行梯度稀释,制备成5个梯度的孢子悬浮液。每个梯度吸取200 μL,分别涂布于PDA、PDF、CM、WA和YEA等5种固体培养基上,每种培养基每个梯度设3个平行。将萌发、无污染的菌落转移至新鲜的PDA培养基中,进行下一步鉴定工作。
1. 2. 4 單核菌丝鉴定 观察索状联合:利用插片法将洁净灭菌的盖玻片以45°角插入待鉴定菌落边缘,待菌丝爬满插片后,取出进行镜检观察。存在索状联合的为双核菌丝,无锁状联合的则需进一步鉴定。细胞核荧光染色观察:在待观察的玻片上滴加几滴DAPI染液(1 μg/mL),染色20 min后用PBS缓冲液进行冲洗,用滤纸吸干水分,滴加荧光封片液(PBS缓冲液与甘油等体积混合),2 min后用荧光显微镜观察。SNP位点分析:利用E.Z.N.A.TM Fungal DNA Mini Kit柱式试剂盒提取菌丝样品的基因组DNA。参照李浩(2012)的方法设计引物(JE54-F:5'-TAGTTGCGTTGCTGTCCG-3';JE54-R:5'-ATCCG CCTTTGGTTGTTC-3'),以长根菇基因组DNA为模板,PCR扩增JE54基因片段并进行SNP位点分析,将获得的单一条带送至生工生物工程(上海)股份有限公司测序;然后利用BioEdit 7.2.1分析测序结果,以寻找SNP位点。
1. 2. 5 双单杂交 在培养基中间接种单核体菌株后置于25 ℃培养3~4 d。在距离单核菌丝2~3 cm处接种双核菌株OuC,然后置于25 ℃恒温培养箱中避光培养。菌丝接触后继续培养5 d,从交界处至单核菌丝体一侧的菌落边界处依次挑取5个菌块,转接到新鲜的PDA固体培养基上以获得待检测双单杂交后代。
1. 2. 6 杂合子菌株鉴定 初筛:对杂交后代进行菌丝形态观察并淘汰不具备锁状联合的后代。将具有锁状联合的后代与亲本菌株OuC在培养基上进行对峙培养,若后代与亲本间有明显的拮抗线说明是杂合子菌株,淘汰拮抗线不明显的杂交后代。复筛:将初筛获得的杂交后代进行SNP位点分析。
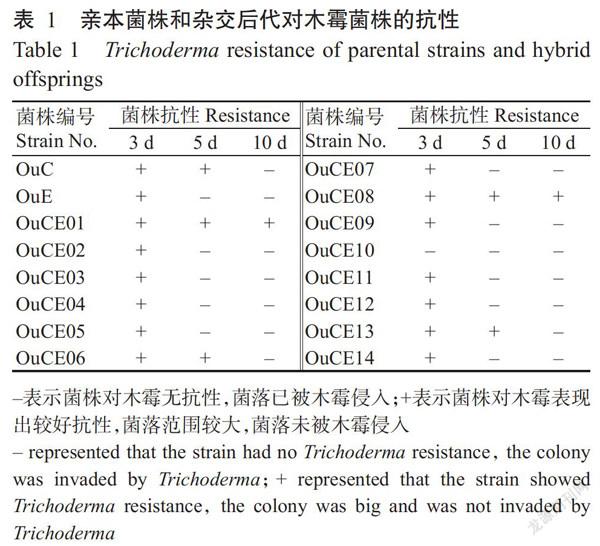
1. 2. 7 抗病突变株筛选 采用菌丝对峙培养法对双单杂交后代进行抗木霉菌株筛选(陈艳露等,2013):在培养基一侧接种双单杂交杂合子菌株,将培养基置于25 ℃培养3~4 d后,在距离单核菌丝4~5 cm处接种病原菌木霉菌株。将接种后的培养基置于25 ℃恒温培养箱中避光培养,分别在接种木霉后第3、5和10 d观察杂合子菌株生长情况,并测量菌落大小。每组设3个平行。
1. 3 统计分析
采用Origin 8.0进行试验数据统计整理,以SPSS 18.0中的Pearson双侧t检验进行相关性分析,并应用BioEdit进行测序结果及SNP位点分析。
2 结果与分析
2. 1 单孢分离结果
采用钟罩法收集菌株OuE的担孢子,然后稀释涂布于5种培养基上进行培养,结果显示,PDA培养基上长出14个单菌落,PDF培养基上长出12个单菌落,CM培养基上长出8个单菌落,WA培养基上长出29个单菌落,YEA培养基上长出11个单菌落。以WA培养基上的单菌落数量最多。
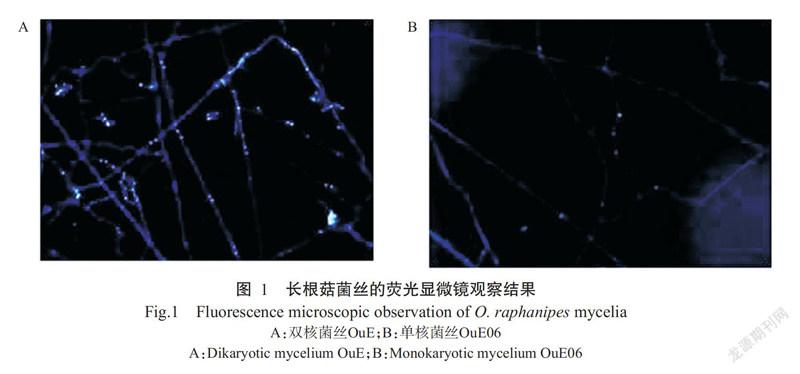
通过锁状联合观察淘汰31个单菌落,对剩余的43个单菌落和亲本菌株OuE进行SNP位点分析及细胞核染色观察。结果显示,菌株OuE的菌丝具备锁状联合,且细胞中两个细胞核通常相距较近(图1-A),可判断为双核菌丝;有20个单菌落菌丝中细胞核较分散(图1-B),初步判断这些菌落菌丝为单核菌丝。
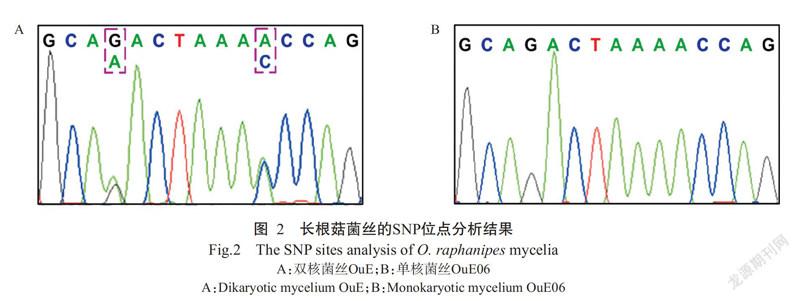
对亲本菌株OuE和剩余单菌落进行JE54基因片段上的SNP位点分析。据DNA测序图谱显示,亲本菌株OuE在第4个碱基(A/G)和第11个碱基(A/C)两处存在SNP位点(图2-A),而在单核菌丝OuE06中以上两处不存在SNP位点(图2-B)。通过SNP位点分析,结果发现有14株菌株能扩增出目的条带,且不具备SNP位点,因此确定这14株菌株的菌丝为单核菌丝,编号依次为OuE01~OuE14。
2. 2 双单杂交结果
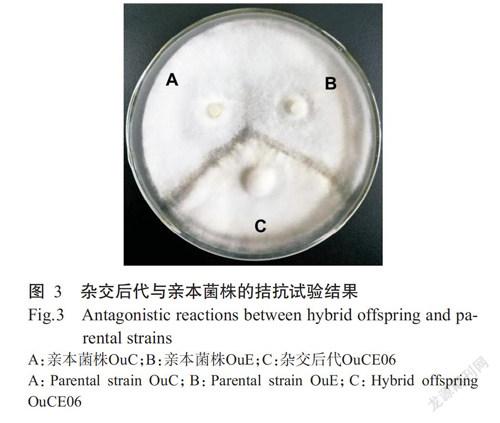
利用双单杂交共获得35株具备锁状联合的双核体菌株,将这35株菌株与两个亲本菌株(OuC和OuE)进行拮抗试验(图3),结果淘汰16株与亲本菌株拮抗反应不明显的菌株,而剩余19株菌株中有5株与其他菌株间的拮抗反应不明显,故将其去除,最终共获得14株双单杂交后代。
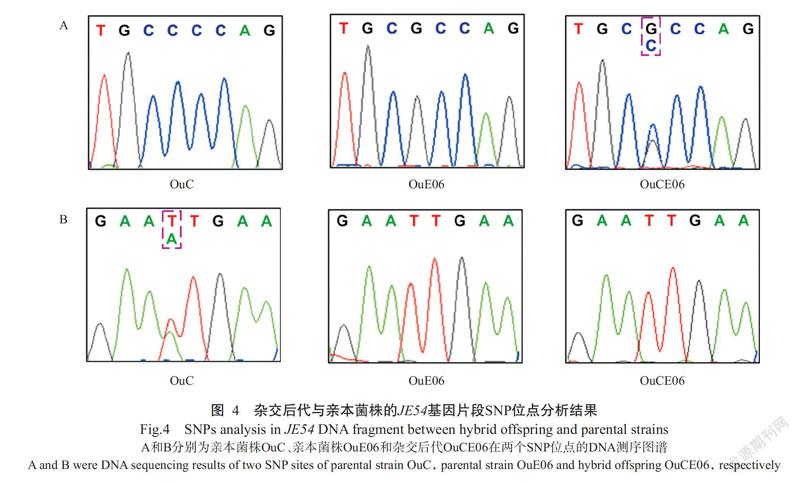
对双核亲本、单核亲本和双单杂交后代的JF54基因片段SNP位点进行分析,结果显示获得的14株双单杂交后代均存在SNP位点的改变,因此可确定为杂交后代。以亲本双核体菌株OuC与单核菌株OuE06的杂交后代OuCE06为例,在图4-A中第4个碱基两个亲本分别为纯合的C和G,而杂交后代为C/G的套峰;在图4-B中第4个碱基亲本双核体菌株OuC 为A/T杂合,单核菌株OuE06为T,杂交后代仍为纯合的T。说明杂交后代OuCE06的两个细胞核分别来自于OuC和OuE06两个亲本。
2. 3 杂交后代小奥德蘑酮含量测定结果
亲本菌株和杂交后代的菌丝生长速度如图5所示。亲本菌株OuC和OuE的菌丝平均生长速度分别为8.39和9.09 mm/d。大部分杂交后代的菌丝平均生长速度显著高于两个亲本菌株(P<0.05,下同),其中,杂交后代OuCE02、OuCE08和OuCE12的菌丝平均生长速度分别为16.00、16.10和15.30 mm/d,均显著高于两个亲本菌株。14株双单杂交后代菌株发酵液的小奥德蘑酮含量比较如图6所示。杂交后代OuCE03、OuCE05、OuCE08和OuCE10的菌丝发酵液小奥德蘑酮含量均高于两个亲本菌株,与亲本菌株OuC相比,其菌丝发酵液小奥德蘑酮含量分别提高6.07%、47.66%、4.67%和15.42%。综上所述,双单杂交产生的菌株后代遗传多样性丰富,其中杂合菌株OuCE08的菌丝生长最迅速,且可产生高浓度的小奥德蘑酮。
2. 4 抗病性菌株筛选结果
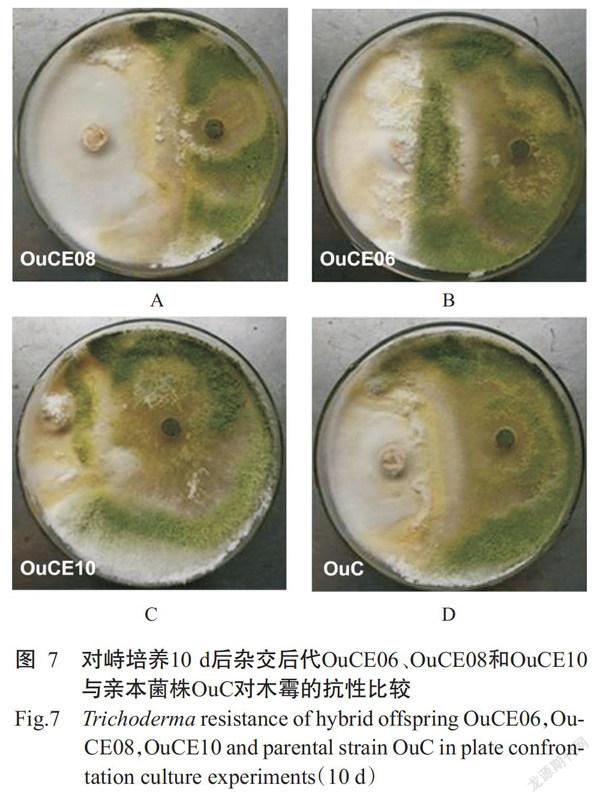
利用对峙培养法检测双单杂交后代对木霉的抗性,结果显示,对峙培养10 d后部分杂交后代如OuCE08(图7-A)与木霉的拮抗现象明显,长势与木霉均衡,表现出较好的木霉抗性;部分杂交后代如OuCE06(图7-B)与木霉存在一定拮抗现象,可阻止木霉的完全侵入,但长势弱于木霉;部分杂交后代如OuCE10(图7-C)对木霉的抵抗能力很差,菌丝生长区域完全被木霉菌丝侵入。
由表1可知,14株杂交后代中以OuCE01和OuCE08的抗木霉能力最强,且强于两个亲本菌株(OuC和OuE); OuCE06和OuCE13的抗木霉能力与具有较强木霉抗性的亲本菌株OuC相近;其余10株杂交后代的抗木霉能力与亲本菌株OuE相近。说明双单杂交能产生具有丰富遗传特性的后代,可作为有效的育种手段用于筛选抗病长根菇菌株。
3 讨论
杂交是食用菌育种最常用、最有效的方法之一,能迅速将亲本优势性状集中到子代,可用优秀性状的显性基因掩盖性状不佳的隐性基因(马三梅等,2004;桂明英等,2006;陈娟和苏开美,2008)。杂交育种包括单孢杂交、多孢杂交和双单杂交(陈世通等,2013;周莉,2014)。其中,双单杂交的目的性最强,仅需一个单倍体菌丝,能有效节省孢子分离的时间,具有简单、迅速、高效等优势(Pilotti et al.,2002)。高效筛选是食用菌雜交育种的关键步骤。SNP分子标记技术可对不同亲本菌株进行标记,并通过对杂交后代相同位点分析实现对杂交后代的鉴别和亲本追溯。Nieuwenhuis等(2013)通过对8个SNP位点的检测,成功对60株野生裂褶菌菌株的亲本进行追溯;Xiang等(2016)将SNP位点分析成功应用于茯苓杂交后代鉴定,并确立一套有效的杂交后代筛选方法。本研究利用SNP分子标记技术成功鉴定了长根菇的杂交后代,进一步证实该技术是鉴别食用真菌杂交后代的有效手段。
选择适宜的检测引物是开展SNP分析的关键步骤。李浩(2012)使用4对引物对不同来源的长根菇菌株进行SNP位点分析,根据SNP位点分布进行遗传多样性分析;并通过对双孢长根菇菌株和四孢长根菇菌株进行SNP位点分析,确定双孢长根菇为同核体,四孢长根菇为异核体。本研究对李浩(2012)筛选出的4条引物进行比对分析,发现JE54基因片段扩增条带单一,测序结果表明有多个SNP位点适合进行杂交后代检测。SNP位点分析虽然准确性高,但存在操作步骤繁琐、成本高、周期长等缺点(Kwan et al.,2019)。本研究先通过拮抗试验筛选出与两个亲本菌株均具有明显拮抗现象的菌株,再利用SNP位点分析对筛选出的菌株作进一步鉴定,结果显示筛选出的14株菌株均为真正的杂交后代。可见,长根菇双单杂交后代快速、准确检测的方法可先采用拮抗试验作为初筛手段,再利用SNP位点分析进行复筛。
本研究利用长根菇菌株OuE杂交产生的14种担孢子萌发单核菌丝与亲本双核体菌株OuC进行双单杂交,结果表明,杂交后代OuCE02、OuCE08和OuCE12的菌丝生长速度显著高于两个亲本菌株,杂交后代OuCE03、OuCE05、OuCE08和OuCE10的菌丝体发酵液小奥德蘑酮含量高于两个亲本菌株,杂交后代OuCE01和OuCE08的抗木霉能力强于两个亲本菌株。其中,杂交后代OuCE08在菌丝生长速度、小奥德蘑酮含量和木霉抗性方面均优于两个亲本菌株,表明双单杂交后代存在丰富的遗传多样性,有利于筛选出优良性状的新菌株,但双单杂交的遗传机理至今尚未清楚,有待于进一步研究。
4 结论
双单杂交是一种快速有效获得食用菌新菌株的遗传育种方法,通过该方法筛选出一株高产小奥德蘑酮、高抗木霉的长根菇新菌株OuCE08。长根菇双单杂交后代快速、准确的检测鉴定可先采用拮抗试验作为初筛手段,再利用SNP位点分析进行复筛。
参考文献:
陈娟,苏开美. 2008. 食用菌遗传育种及种质鉴定研究进展[J]. 中国食用菌,27(5):3-8. [Chen J,Su K M. 2008. Proceeding of heredity,breeding and idioplasm identification of edible fungi[J]. Edible Fungi of China,27(5):3-8.]
陈林香. 2018. 长根菇栽培技术[J]. 福建热作科技. 43(1):34-35. [Chen L X. 2018. Cultivation technology of Oudemansiella radicata[J]. Fujian Science & Technology of Tropical Crops,43(1):34-35.]
陈世通,白建波,李梦杰,李荣春. 2013. 香菇单孢杂交及杂合子鉴定的研究[J]. 中国食用菌,32(1):45-46. [Chen S T,Bai J B,Li M J,Li R C. 2013. Study on monospore cross and identification of heterozygotes of Shiitake[J]. Edible Fungi of China,32(1):45-46.]
陈艳露,周莉,黄麟淇,刘斌. 2013. 抗木霉平菇菌株的筛选及其生产性能评价[J]. 北方园艺,(17):145-148. [Chen Y L,Zhou L,Huang L Q,Liu B. 2013. Screening and evalua-tion of Oyster mushroom strains resistant to Trichoderma disease[J]. Northern Horticulture,(17):145-148.]
戴玉成,周丽伟,杨祝良,文华安,图力古尔,李泰辉. 2010. 中国食用菌名录[J]. 菌物学报,29(1):1-21. [Dai Y C,Zhou L W,Yang Z L,Wen H A,Bau Tolgor,Li T H. 2010. A revised checklist of edible fungi in China[J]. Mycosystema,29(1):1-21.]
方少钦,高云超,廖森泰,肖更生,邹宇晓,施英,刘凡,刘军,穆利霞,沈维治. 2015. 桑枝栽培长根菇的试验研究[J]. 农学学报,5(5):76-80. [Fang S Q,Gao Y C,Liao S T,Xiao G S,Zou Y X,Shi Y,Liu F,Liu J,Mu L X,Shen W Z. 2015. Cultivation experiments of the edible mushroom Oudemansiella radicata using sawdust based substrate made of mulberry branch powder[J]. Journal of Agriculture,5(5):76-80.]
桂明英,王刚,郭永红,刘蓓,马绍宾. 2006. 食用菌育种技术的研究进展[J]. 中国食用菌,25(5):3-5. [Gui M Y,Wang G,Guo Y H,Liu B,Ma S B. 2006. Research advancement of breeding technique about edible fungi[J]. Edible Fungi of China,25(5):3-5.]
李浩. 2012. 长根菇生活史研究[D]. 长沙:湖南师范大学. [Li H. 2012. Study the life cycle of Oudemansiella radicata[D]. Changsha:Hunan Normal University.]
马三梅,王永飞,亦如瀚. 2004. 食用菌育种的研究进展[J]. 西北农林科技大学学报(自然科学版),32(4):108-112. [Ma S M,Wang Y F,Yi R H. 2004. Review of edible fungi breeding[J]. Journal of Northwest Sci-Tech University of Agriculture and Forestry(Natural Science Edition),32(4):108-112.]
孙艳颖. 2013. 香菇、滑子菇新品種选育研究[D]. 石家庄:河北师范大学. [Sun Y Y. 2013. Studies on the breeding of new varieties of Lentinula edodes and Pholiota nameko[D]. Shijiazhuang:Hebei Normal University.]
谭琦,潘迎捷,陈明杰,贺冬梅,汪昭月,严培兰,冯志勇,郭倩,刘德云,陈有兴. 2000. 香菇申香10号菌种的选育与推广[J]. 食用菌学报,7(3):6-10. [Tan Q,Pan Y J,Chen M J,He D M,Wang Z Y,Yan P L,Feng Z Y,Guo Q,Liu D Y,Chen Y X. 2000. Strian selection and extention of Lentinula edodes shengxiang No.10[J]. Acta Edulis Fungi,7(3):6-10.]
唐利华,高君辉,郭倩. 2010. 长根菇林地覆土栽培技术[J]. 食用菌,(5):52-53. [Tang L H,Gao J H,Guo Q. 2010. Soil covering cultivation technique of Oudemansiella ra-dicata in forest[J]. Edible Fungi,(5):52-53.]
田慧敏,刘铁志,连静,李桂林,巴特尔. 2014. 基于形态特征及ITS序列对内蒙古红菇的分类鉴定[J]. 食用菌学报,21(4):15-19. [Tian H M,Liu T Z,Lian J,Li G L,Ba T E. 2014. Identification and classification of four Russula species from inner Mongolia based on morphology and ITS sequencing[J]. Acta Edulis Fungi,21(4):15-19.]
万鲁长,李晓博,赵敬聪,张甲生,李瑞琴,郭惠东,杨鹏,刘军,韩建东. 2019. 北方地区长根菇大棚地栽周年生产标准化技术[J]. 食药用菌,27(2):135-138. [Wan L Z, Li X B, Zhao J C, Zhang J S, Li R Q, Guo H D, Yang P, Liu J, Han J D. 2019. Annual production technique of Oudemansiella radicata in greenhouses in northern areas of China[J]. Edible and Medicinal Mushrooms, 27(2):135-138.]
王波,祁丽萍,鲜灵. 2012. 金针菇双单杂交的遗传分析[J]. 西南农业学报,25(5):1805-1810. [Wang B,Qi L P,Xian L. 2012. Di-monad breeding and genetic analysis of Flammulina velutipes[J]. Southwest China Journal of Agricultural Sciences,25(5):1805-1810.]
王春晖,尹永刚,胡汝晓,彭运祥. 2013. 基于ISSR和RAPD标记的八株灰树花栽培菌株遗传多样性分析[J]. 食用菌学报,20(4):1-5. [Wang C H,Yin Y G,Hu R X,Peng Y X. 2013. Genetic diversity of eight Grifola forndosa cultivars analyzed using ISSR and RAPD markers[J]. Acta Edulis Fungi,20(4):1-5.]
杨祝良,臧穆. 1993. 我国西南小奥德蘑属的分类[J]. 真菌学报,12(1):16-27. [Yang Z L,Zang M. 1993. Classification of the genus Oudemansiella Speg. in southwest China[J]. Acta Mycologica Sinica,12(1):16-27.]
叶明,叶崇军,陈辉,王文敏. 2007. 香菇双单杂交菌株富铁及其培养条件研究[J]. 食品科学,28(1):275-278. [Ye M,Ye C J,Chen H,Wang W M. 2007. Study on optimization of cultivation conditions in iron-enriched strains of di-mon mating in Lentinula edodes[J]. Food Science,28(12):275-278.]
張磊,徐丽丽,何翠萍,郭立忠. 2018. 长根菇菌种鉴定及生长条件优化[J]. 安徽农学通报,24(5):14-19. [Zhang L,Xu L L,He C P,Guo L Z. 2018. Identification of Oudemansiella radicata and its growth conditions optimization[J]. Anhui Agricultural Science Bulletin,24(5):14-19.]
钟祝烂,益志能. 2017. 长根菇工厂化栽培技术[J]. 食用菌,(2):51-53. [Zhong Z L,Yi Z N. 2017. Industrial cultivation of Oudemansiella radicata[J]. Edible Fungi,(2):51-53.]
周莉. 2014. 平菇单孢杂交及抗病新菌株选育[D]. 南宁:广西大学. [Zhou L. 2014. Monospore cross breeding and screening of new strains resisitant to disease of Oyster mushroom[D]. Nanning:Guangxi University.]
朱兆香,庄文颖. 2014. 木霉属研究概况[J]. 菌物学报,33(6):1136-1153. [Zhu Z X,Zhuang W Y. 2014. Current understanding of the genus Trichoderma(Hypocreales,Ascomycota)[J]. Mycosystema,33(6):1136-1153.]
Acharya K,Nandi S,Dutta A K. 2019. Microanatomical and physicochemical characterization and antioxidative activity of methanolic extract of Oudemansiella canarii(Jungh.) Höhn[J]. Turkish Journal of Pharmaceutical Sciences,16(1):76-81.
Carvalho D B,Smith M L,Anderson J B. 1995. Genetic exchange between diploid and haploid mycelia of Armilla-ria gallica[J].Mycological Research,99(36):641-647.
Eiji T,Kenji Y,Yuri M,Kenjiro K. 1994. Nuclear selection and nuclear substitution in fully compatible demonm ma-tings in Pleurotus ostreatus[J]. Mycoscience, 35(3):239-243.
Gao Z,Liu X C,Wang W S,Yang Q H,Dong Y H,Xu N,Zhang C,Song X L,Ren Z Z,Zhao F L,Z L J,Jia L. 2019. Characteristic anti-inflammatory and antioxidative effects of enzymatic-and acidic-hydrolysed mycelium polysaccharides by Oudemansiella radicata on LPS-induced lung injury[J]. Carbohydrate Polymers,204:142-151.
Hao Y J,Zhao Q,Wang S X,Yang Z. 2016. What is the radicate Oudemansiella cultivated in China[J]. Phytotaxa,286(1):1-12.
Koizumi S,Nagatsu T,Iinuma H,Ohno M,Takeuchi T,Umezawa H. 1982. Inhibition of phenylalanine hydroxylase,a pterin-requiring monooxygenase,by oudenone and its derivatives[J]. The Journal of Antibiotics,35(4):458-462.
Kwon O C,Lee C S,Park Y J. 2019. SNP and SCAR mar-kers for specific discrimination of antler-shaped Ganoderma lucidum[J]. Microorganisms,7(1):12.
Mah J T L,Low E S H,Lee E. 2011. In silico SNP analysis and bioinformatics tools:A review of the state of the art to aid drug discovery[J]. Drug Discovery Today,16(17-18):800-809.
Nieuwenhuis B P S,Nieuwhof S,Aanen D K. 2013. On the asymmetry of mating in natural populations of the mushroom fungus Schizophyllum commune[J]. Fungal Genetics and Biology,56(5):25-32.
Pilotti C A,Sanderson F R,Aitken E A B. 2002. Sexuality and interactions of monokaryotic and dikaryotic mycelia of Ganoderma boninense[J]. Mycological Research,106(11):1315-1322.
Wang Y F,Jia J X,Ren X X,Li B H,Zhang Q. 2018. Extraction,preliminary characterization and in vitro antioxidant activity of polysaccharides from Oudemansiella radicata mushroom[J]. International Journal of Biological Macromolecules, 120(Part B):1760-1769.
Xiang X Z,Wang X X,Bian Y B,Xu Z Y. 2016. Development of crossbreeding high-yield-potential strains for commercial cultivation in the medicinal mushroom Wolfiporia cocos(Higher Basidiomycetes)[J]. Journal of Natural Me-dicines,70(3):645-652.
(责任编辑 兰宗宝)
优 秀 青 年 学 者 论 坛
于浩(1985-),博士,副教授,青岛农业大学生命科学学院硕士生导师,毕业于上海交通大學微生物代谢国家重点实验室。主要从事食用菌遗传育种及食用菌生长发育与抗病、抗逆分子机理研究工作。主持、参与国家自然科学基金项目、国家重点研发计划项目、山东省自然科学基金项目、山东省重点研发计划项目、山东省现代农业产业技术体系食用菌创新团队建设项目等13项。在国内外期刊上发表论文40余篇,其中以第一作者或通讯作者在《Journal of Biological Chemistry》《Applied and Environmental Microbiology》《Applied Microbiology and Biotechnology》《Journal of Bacteriology》等SCI期刊上发表学术论文16篇。申报国家专利9项,获国家发明专利3项。
