附子脂溶性生物碱与白芍总苷配伍治疗风寒湿痹证模型大鼠的增效作用研究
2019-09-10谢运飞李芸霞谢红军彭成
谢运飞 李芸霞 谢红军 彭成


中圖分类号 R285.5 文献标志码 A 文章编号 1001-0408(2019)20-2772-06
DOI 10.6039/j.issn.1001-0408.2019.20.08
摘 要 目的:研究附子脂溶性生物碱与白芍总苷配伍治疗风寒湿痹证模型大鼠的增效作用。方法:取SD雄性大鼠100只,随机分为空白组(水),模型组(水),罗通定组[阳性对照,10.0 mg/(kg·d)]、地塞米松组[阳性对照,0.3 mg/(kg·d)],附子生物碱低、高剂量组[附子脂溶性生物碱浸膏12.5、25.0 mg/(kg·d)],白芍总苷低、高剂量组[白芍总苷粉末200.0、400.0 mg/(kg·d)],配伍低、高剂量组[附子脂溶性生物碱浸膏+白芍总苷粉末分别为12.5 mg/(kg·d)+400.0 mg/(kg·d)、25.0 mg/(kg·d)+800.0 mg/(kg·d)],每组10只。除空白组外,其余各组大鼠均于右后足垫部位注射完全弗氏佐剂0.1 mL并辅以风、寒、湿刺激来复制风寒湿痹证模型。造模19 d后开始灌胃给药或水,每日1次,持续14 d。分别于给药第0(即给药前)、3、6天时测定大鼠的关节压痛阈值(地塞米松组除外)和关节肿胀指数(罗通定组除外);采用苏木素-伊红染色法,观察大鼠(罗通定组除外)踝关节滑膜组织的病理学变化;采用酶联免疫吸附法测定大鼠(罗通定组除外)血清中抗环瓜氨酸肽(CCP)抗体并计算增效指数(CI)。结果:与空白组比较,模型组大鼠关节压痛阈值在不同给药时间点均显著降低,关节肿胀指数则显著升高(P<0.01);滑膜组织炎性病变现象明显;血清中抗CCP抗体含量显著升高(P<0.01)。与模型组比较,各给药组大鼠关节压痛阈值、关节肿胀指数、滑膜组织病变程度以及血清中抗CCP抗体含量均有不同程度的改善,大部分指标差异有统计学意义(P<0.05或P<0.01),且配伍组的指标改善效果优于单味组分给药组;基于抗CCP抗体含量计算得CI值为0.213(>1),提示两者配伍具有协同作用。结论:附子脂溶性生物碱与白芍总苷配伍治疗风寒湿痹证模型大鼠具有镇痛、抗炎、保护滑膜组织等作用,并呈协同增效作用。
关键词 附子脂溶性生物碱;白芍总苷;配伍;风寒湿痹证;增效作用;抗环瓜氨酸肽抗体;大鼠
ABSTRACT OBJECTIVE: To study the efficacy enhancing effect of compatibility of Aconitum carmichaeli liposoluble alkaloids and total glucosides of peony in the treatment of wind-cold-dampness type bi-syndrome model rats. METHODS: Totally 100 SD male rats were randomly divided into blank group (water), model group (water), rotundine group [positive control, 10.0 mg/(kg·d)], dexamethasone group [positive control, 0.3 mg/(kg·d)],A. carmichaeli alkaloids low-dose and high-dose groups [A. carmichaeli liposoluble alkaloid extract 12.5, 25.0 mg/(kg·d)], total glucosides of peony low-dose and high-dose groups [total glucosides of peony powder 200.0,400.0 mg/(kg·d)], compatibility low-dose and high-dose groups [A. carmichaeli liposoluble alkaloid+total glucosides of peony powder were 12.5 mg/(kg·d)+400.0 mg/(kg·d), 25.0 mg/(kg·d)+800.0 mg/(kg·d) respectively], with 10 rats in each group. Except for blank group, other groups were given complete Freund’s adjuvant 0.1 mL on the right hind paw and wind-cold-dampness stimulation to induce wind-cold-dampness type bi-syndrome model. Nineteen days after modeling, they were given relevant medicine or water intragastrically, once a day, for consecutive 14 d. The joint tenderness threshold (except for dexamethasone group) and joint swelling index (except for rotundine group) were measured at 0 (before medication), 3rd and 6th day after administration respectively. HE staining was used to observe the pathological changes of synovial membrane of ankle joint in rats (except for rotundine group). ELISA assay was used to determine anti-cyclic citrullinated peptide (CCP) antibody in serum of rats (except for rotundine group), and compatibility index (CI) were calculated. RESULTS: Compared with blank group, joint tenderness threshold of rats were decreased significantly in model group at different time points, while joint swelling index was increased significantly (P<0.01). Inflammatory lesions in synovial tissue were obvious, and the content of anti-CCP antibody in serum was significantly increased (P<0.01). Compared with model group, the joint tenderness threshold, joint swelling index, synovial tissue pathological changes and anti-CCP antibody content in serum of rats in medication groups were improved in varying degrees, most of the indicators had significant difference (P<0.05 or P<0.01), and the improvement effect of the compatibility groups was better than single component treatment groups. CI value calculated based on anti-CCP antibody content was 0.213,suggesting that the compatibility of the two components had synergistic effect. CONCLUSIONS: The compatibility of A. carmichaeli liposoluble alkaloids and total glucosides of peony in the treatment of wind-cold-dampness type bi-syndrome model rats has analgesia,anti-inflammation and synovial tissue protection, with synergistic efficacy-enhancing effect.
KEYWORDS Aconitum carmichaeli liposoluble alkaloids;Total glucosides of peony;Compatibility; Wind-cold-dampness type bi-syndrome; Efficacy-enhancing effect; Anti-cyclic citrullinated peptide antibody; Rat
附子为毛茛科植物乌头(Aconitum carmichaeli Debx)的子根加工品,始载于《神龙本草经》,其味辛、甘,性大热,有毒,具有回阳救逆、补火助阳、散寒止痛等功效,主治亡阳虚脱、肢冷脉微、心阳不足、胸痹心痛、虚寒吐泻、脘腹冷痛、肾阳虚衰、阳痿宫冷、阴寒水肿、阳虚外感、寒湿痹痛等症[1]。白芍为毛茛科植物芍药(Paeonia lactiflora Pall.)的干燥根,其最早收录于《五十二病方》,《神龙本草经》对其有详细记载,其气微,味微苦、酸,性微寒,归肝、脾经,有小毒,具有养血敛阴、柔肝止痛、平抑肝阳等功效[2-3]。
中医理论将类风湿性关节炎(RA)归属为“痹证”的范畴,也称其为“历节风”“鹤膝风”“尪痹”等,并认为痹证的发生发展是风寒湿热等外邪的侵袭,合并气血亏虚、经脉不通、情志失调等内因导致身体正气缺失所致[4-5]。中药配伍理论是传统中医的智慧结晶,恰当的配伍不仅能使合用药物产生协同效应、增强疗效,亦可降低毒性、减少药物不良反应;其形式不仅包括药对以及饮片的配伍,还包括中药组分以及单体成分的配伍[6]。附子因其生物碱类成分毒性强烈,所以需要进行适当炮制和药对配伍,以降低毒性、增加疗效[7];白芍则药性甘缓柔润,与附子配伍,可缓和附子刚燥辛烈之性,起到刚柔相济、温阳祛寒的功效,而无耗伤阴血之弊[8]。现代研究表明,附子与白芍配伍可有效降低有毒性的附子双酯型生物碱在心、肝、肾等脏器中的蓄积,增加小鼠对附子毒性生物碱的耐受性,提高药物的转运效率,降低佐剂性关节炎模型大鼠血清中部分促炎细胞因子的水平等[9-10]。
附子与白芍配伍是历代医家推崇的传统药对,主要用于治疗风寒湿痹痛、中风麻木疼痛等,具有增效减毒的效果[11]。附子的脂溶性生物碱类成分是其重要的生物活性成分,具有镇痛、抗炎、强心、免疫调节等多种药理效应,其中镇痛、抗炎及免疫调节作用与风寒湿痹证的治疗密切相关[12]。白芍总苷亦具有抗炎及免疫调节等作用,其成品已通过国家食品药品监督管理局的批准,用于风寒湿痹证的治疗[13-14]。但两种组分的配伍增效作用缺乏相关基础性研究。因此,本研究采用关节压痛阈值、关节肿胀指数、组织病理学及增效指数(CI)等指标,探讨附子脂溶性生物碱与白芍总苷配伍治疗风寒湿痹证的增效作用,为两者的临床合理联用提供理论支撑。
1 材料
1.1 仪器
AL204型电子天平[梅特勒-托利多仪器(上海)有限公司];KDC-2046型低速冷冻离心机(安徽中科中佳科学仪器有限公司);YLS-3E型压痛仪(山东省医学科学院设备站);MNT-150型数显游标卡尺(上海美耐特实业有限公司);3001型全波长酶标仪(美国赛默飞世尔科技公司);QL-9001型快速振荡器(海门市麒麟医用仪器厂);Eclipse Ci型科研显微镜、DS-Fi2型显微镜摄像头(日本尼康株式会社)。
1.2 药品与试剂
罗通定片(成都市湔江制药厂,批号:170921,规格:30 mg/片);地塞米松片(重庆科瑞制药有限公司,批号:348001,规格:0.75 mg/片);完全弗氏佐剂(美国Sigma公司,批号:SLBV6895);水合氯醛(成都市科龙化工试剂厂,批号:2016092901);4%多聚甲醛通用型组织固定液(合肥新恩源生物技术有限公司,批号:1808575);10%乙二胺四乙酸(EDTA)脱钙液、苏木素-伊红(HE)试剂(武汉赛维尔生物科技有限公司,批号:YP184204、20180925);大鼠抗环瓜氨酸肽(CCP)抗体酶联免疫吸附试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号:3JWZM4UWG5);其余试剂均为分析纯或实验室常用规格,水为蒸馏水。
1.3 药材
附子(四川江油中坝附子科技发展有限公司,批号:160901);白芍(安徽亳州中药材市场,批号:20160508)。药材经由成都中医药大学生药学教研室裴瑾教授鉴定,分别为毛茛科植物乌头(A. carmichaeli Debx)子根的黑顺片炮制品和毛茛科植物芍药(P. lactiflora Pall.)的干燥根。
1.4 动物
SD大鼠100只,SPF级,雄性,体质量(200±20)g,购自四川省中医科学院实验动物中心,动物生产许可证号:SCXK(川)2018-19。大鼠均适应性喂养7 d后进行后续实验。
2 方法
2.1 附子脂溶性生物碱和白芍总苷的制备
按本课题组前期研究方法[15]提取附子脂溶性生物碱和白芍总苷,原药材及所获提取物均为同一批次。
2.1.1 附子脂溶性生物碱的制备 取黑顺片5 kg,粉碎,用二氯甲烷、5%Na2CO3溶液先后浸泡,再以二氯甲烷为溶剂加热回流提取2次;合并提取液,回收溶剂并浓缩后,以0.05 mol/L硫酸溶液萃取2次;合并酸水萃取液,加氨水调pH至9~10,再以二氯甲烷萃取3次;合并有机相萃取液,回收溶剂并浓缩,得附子脂溶性生物碱浸膏(12.5 g)。
2.1.2 白芍总苷的制备 取白芍药材5 kg,粉碎,以70%乙醇为溶劑加热回流提取2次;合并提取液,回收溶剂并浓缩至无醇味;取浓缩液,过D101型大孔树脂,先后以水、25%乙醇洗脱;收集25%乙醇洗脱部位,回收溶剂并浓缩至无醇味,喷雾干燥,得白芍总苷粉末(200.0 g)。
2.2 分组、造模与给药
取大鼠100只,随机分为空白组,模型组,罗通定组[阳性对照,10.0 mg/(kg·d);按等效剂量系数折算法[16]制定给药剂量],地塞米松组[阳性对照,0.3 mg/(kg·d);按罗通定组同法制定给药剂量],附子生物碱低、高剂量组[附子脂溶性生物碱浸膏12.5、25.0 mg/(kg·d);按前期研究结果[17]制定剂量],白芍总苷低、高剂量组[白芍总苷粉末200.0、400.0 mg/(kg·d);按前期研究结果[15]制定剂量],配伍低、高剂量组[附子脂溶性生物碱和白芍总苷分别为12.5 mg/(kg·d)+400.0 mg/(kg·d)、25.0 mg/(kg·d)+800.0 mg/(kg·d);按前期研究结果[15]制定配伍比例,相当于附子与白芍原药材配伍比例为1 ∶ 2],每组10只。罗通定片、地塞米松片、附子脂溶性生物碱浸膏、白芍总苷粉末均在临用前以水配制成适当浓度的药液,每次给药体积均为20 mL/kg。
根据文献方法[17]进行造模:模型组和各给药组大鼠均于右后足垫部位注射完全弗氏佐剂0.1 mL以建立佐剂性关节炎(AIA)模型,然后每天将大鼠双后足踝关节以下部位浸泡于凉水15 min,同时吹电风扇刺激,即在AIA模型的基础上,辅以“风、寒、湿”等外因刺激,以建立符合中医病证结合特点的风寒湿痹证模型;空白组大鼠在在相同部位注射生理盐水0.1 mL,并避免风、寒、湿的刺激。自注射之日起第19天时,各给药组大鼠分别灌胃相应药液,每日1次,连续14 d;空白组和模型组大鼠均同法灌胃相应体积水。
2.3 大鼠关节压痛阈值测定
分别于给药第0(即给药前)、3、6天时,取“2.2”项下除地塞米松组外的各组大鼠,采用电子压痛仪进行其左、右踝关节疼痛情况测定。压痛阈值以大鼠产生疼痛挣扎时的仪器计数为准。
2.4 大鼠关节肿胀指数测定
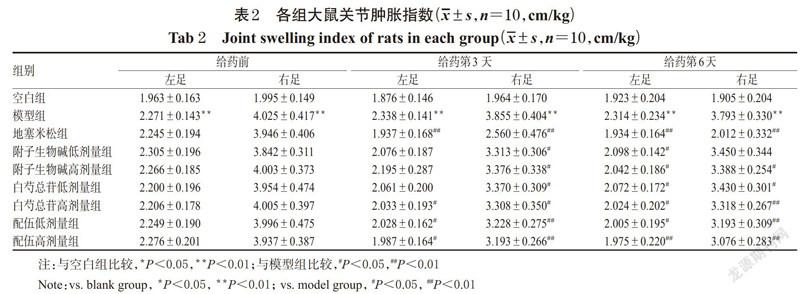
分别于给药第0(即给药前)、3、6天时,取“2.2”项下除罗通定组外的各组大鼠,采用游标卡尺测量其左、右足踝关节直径,计算肿胀指数[18]:肿胀指数(cm/kg)=关节直径(cm)/体质量(g)×10-3。
2.5 样本采集及处理
末次给药后2 h,取除罗通定组外的各组大鼠,腹腔注射10%水合氯醛(3 mL/kg)麻醉,用含促凝剂的真空采血管从其腹主动脉采集血样,静置30 min后,在4 ℃条件下以1 000×g离心10 min,收集上层血清。血样采集完毕后,迅速断颈处死大鼠,收集注射足的对侧足(左足)关节样本,置于4%多聚甲醛通用型组织固定液中固定。
2.6 大鼠滑膜组织病理学检查
取“2.5”项下固定的大鼠左足踝关节组织,在4 ℃条件下以10%EDTA脱钙液进行脱钙60 d,期间定期更换脱钙液;脱钙完成后取关节组织进行石蜡包埋,制作切片(厚度:4 μm);采用HE法染色后,置于显微镜下观察。以结缔组织增生、炎性细胞浸润、新生血管形成等情况评价滑膜组织病变程度。
2.7 大鼠血清中抗CCP抗体含量测定及配伍增效作用评价
取“2.5”项下大鼠血清样本,按酶联免疫吸附法试剂盒说明书操作,用酶标仪测定血清抗CCP抗体含量。根据文献方法[19],计算附子脂溶性生物碱与白芍总苷配伍治疗风寒湿痹证的CI。首先,按公式计算各组大鼠血清抗CCP抗体抑制率:抗体抑制率=[(模型组抗CCP抗体含量-空白组抗CCP抗体含量)-(给药组抗CCP抗体含量-空白组抗CCP抗体含量)]/(模型组抗CCP抗体含量-空白组抗CCP抗体含量);然后,采用CompuSyn 1.0软件录入附子生物碱各剂量组、白芍总苷各剂量组、配伍各剂量组大鼠的给药剂量及其抗CCP抗体抑制率,由软件自动计算得到CI值。按以下标准判断附子脂溶性生物碱与白芍总苷配伍的增效作用:CI<1,表明两者配伍具有协同作用;CI=1,表明两者配伍具有相加作用;CI>1,表明两者配伍具有拮抗作用[20]。
2.8 统计学方法
采用SPSS 21.0软件对实验数据进行统计分析。计量资料均以x±s表示,组间比较采用t检验。P<0.05为差异具有统计学意义。
3 结果
3.1 大鼠关节压痛阈值测定结果
与空白组比较,给药前及给药第3、6天时,模型组大鼠左、右足关节压痛阈值显著降低,差异有统计学意义(P<0.01)。与模型组比较,给药前,各给药组大鼠左、右足关节压痛阈值差异均无统计学意义(P>0.05);给药第3、6天时,罗通定组大鼠、附子生物碱各剂量组和配伍各剂量组大鼠上述指标均显著升高,差异均有统计学意义(P<0.05或P<0.01),而白芍各剂量组上述指标差异均无统计学意义(P>0.05)。各组大鼠关节压痛阈值测定结果见表1。
3.2 大鼠关节肿胀指数测定结果
与空白组比较,给药前及给药第3、6天时,模型組大鼠左、右足关节肿胀指数显著升高,差异均有统计学意义(P<0.01)。与模型组比较,给药前,各给药组大鼠左、右足关节肿胀指数差异均无统计学意义(P>0.05);给药第3天时,地塞米松组、白芍总苷高剂量组和配伍各剂量组大鼠左、右足关节肿胀指数,附子生物碱各剂量组和白芍总苷低剂量组大鼠右足关节肿胀指数均显著降低,差异均有统计学意义(P<0.05或P<0.01);给药第6天时,地塞米松组、附子生物碱高剂量组、白芍总苷各剂量组和配伍各剂量组大鼠左、右足关节肿胀指数,附子生物碱低剂量组左足关节肿胀指数均显著降低,差异均有统计学意义(P<0.05或P<0.01);其余指标差异均无统计学意义(P>0.05)。各组大鼠关节肿胀指数测定结果见表2。
3.3 大鼠滑膜组织病理学检查结果
空白组大鼠滑膜未见明显增生,也未见炎性细胞大量浸润或炎症变化;模型组大鼠滑膜组织呈重度增生,伴有大量淋巴细胞、中性粒细胞及少量多核巨细胞浸润,存在较多坏死细胞碎片,并可见较多囊腔结构及新生血管;各给药组大鼠的滑膜病变情况均有不同程度的改善,滑膜增生较轻微,炎性细胞浸润明显减少,少见囊腔结构及新生血管,其中以地塞米松组和配伍高剂量组改善程度最明显。各组大鼠左足关节滑膜组织病理学显微图见图1。
3.4 大鼠血清中抗CCP抗体含量及CI
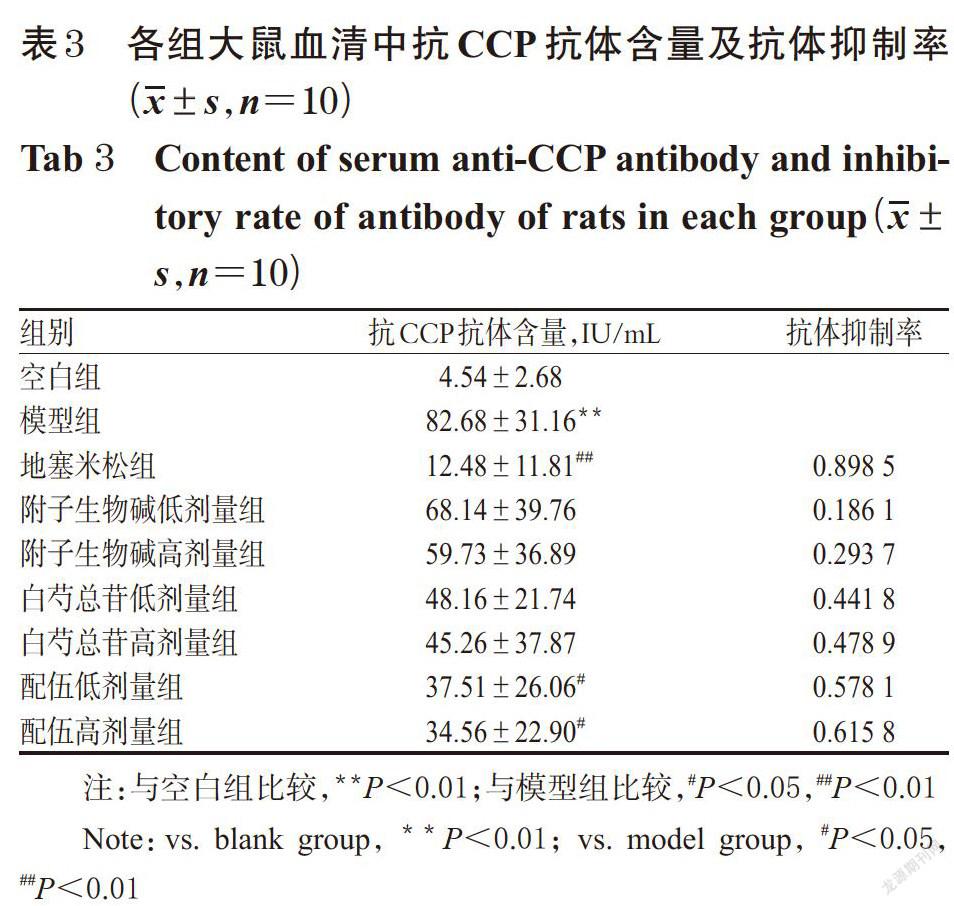
与空白组比较,模型组大鼠血清中抗CCP抗体含量显著升高,差异有统计学意义(P<0.01)。与模型组比较,地塞米松组大鼠血清中抗CCP抗体含量显著降低,差异有统计学意义(P<0.01),抗体抑制率为0.898 5;附子生物碱低、高剂量组,白芍总苷低、高剂量组大鼠血清中抗CCP抗体含量均有不同程度降低,但差异均无统计学意义(P>0.05),抗体抑制率分别为0.186 1、0.293 7、0.441 8、0.478 9;配伍低、高剂量组大鼠血清中抗CCP抗体含量均显著降低,差异均有统计学意义(P<0.05),抗体抑制率分别为0.578 1、0.615 8。附子脂溶性生物碱与白芍总苷配伍的CI值为0.213(<1),表明两者配伍具有协同作用。各组大鼠血清中抗CCP抗体含量及抗体抑制率测定结果见表3。
4 討论
乌头类中药与白芍配伍,具有散寒止痛、通经活络之功效,是中医治疗风寒湿痹证的经典药对之一,且沿用至今。风寒湿痹证患者常常伴随关节疼痛、肿胀、畸形等临床症状,且随着病程延长,其滑膜、骨、软骨及韧带等重要组织不断被侵蚀与破坏,对患者生活造成严重影响[21]。本研究考察了附子脂溶性生物碱与白芍总苷配伍对风寒湿痹证模型大鼠关节压痛阈值、关节肿胀指数、组织病理学及CI等指标的影响,旨在为这两种活性组分临床联用治疗风寒湿痹证提供实验依据。
传统的佐剂诱导关节炎或胶原诱导关节炎模型,不能完全反映中医“证”的特征,故近年来国内学者在其基础上,结合“风、寒、湿”等外因刺激,建立了病证结合的风寒湿痹证模型[22]。研究发现,与传统关节炎模型比较,风寒湿痹证模型动物在关节肿胀、滑膜病变以及细胞凋亡程度方面表现更为严重[23];且关节表面温度较低、血流量减少,低剪切率下全血黏度、血浆黏度以及红细胞压积均明显增高,符合风寒湿痹证“寒凝血瘀”的特征[24]。因此,本研究采用符合中医病证结合特点的风寒湿痹证模型,更符合附子与白芍在临床应用的实际情况。
罗通定是非甾体抗炎药,能通过抑制环氧合酶活性、减少前列腺素合成从而显著缓解风寒湿痹证患者的关节疼痛,但对疾病的发展无控制作用[25],故本研究在大鼠的关节压痛实验中选取罗通定作为阳性对照药。而糖皮质激素作用强大且药效广泛,可通过减少炎症组织中单核巨噬细胞、中性粒细胞等的数量,抑制促炎性细胞因子、基质金属蛋白酶的释放,减少滑膜及周围组织的炎性渗出,从而产生强效的抗炎、免疫抑制作用,是风寒湿痹证治疗中用于缓解炎性损伤的一类重要药物[26]。因此,本研究中的大鼠关节肿胀实验、组织病理学检查以及基于抗CCP抗体抑制率的CI计算,均选取经典的糖皮质激素药地塞米松作为阳性对照药。
大鼠关节压痛实验结果显示,罗通定、附子脂溶性生物碱单用以及其与白芍总苷配伍均具有较强的镇痛作用,且配伍组的镇痛效果优于单味组分给药组。大鼠关节肿胀实验结果显示,地塞米松、附子脂溶性生物碱、白芍总苷以及二者配伍均具有较强的抗炎作用,且配伍组的抗炎效果优于单味组分给药组。组织病理学检查结果显示,地塞米松组与配伍组的滑膜保护效果优于其它单味组分给药组。上述实验结果表明,附子脂溶性生物碱与白芍总苷配伍可显著缓解风寒湿痹证患者的关节疼痛、降低关节肿胀程度、保护滑膜组织、减少炎性损伤,且二者配伍具有明显的增效作用。
类风湿因子(RF)和抗CCP抗体是临床用于诊断RA的两个重要的检测指标。其中,RF虽因最初在RA疾病中被发现而以此命名,且检测敏感性可达70%以上,但由于其在系统性红斑狼疮、系统性硬化症、多肌炎或真皮炎、冷球蛋白血症及混合型结缔组织病等疾病中亦有阳性表达,所以其对RA的特异性相对较差[27]。2000年,Schellekens GA等[28]首次使用酶联免疫吸附法测定了RA患者血清抗CCP抗体并逐渐应用于临床。该抗体检测敏感性与RF相似,但对RA疾病的特异性高达90%以上[29]。临床研究表明,不同的RA中医证型中,患者的血清抗CCP抗体表达亦出现一定的差异性,尤其以在风寒湿型患者中的表达最高[30]。本课题组前期通过预实验发现,风寒湿痹证模型大鼠的血清RF与空白组比较差异无统计学意义,但抗CCP抗体则较空白组显著升高(P<0.01)。因此,本研究在进行CI值计算时,采用血清抗CCP抗体作为特征性参考指标,用于量化不同药物的治疗效果及协同作用。抗CCP抗体测定及CI值计算结果显示,配伍组的血清抗CCP抗体抑制率显著高于单味组分给药组,且CI值为0.213,这提示附子脂溶性生物碱与白芍总苷配伍可能具有显著降低风寒湿痹证患者体内异常升高的特异性指标的作用。CI值的计算,为两种组分配伍治疗风寒湿痹证的增效作用提供了新的实验证据。
综上所述,附子脂溶性生物碱与白芍总苷配伍治疗风寒湿痹证模型大鼠的镇痛、抗炎作用更强,对滑膜组织的保护作用更强,并表现为协同效应,具有明显的增效作用。本研究为附子与白芍这一中医经典药对的临床合理联用提供了更多的证据支持,然而中药配伍增效的复杂作用机制还需通过更多的技术手段深入研究,以进一步验证此结论。
参考文献
[ 1 ] 缪璐琳,熊秋韵,高继海,等.不同产地和叶形附子水煎液的抗炎、镇痛作用比较[J].中国药房,2017,28(25):3483-3486.
[ 2 ] 崔虹,朱佳茜,冯秋芳,等.中药白芍化学成分及生物活性研究进展[J].海峡药学,2017,29(9):1-5.
[ 3 ] 杨晓帆.白芍有效成分的研究进展[J].广州化工,2015,43(20):1-5.
[ 4 ] 李建洪,杨博,狄朋桃,等.中医药治疗类风湿性关节炎研究概况[J].中国民族民间医药,2017,26(13):41-44.
[ 5 ] 张勇,温蕾.中医对风湿性关节炎的病因病机认识及治疗现状研究[J].中医临床研究,2018,10(35):144-146.
[ 6 ] 彭成.试论中药配伍研究的方法与实践[J].中药与临床,2012,3(1):1-4.
[ 7 ] 张云丽,吴永佩,刘丽婷.乌头类中药炮制配伍减毒增效的研究进展[J].中国医药指南,2017,15(32):10-11.
[ 8 ] 吴庆光,姚海燕,蓝森麟,等.白芍配伍缓性制毒浅析[J].中药与临床,2012,3(1):36-37.
[ 9 ] 皮子凤,宋凤瑞,刘志强,等.附子不同配伍药对中生物碱成分的电喷雾质谱分析[J].药学学报,2007,42(2):201-205.
[10] 杨华生,梁秉文,黎晓丽,等.制川乌配伍白芍对6种乌头生物碱经皮吸收的影响[J].中成药,2015,37(9):1917-1921.
[11] 刘家骅.药对[M].北京:人民卫生出版社,2009:324.
[12] 熊亮,彭成,缪璐琳,等.基于“毒-效整合分析思路”探讨有毒中药附子的物质基础[J].世界中医药,2017,12(11):2568-2578.
[13] 余欣然,曹峰,陈云志.白芍总苷在自身免疫性疾病中的运用进展[J].中医药学报,2019,47(1):127-130.
[14] WU H,WEI W,SONG L,et al. Paeoniflorin induced immune tolerance of mesenteric lymph node lymphocytes via enhancing beta2-adrenergic receptor desensitization in rats with adjuvant arthritis[J]. Int Immunopharmacol,2007,7(5):662-673.
[15] XIE YF,FENG WW,LIU MC,et al. Investigation of efficacy enhancing and toxicity reducing mechanism of combination of Aconiti Lateralis Radix Praeparata and Paeo- niae Radix Alba in adjuvant-induced arthritis rats by meta- bolomics[J]. Evid Based Complement Alternat Med,2019.DOI:10.1155/2019/9864841.
[16] 徐叔云.药理实验方法学[M].北京:人民卫生出版社,1982:1861.
[17] 姜辉,刘健,高家荣,等.五味温通除痹胶囊对类风湿关节炎风寒湿痹阻证模型大鼠的治疗作用[J].风湿病与关节炎,2012,1(6):23-27.
[18] 李晋奇,彭成,姬洁莹.制川乌总碱与白芍总苷、白芍多糖配伍治疗类风湿性关节炎大鼠的作用机制研究[J].中国中药杂志,2009,34(22):2937-2942.
[19] CHOU TC. Drug combination studies and their synergy quantification using the Chou-Talalay method[J]. Cancer Res,2010,70(2):440-446.
[20] YANG T,AIMAITI M,SU DQ,et al. Enhanced efficacy with reduced toxicity of chemotherapy drug 5-fluorouracil by synergistic treatment with Abnormal Savda Munziq from Uyghur medicine[J]. BMC Complement Altern Med,2017,17(1):1-10.
[21] 秦桂福,李惠玲,叶志勤,等.尪痹胶囊治疗类风湿关节炎60例[J].中国中医骨伤科杂志,2019,27(7):54-56.
[22] 岳静,张亚楠,季旭明,等.类风湿性关节炎病证结合动物模型的研究进展[J].辽宁中医杂志,2016,43(5):1095- 1097.
[23] 董小君,王永辉,侯渊,等.不同外感致病因素对病证结合CIA模型建立的比较研究[J].辽宁中医杂志,2018,45(9):1987-1991.
[24] 孙艳群.乌头汤抗类风湿性关节炎作用及机制探索[D].北京:中国中医科学院,2012.
[25] 张晓攀,李艳贞,李珊珊,等.类风湿性关节炎治疗药物研究进展[J].药物评价研究,2018,41(10):1906-1910.
[26] 罗应碧.类风湿性关节炎患者应用糖皮质激素治疗对骨密度的影响[J].临床医药文献电子杂志,2018,5(66):147-148.
[27] 吴意,张艳如.抗CCP抗体和RF对类风湿性关节炎诊断价值的比较[J].中国现代医学杂志,2010,20(17):2680-2684.
[28] 刘金禄,王蕾,何晓峰,等.类风湿性关节炎实验诊断研究进展[J].河北北方学院学报,2012,28(1):108-111.
[29] SCHELLEKENS GA,VISSER H,DE JONG BA,et al.The diagnostic properties of rheumatoid arthritis antibo- dies recognizing a cyclic citrullinated peptide[J]. Arthritis Rheum,2000,43(1):155-163.
[30] 陈琛.抗CCP抗体、RF的血清水平与类风湿关节炎中医证型的特点分析[D].兰州:甘肃中医药大学,2017.
(收稿日期:2019-05-16 修回日期:2019-08-11)
(編辑:段思怡)
