补阳还五汤对特发性肺纤维化模型大鼠肺组织内皮间质转化的影响及其机制研究
2019-09-10杨邯捷赵惠亮渠景连谭芸王俊霞
杨邯捷 赵惠亮 渠景连 谭芸 王俊霞

中圖分类号 R285 文献标志码 A 文章编号 1001-0408(2019)20-2757-06
DOI 10.6039/j.issn.1001-0408.2019.20.05
摘 要 目的:探讨补阳还五汤对特发性肺纤维化(IPF)模型大鼠肺组织内皮间质转化(EndMT)的影响,并探讨其可能机制。方法:将雄性SD大鼠随机分为正常组、模型组、地塞米松组[0.405 mg/(kg·d)]和补阳还五汤低、中、高剂量组[6.435、12.87、25.74 g/(kg·d),以生药总质量计],每组8只。除正常组外,其余各组大鼠均于气管内注射博来霉素以复制IPF模型。自造模后第2天起,正常组和模型组大鼠均灌胃水[10 mL/(kg·d)],各给药组大鼠灌胃相应药物,每日1次,连续28 d。末次给药24 h后,采用免疫组化法检测大鼠肺组织中内皮细胞标志物[血小板内皮细胞黏附分子1、血管内皮细胞钙黏蛋白]和间质细胞标志物[α-平滑肌肌动蛋白、成纤维细胞特异性蛋白1]的表达情况,采用蛋白质印迹法检测大鼠肺组织中Notch4、DLL4的表达情况。结果:与正常组比较,模型组大鼠肺组织中内皮细胞标志物的表达水平均显著降低,间质细胞标志物以及Notch4、DLL4的表达水平均显著升高(P<0.01)。各给药组大鼠肺组织中内皮细胞标志物的表达水平均显著高于模型组,补阳还五汤低剂量组上述指标显著低于地塞米松组;间质细胞标志物以及Notch4、DLL4的表达水平均显著低于模型组,补阳还五汤低剂量组上述指标显著高于地塞米松组(P<0.05或P<0.01)。结论:补阳还五汤可通过干预EndMT来减轻大鼠的IPF,其机制可能与抑制DLL4/Notch4信号通路有关。
关键词 特发性肺纤维化;补阳还五汤;内皮间质转化;内皮细胞标志物;间质细胞标志物;DLL4/Notch4信号通路;机制;大鼠
ABSTRACT OBJECTIVE: To investigate the effects of Buyang huanwu decoction on endothelial-mesenchymal transformation (EndMT) of lung tissue in idiopathic pulmonary fibrosis (IPF) model rats, and to explore its potential mechanism. METHODS: Male SD rats were randomly divided into normal group, model gorup, dexamethasone group [0.405 mg/(kg·d)], Buyang huanwu decoction low-dose, medium-dose and high-dose groups [6.435, 12.87, 25.74 g/(kg·d), by raw material], with 8 rats in each group. Except for normal group, other groups were given endotracheal injection of bleomycin to induce IPF model. On the second day after modeling, normal group and model group were given water intrgastrically [10 mL/(kg·d)]; administration groups were given relevant medicine intragastrically, once a day, for consecutive 28 days. 24 h after last medication, the expression of endothelial cell markers [platelet endothelial cell adhesion molecule 1, vascular endothelial cell cadherin] and interstitial cell markers [α-smooth muscle actin, fibroblast specific protein 1] were detected by immunohistochemistry method. The expression of Notch4 and DLL4 in lung tissue of rats were detected by Western blotting assay. RESULTS: Compared with normal group, the expression of endothelial cell markers were decreased significantly in lung tissue of model group, while the expressipon of interstitial cell markers, Notch4 and DLL4 were increased significantly (P<0.01). Compared with model group, the expression of endothelial cell markers in lung tissue of rats were increased significantly in administration groups, while Buyang huanwu decoction low-dose group was significantly lower than dexamethasone group; the expression of interstitial cell markers, Notch4 and DLL4 were decreased significantly, while Buyang huanwu decoction low-dose group was significantly higher than dexamethasone group (P<0.05 or P<0.01). CONCLUSIONS: Buyang huanwu decoction can relieve IPF of model rats by intervening in EndMT, the mechanism of which may be associated with inhibiting DLL4/Notch4 singaling pathway.
KEYWORDS Idiopathic pulmonary fibrosis; Buyang huanwu decoction; Endothelial-mesenchymal transformation; Endothelial cell marker; Interstitial cell marker; DLL4/Notch4 singaling pathway; Mechanism; Rats
特发性肺纤维化(Idiopathic pulmonary fibrosis,IPF)是一种慢性纤维化性间质性肺炎,临床主要表现为进行性呼吸困难或刺激性干咳,其病情呈持续性进展,最终可导致患者呼吸衰竭而亡[1]。目前,IPF的发病机制尚未完全阐明,肺泡上皮损伤后修复异常被认为是该病的主要发生机制[2]。但有研究表明,内皮间质转化(Endothelial-to-mesenchymal transition,EndMT)也是IPF发生、发展的重要机制之一[3]。EndMT是指在特定的生理条件下,内皮细胞的形态由鹅卵石样转变为细长梭形,同时其迁移能力和侵袭能力显著增强的病理过程。在此过程中,内皮细胞特异性标志物[如血管内皮细胞钙黏蛋白(VE-cadherin)、血小板内皮细胞黏附分子1(CD31)等]的表达逐渐减弱或丧失,而间质细胞的特异性标志物[如α-平滑肌肌动蛋白(α-SMA)、成纤维细胞特异性蛋白1(FSP-1)等]逐渐上调[4]。近期研究认为,包括DLL4/Notch4等在内的Notch信号通路在EndMT过程中发挥着重要作用[5]。其中,Notch4受体主要分布于血管内皮细胞中,DLL4配体作为一种重要的血管生长发育调节因子,也主要在内皮细胞内表达,两者的特异性结合可启动细胞内的信号传导,从而调节血管的发育、成熟及稳定[5-6]。
中医学理论认为,IPF的主要病机为气虚血瘀,益气活血是其基本治法[7]。补阳还五汤出自清代名医王清任的《医林改错》,是益气活血的代表方剂,可有效防治IPF[8]。现代药理研究表明,补阳还五汤能够通过抑制IPF模型大鼠肺组织转化生长因子β1(TGF-β1)、高迁移率族蛋白B1(HMGB1)、α-SMA等的过度表达,降低支气管肺泡灌洗液中炎症因子的含量,减轻肺泡炎症反应,减少肺纤维化瘢痕形成,从而发挥抗肺纤维化作用[9-10]。本课题组前期研究表明,补阳还五汤含药血清可一定程度上抑制人肺动脉内皮细胞的间质转化,这种作用可能与调控Jagged1/Notch1通路的信号传导有关[11]。在此基础上,本研究以EndMT为切入点,进一步探讨了补阳还五汤对IPF模型大鼠肺组织EndMT的影响,并从DLL4/Notch4信号通路出发分析其可能机制,以期为阐明该方剂防治IPF的作用机制提供参考。
1 材料
1.1 仪器
1510型多功能酶标仪(美国Thermo Fisher Scientific公司);ChemiDocTM XRS+型凝胶成像系统、PowerPacTM Basic型电泳仪(美国Bio-Rad公司);BX53型光学显微镜(日本Olympus公司);RM2265型切片机、1150H型包埋机(德国Leica公司);Allegra X-30R型离心机(美国Beckman公司);PL303型电子天平[梅特勒-托利多(上海)仪器公司];WGL-65B型电热鼓风干燥箱(天津市泰斯特仪器有限公司);T10BS25型电动匀浆器(德国IKA公司)。
1.2 药材、药品与试剂
生黄芪(批号:180108,产地:甘肃)、當归(批号:171016,产地:甘肃)、赤芍(批号:161201,产地:甘肃)、地龙(批号:170801,产地:广东)、川芎(批号:170701,产地:四川)、桃仁(批号:171101,产地:山东)、红花(批号:170901,产地:新疆)等饮片均购自贵阳同仁堂药房,经贵州中医药大学药学院孙庆文教授鉴定,分别为豆科植物蒙古黄芪[Astragalus membranaceus(Fisch.)Bge. var. mongholicus(Bge.)Hsiao]的干燥根、伞形科植物当归[Angelica sinensis(Oliv.)Diels]的干燥根、毛茛科植物芍药(Paeonia lactiflora Pall.)的干燥根、钜引科动物参环毛蚓[Pheretima aspergillum(E. Perrier)]的干燥体、伞形科植物川芎(Ligusticum chuanxiong Hort.)的干燥根茎、蔷薇科植物桃[Amygdalus persica(L.)]的干燥成熟种子、菊科植物红花(Chelonopsis tinctorius L.)的干燥花。
醋酸地塞米松片(阳性对照,浙江仙琚制药股份有限公司,批号:151238,规格:0.75 mg);注射用盐酸博来霉素(瀚晖制药有限公司,批号:16032311,规格:1.5万单位);兔源α-SMA抗体(批号:AG02247616)、兔源VE-cadherin抗体(批号:AC03185478)、兔源CD31抗体(批号:AO04265948)、兔源FSP1抗体(批号:AC09223656)均购自北京博奥森生物技术有限公司;兔源Notch4抗体(批号:GR288351-4)、山羊源DLL4抗体(批号:GR162316-12)均购自英国Abcam公司;山羊抗兔辣根过氧化酶(HRP)标记二抗(批号:3825j63)、兔抗山羊HRP标记二抗(批号:34q9532)、山羊抗小鼠HRP标记二抗(批号:1292k61)、小鼠源β-肌动蛋白(β-actin)抗体(批号:48k2671)均购自美国Affinity Biosciences公司;RIPA裂解液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液均购自碧云天生物技术有限公司;0.01 mol/L柠檬酸钠缓冲液(pH 6.0)、牛血清白蛋白、二氨基联苯胺(DAB)显色试剂盒均购自北京索莱宝科技有限公司;BCA蛋白定量试剂盒购自美国Thermo Fisher Scientific公司;ECL发光液、聚偏氟乙烯(PVDF)膜均购自默克密理博(中国)有限公司;其余试剂均为分析纯,水为纯化水。
1.3 动物
SPF级健康SD大鼠48只,雄性,2月龄,体质量180~200 g,购自长沙市天勤生物技术有限公司,动物生产合格证号:SCXK(湘)2014-0011。
2 方法
2.1 补阳还五汤药液的制备
按补阳还五汤的配方比例(生黄芪120 g、当归6 g、赤芍5 g、地龙3 g、川芎3 g、桃仁3 g、红花3 g)称取各饮片适量,用10倍量(mL/g)水浸泡30 min后,文火煎煮2次,每次1 h,合并滤液,减压浓缩,分别制得质量浓度分别为1.5、3、6 g/mL(以生药总质量计)的药液,于4 ℃保存,备用。
2.2 分组、造模与给药
所有大鼠均适应性喂养7 d后,随机分为正常组、模型组、地塞米松组和补阳还五汤低、中、高剂量组,每组8只。除正常组外,其余各组大鼠均于气管内注射博来霉素以复制IPF模型:大鼠腹腔注射10%水合氯醛(3 mL/kg)麻醉后,行颈正中切口,分离、暴露气管,经气管软骨环间隙向心端穿刺,注射博来霉素0.5万单位/kg(以生理盐水为溶剂),随后立即将大鼠直立并旋转,使药液在肺内分布充分、均匀,缝合伤口。正常组大鼠经气管软骨环间隙注入等容生理盐水,其余操作同上。术后,所有大鼠均自由饮水、进食。自造模后第2天起,正常组和模型组大鼠均灌胃水[10 mL/(kg·d)],地塞米松组大鼠灌胃地塞米松0.405 mg/(kg·d)(以水为溶剂,剂量设置参考人等效剂量并按动物体表面积换算而得),补阳还五汤低、中、高剂量组分别灌胃补阳还五汤6.435、12.87、25.74 g/(kg·d)(以生药总质量计,由“2.1”项下药液经水稀释制得;剂量设置参考人等效剂量并按动物体表面积换算而得,其中中剂量与人等效剂量相当,每日1次,连续28 d。
2.3 标本采集
末次给药24 h后,大鼠腹腔注射10%水合氯醛(3 mL/kg)麻醉,于其股动脉放血后剖取两肺,剪除气管、支气管,取左肺组织适量,备用。
2.4 肺组织中内皮细胞、间质细胞标志物表达情况检测
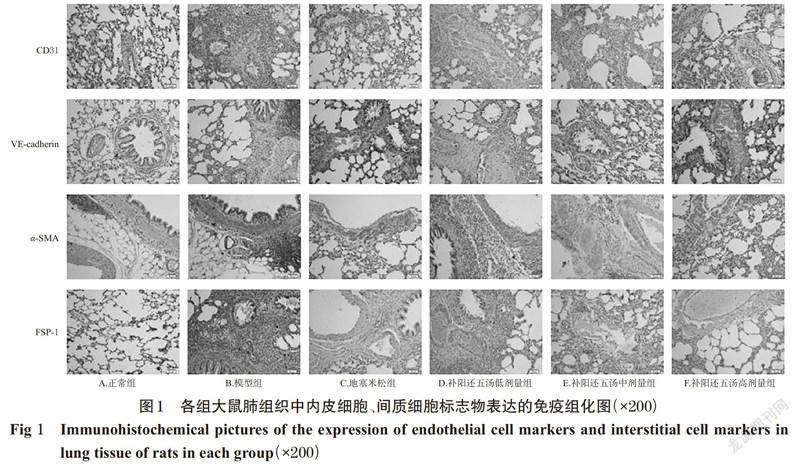
采用免疫组化法检测。取“2.3”项下大鼠肺组织适量,用-20 ℃氯化钠溶液清洗3次,滤纸吸干水分,于4%多聚甲醛溶液中固定48 h后,常规石蜡包埋、切片(厚度约为5 μm),置于60 ℃干燥箱中烘干2 h。切片经二甲苯脱蜡、乙醇梯度脱水后,用3%H2O2溶液室温孵育10~15 min,用磷酸盐缓冲液(PBS,pH 7.2)清洗5 min×3次后,置于0.01 mol/L柠檬酸钠缓冲液中,95 ℃微波加热10 min,进行抗原热修复;冷却至室温,用PBS清洗5 min×3次,用牛血清白蛋白于37 ℃封闭30 min;分别滴加CD31、VE-cadherin、α-SMA、FSP-1一抗(稀释度均为1 ∶ 200),于37 ℃孵育2 h;用PBS清洗5 min×3次,滴加山羊抗兔HRP标记二抗(稀释度为1 ∶ 1 000),室温孵育30 min;用PBS清洗5 min×3次,经DAB显色试剂盒显色后,行常规乙醇梯度脱水、二甲苯透明、树胶封片;在光学显微镜高倍镜视野(×200)下随机选取5个视野观察,采用Image Pro Plus 6.0软件测量并记录每个视野中阳性染色(即染色后呈棕黄色的细胞)的平均光密度值,以此表示相应蛋白的表达水平。
2.5 肺组织中Notch4、DLL4表达情况检测
采用蛋白质印迹法检测。取“2.3”项下大鼠肺组织100 mg,加入4 ℃预冷的RIPA裂解液1 mL,匀浆,于4 ℃下以12 000 r/min离心20 min,收集上清液。采用BCA蛋白定量试剂盒进行蛋白定量,加入等体积2×SDS-PAGE蛋白上样缓冲液后,于95 ℃水浴中变性5 min后,于-80 ℃保存,备测。取上述蛋白适量进行SDS-PAGE电泳(电压:100 V,时间:1.5 h),电泳结束后转移至PVDF膜后,于5%脱脂奶粉中室温振摇封闭1 h;分别加入Notch4、DLL4、β-actin一抗(稀释度分别为 1 ∶ 1 000、1 ∶ 2 500、1 ∶ 5 000),4 ℃孵育过夜,用TBST溶液清洗8 min×3次,分别滴加山羊抗兔HRP;标记二抗、兔抗山羊HRP标记二抗、山羊抗小鼠HRP标记二抗(稀释度均为1 ∶ 10 000),37 ℃孵育1 h;用TBST溶液清洗8 min×3次,经ECL显色后,置于化学凝胶成像系统中显影;采用ImageJ 1.51K软件进行分析,以目的蛋白与内参β-actin的灰度值比值表示相应蛋白的表达水平。
2.6 统计学方法
采用SPSS 21.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,两组间比较采用LSD法。P<0.05为差异有统计学意义。
3 结果
3.1 补阳还五汤对IPF模型大鼠肺组织中内皮细胞、间质细胞标志物表达的影响
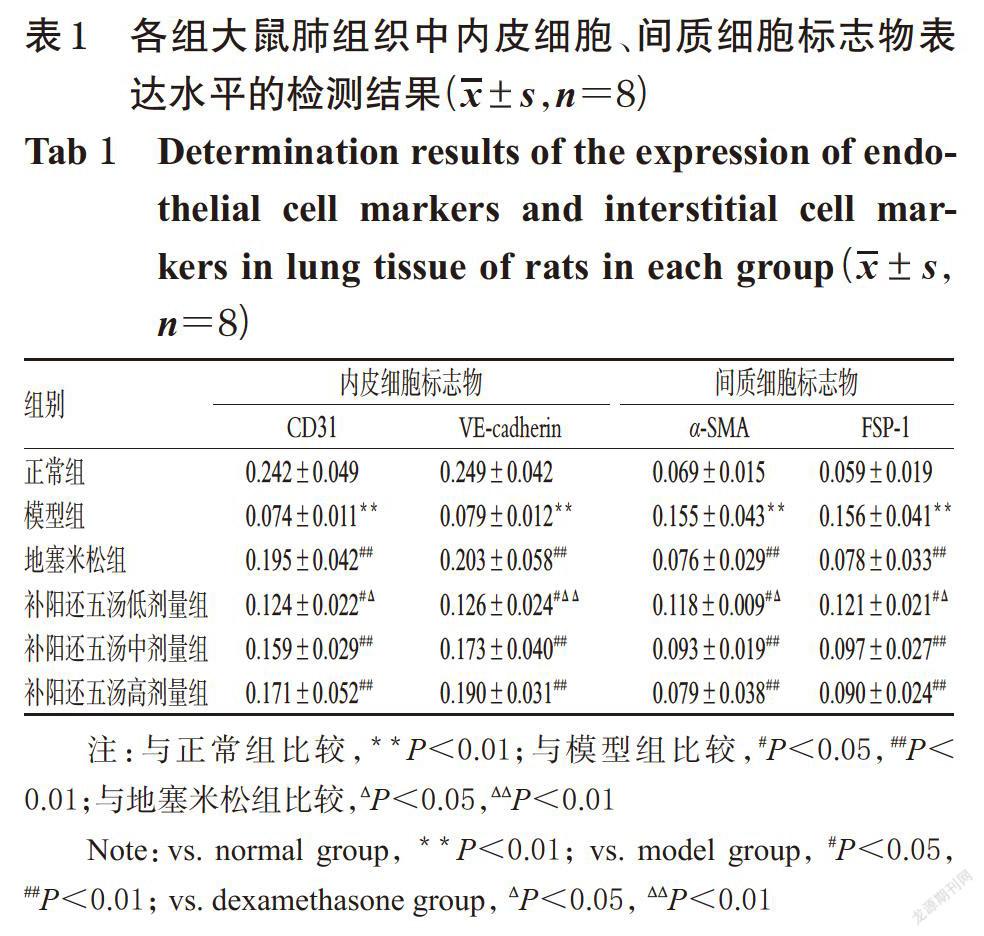
与正常组比较,模型组大鼠肺组织中CD31、VE-cadherin的表达水平均显著降低,α-SMA、FSP-1的表达水平均显著升高,差异均有统计学意义(P<0.01)。与模型组比较,各给药组大鼠肺组织中CD31、VE-cadherin的表达水平均显著升高,α-SMA、FSP-1的表达水平均显著降低;与地塞米松组比较,补阳还五汤低剂量组的CD31、VE-cadherin表达水平均显著降低,α-SMA、FSP-1的表达水平均显著升高,差异均有统计学意义(P<0.05或P<0.01);其余各给药组上述指标组间比较,差异均无统计学意义(P>0.05),详见图1、表1。
3.2 补阳还五汤对IPF模型大鼠肺组织Notch4、DLL4表达的影响
与正常组比较,模型组大鼠肺组织中Notch4、DLL4的表達水平均显著升高,差异均有统计学意义(P<0.01)。各给药组大鼠肺组织中Notch4、DLL4的表达水平均显著低于模型组,补阳还五汤低剂量组上述指标显著高于地塞米松组,差异均有统计学意义(P<0.05或P<0.01);其余各给药组上述指标组间比较,差异均无统计学意义(P>0.05),详见图2、表2。
4 討论
IPF是一种纤维化间质性肺炎,其病因尚未完全明确。该病的临床治疗应分阶段进行,其中轻、中度患者应以口服抗纤维化药物为主;而病情严重者则需进行肺移植,平均存活时间仅为2~5年[12]。
有研究表明,IPF的主要病理改变是肺泡上皮损伤后的异常修复,即肺成纤维细胞的增殖活化和由此而产生的细胞外基质的过度沉积[2]。近来有研究证实,纤维化疾病中活化的肌成纤维细胞的另一个来源是内皮细胞[13]。虽然肌成纤维细胞是纤维化疾病中关键的细胞成分,但有研究指出,从内皮细胞向肌成纤维细胞的转化并不需要完全的转分化即可引发病理性纤维化的发生[14]。在这一过程中,内皮细胞将获得间质细胞表型,继而表达α-SMA、FSP-1等间质细胞标志物,同时CD31、VE-cadherin等内皮细胞标志物表达则明显下调[4,15]。其中,CD31是内皮细胞存在的重要标志,可显示较小的微血管内皮细胞的生成情况[16];VE-cadherin是调节微血管内皮细胞黏附、连接的重要蛋白,当肺纤维化损伤发生时,其可迅速磷酸化,继而引起内皮细胞间黏附作用失调,最终导致微血管屏障受损[17];α-SMA是成纤维细胞的特异性标志物,其表达水平的高低可用以评估肌纤维母细胞的转化程度[18];FSP-1作为肺成纤维细胞的标志物之一,在正常肺组织中表达较少,而在博来霉素诱导的IPF中呈持续升高,可作为研究该病发病机制的指标之一[19]。
Notch信号通路(包括DLL4/Notch4等)是一种高度保守的信号传导途径,参与了肺细胞生物功能的调节,与IPF关系密切,已有证据表明该信号通路可影响内皮细胞的增殖、迁移及分化,在EndMT过程中发挥了重要作用[5-6,20-21]。在TGF-β诱导的人脐静脉内皮细胞转分化中,整合素avβ3可激活Notch信号通路,活化FSP-1编码基因启动子,使其蛋白表达增强,从而使内皮细胞获得平滑肌细胞样的特征,大大增强了细胞的迁移能力;阻断Notch信号通路后,内皮细胞CD31表达下调,α-SMA表达上调,EndMT受到抑制[22-23]。Notch4特异性分布于血管内皮细胞中,为血管内皮细胞的特异性受体,在血管发育的后期参与调节血管的形成,抑制晚期血管的分支发育[24]。DLL4是Notch信号通路的重要配体之一,特异性表达于内皮细胞中,可通过参与动静脉分化、诱导血管尖细胞来控制细胞数目、血管分支数和血管密度,从而在血管构建和稳态维护中发挥重要作用[25]。有研究发现,当大鼠发生IPF时,其体内的DLL4/Notch4信号通路被激活,从而导致肺组织内血管新生和重构明显失控,是IPF发生和进展的重要通路之一[20]。
中医将IPF归于“肺痹”“肺痿”等症范畴。在该病的早期阶段多因外邪阻络、气血凝滞致肺络闭阻,多归于“肺痹”范畴;在该病的后期因出现肺气亏虚、肺脏失去津液濡养致肺叶萎缩,则多归于“肺痿”范畴[26]。补阳还五汤首载于清代的《医林改错》,该方中黄芪益气活血化瘀,为君药;当归活血通络,为臣药;赤芍、桃仁、红花、川芎协同当归活血祛瘀通络,地龙周行全身、通经活络,共为佐药;诸药通补兼用,行益气、活血、通络之效,与IPF核心病机“气虚血瘀,肺络闭阻”一致,符合中医“方-证要素对应”的治疗原则[27]。近年来,补阳还五汤治疗IPF的效果受到临床认可,关于该方药理作用的研究也逐渐深入。现代药理研究表明,补阳还五汤对实验性IPF具有较好的防治作用,可通过改善微循环、抑制过敏介质释放来延缓IPF的进程[28]。为此,本研究以疗效较好的地塞米松[29]为阳性对照,在前期研究的基础上探讨了补阳还五汤对IPF模型大鼠肺组织中内皮细胞、间质细胞标志物表达以及DLL4/Notch4信号通路的影响。
本研究结果显示,模型组大鼠肺组织中CD31、VE-cadherin的表达水平均较正常组显著降低,α-SMA、FSP-1的表达水平均较正常组显著升高,提示模型复制成功。给予不同剂量的补阳还五汤后,各给药组大鼠CD31、VE-cadherin的表达水平均较模型组显著升高,α-SMA、FSP-1的表达水平均显著降低,表明补阳还五汤可不同程度地上调CD31、VE-cadherin的表达,下调α-SMA、FSP-1的表达,提示该方治疗IPF的作用可能与抑制EndMT有关。进一步研究结果显示,模型组大鼠肺组织中Notch4、DLL4的表达水平均显著升高,提示IPF发生后,DLL4/Notch4信号通路被激活,血管内皮细胞分化增多,使得结构及功能完整的血管的形成受到抑制,造成肺纤维化进一步加重。给予不同剂量的补阳还五汤后,大鼠Notch4、DLL4的表达水平均显著降低,提示补阳还五汤治疗IPF的机制可能与抑制DLL4/Notch4信号通路有关。此外,本研究结果还显示,补阳还五汤低剂量组大鼠肺组织中CD31、VE-cadherin的表达水平显著低于地塞米松组,α-SMA、FSP-1、Notch4、DLL4的表达水平均显著高于地塞米松组,而中、高各剂量组与地塞米松组比较差异无统计学意义,提示中、高剂量补阳还五汤对IPF模型大鼠的改善作用与地塞米松相当。
综上所述,补阳还五汤可通过干预EndMT来减轻模型大鼠的IPF,其机制可能与抑制DLL4/Notch4信号通路有关,但其具体靶点和机制有待后续研究进一步确认。
参考文献
[ 1 ] 周瑛,李惠萍. 2018 ATS/ERS/JRS/ALAT特发性肺纤维化诊断指南解读[J].同济大学学报(医学版),2018,39(6):30-33.
[ 2 ] RICHELDI L,COLLARD HR,JONES MG. Idiopathic pulmonary fibrosis[J]. Lancet,2017,389(10082):1941- 1952.
[ 3 ] PIERA-VELAZQUEZ S,LI Z,JIMENEZ SA. Role of endothelial-mesenchymal transition(EndMT)in the pathogenesis of fibrotic disorders[J]. Am J Pathol,2011,179(3):1074-1080.
[ 4 ] 何光庭,吴洁,黄巧冰.内皮细胞间质转化的信号调节和生物学意义[J].中国循环杂志,2016,31(6):622-624.
[ 5 ] POST LC,TERNET M,HOGAN BL. Notch/Delta expression in the developing mouse lung[J]. Mech Dev,2000,98(1):95-98.
[ 6 ] CLAXTON S,FRUTTIGER M. Periodic Delta-like 4 expression in developing retinal arteries[J]. Gene Expr Patterns,2004,5(1):123-127.
[ 7 ] 陈炜,胡梦娟.中医药干预特发性肺纤维化血管新生相关通路研究进展[J].辽宁中医药大学学报,2018,20(10):19-22.
[ 8 ] 魏莱,王泽玉.补阳还五汤防治特发性肺纤维化的研究进展[J].中国老年学杂志,2019,39(5):1252-1256.
[ 9 ] 杨晗,王飞,王全林,等.补阳还五汤对肺纤维化大鼠肺组织TGF-β1/Smad3表达的影响[J].中国实验方剂学杂志,2013,19(24):240-244.
[10] 杨昆.补阳还五汤对博来霉素所致大鼠特发性肺纤维化的保护作用及机制研究[D].成都:成都中医药大学,2016.
[11] 渠景连,杨邯捷,赵惠亮.补阳还五汤含药血清对人肺动脉内皮细胞间质转化的影响[J].中国实验方剂学杂志,2019,25(19):1-9.
[12] XAUBET A,ANCOCHEA J,MOLINA-MOLINA M. Idiopathic pulmonary fibrosis[J]. Med Clin:Barc,2017,148(4):170-175.
[13] KARASEK MA. Does transformation of microvascular endothelial cells into myofibroblasts play a key role in the etiology and pathology of fibrotic disease? [J]. Med Hypotheses,2007,68(3):650-655.
[14] MOORE-MORRIS T,GUIMARÃES-CAMBOA N,BANERJEE I,et al. Resident fibroblast lineages mediate pressure overload-induced cardiac fibrosis[J]. J Clin Invest,2014,124(7):2921-2934.
[15] PARDALI E,SANCHEZ-DUFFHUES G,GOMEZ-PUERTO MC,et al. TGF-β-induced endothelial-mesenchymal transition in fibrotic diseases[J]. Int J Mol Sci,2017. DOI:10.3390/ijms18102157.
[16] 王桂.丹贝益肺颗粒对特发性肺纤维化大鼠CD31和CD34蛋白表达水平的影响[D].哈尔滨:黑龙江省中医药科学院,2018.
[17] 曹芳,李海涛,王明明.大黄酸对油酸所致急性肺损伤大鼠治疗作用及其对肺部微血管屏障与炎症反应的影响[J].贵州医药,2018,42(8):917-921.
[18] 黄彦铭.补阳还五汤对肺纤维化大鼠肺泡灌洗液中HMGB1、IL-8、α-SMA水平影响的实验研究[D].成都:成都中医药大学,2015.
[19] LAWSON WE,POLOSUKHIN VV,ZOIA O,et al. Cha- racterization of fibroblast-specific protein 1 in pulmonary fibrosis[J]. Am J Respir Crit Care Med,2005,171(8):899-907.
[20] 渠景连.养肺通络法干预Notch信号通路防治肺纤维化的机制研究[D].南京:南京中医药大学,2015.
[21] 刘晓夏.Dll4/Notch4-ephrin-B2调控血管内皮祖细胞改善胎盘血管内皮损伤的研究[D].武汉:华中科技大学,2017.
[22] WANG W,WANG Z,TIAN D,et al. Integrin β3 mediates the endothelial-to-mesenchymal transition via the Notch pathway[J]. Cell Physiol Biochem,2018. DOI:10.1159/000493229.
[23] TIAN D,ZENG X,WANG W,et al. Protective effect of rapamycin on endothelial-to-mesenchymal transition in HUVECs through the Notch signaling pathway[J]. Vascul Pharmacol,2019. DOI:10.1016/j.vph.2018.10.004.
[24] WANG Y,YANG R,WANG X,et al. Evaluation of the correlation of vasculogenic mimicry,Notch4,DLL4,and KAI1/CD82 in the prediction of metastasis and prognosis in non-small cell lung cancer[J]. Medicine:Baltimore,2018. DOI:10.1097/MD.0000000000013817.
[25] 縱单单,陈平,陈燕. Notch信号通路在血管生成中的作用研究进展[J].国际呼吸杂志,2012,32(4):299-303.
[26] 王国琛,刘江彦.特发性肺纤维化中医研究进展[J].吉林中医药,2018,38(2):243-245.
[27] 张川锋,王振兴,杨昆,等.依据“方-证要素对应”分析补阳还五汤治疗肺纤维化疾病机制[J].时珍国医国药,2018,29(6):1406-1408.
[28] 杨昆,李勇华,王飞,等.补阳还五汤防治特发性肺纤维化的作用及机制探讨[J].北京中医药大学学报,2017,40(7):550-557.
[29] 崔兰凤.中药治疗特发性肺纤维化随机对照试验的系统综述和Meta分析[D].北京:北京中医药大学,2017.
(收稿日期:2019-01-18 修回日期:2019-07-12)
(编辑:张元媛)
