磁共振成像在喉癌和下咽癌放化疗评价中的应用
2019-09-09杨玲刘杰
杨玲 刘杰


[摘要]目的:探讨磁共振成像(MRI)在喉癌和下咽癌放化疗评价中的应用价值,为喉癌和下咽癌放化疗效果评价提供新的思路。方法:收集经病理证实的喉癌及下咽癌109例初治患者纳入此次前瞻性研究。患者均于我院接受放化疗综合治疗,分别于治疗前、治疗后行磁共振检查,记录其扩散加权成像(DWI)半定量参数,以及MR动态多期增强扫描(DCE-MRI)定量参数,比较完全缓解(CR)者与非CR者上述参数差异,运用受试者工作特征曲线(ROC),计算各项参数预测喉癌和下咽癌放化疗效果的价值。结果:109例患者均顺利完成治疗,治疗结束后,CR48例,PR61例,CR率为44.04%。CR组治疗前ADCmean、ADCmax低于非CR组,两组患者治疗后ADCmean均较治疗前上升,CR组治疗后ADCmean高于非CR组,差异有统计学意义(P<0.05)。CR组治疗前Kep高于非CR组,两组患者治疗后Kep均下降,Ve均上升,CR组治疗后Ktrans下降,非CR组治疗后Ktrans上升,差异有统计学意义(P<0.05)。以治疗前ADCmean≤1.06预测CR的ROC曲线下面积为0.642(灵敏度为91.57%、特异性为54.88%),以治疗前Kep≥1.105min预测CR的曲线下面积为0.581(灵敏度为93.65%、特异性为51.62%)。结论:治疗前DWI半定量参数及DCE-MRI定量参数均可为喉癌和下咽癌患者放化疗效果的预测提供一定参考,值得进一步关注。
[关键词]磁共振成像;喉癌;下咽癌;放化疗;评价
中图分类号:R739.63
文献标识码:A
文章编号:2095-5200(2019)02-001-05
DOI:10.11876/mimt201902001
喉癌和下咽癌为头颈部常见恶性肿瘤,以鳞状细胞癌为主,具有恶性程度高、侵袭能力强的特点,且早期临床症状不明显,多数患者确诊时已进展至中晚期,加之喉全切术对患者生活质量的严重影响,以放化疗为主的综合方案已成为喉癌和下咽癌临床治疗首选对策。而如何早期预测、评估喉癌和下咽癌对放化疗的反应,则是指导个体化治疗方案制定与调整的关键环节。大量研究显示,磁共振成像(MRI)能够为多种肿瘤的鉴别诊断与疗效判断提供可靠参考月。在既往文献报道基础上,此次研究选择扩散加权成像(DWI)半定量参数与MR动态多期增强扫描(DCE-MRI)定量参数预测喉癌和下咽癌放化疗效果,观察其应用的价值。
1对象与方法
1.1研究对象
2015年8月至2017年10月选取拟于我院接受放化疗综合治疗的喉癌和下咽癌患者开展前瞻性研究。患者均经鼻咽镜或喉镜下活检明确诊断,病理分型均为鳞状细胞癌;既往无喉癌和下咽癌治疗史。最终共109例患者进行了治疗前MRI检查。109例患者中,男91例,女18例,年齡41~79岁,平均(57.62+8.95)岁;病灶部位:喉癌39例,下咽癌70例;临床分期:T2期13例,T;期41例,T4期55例。本研究已征得我院医学伦理委员会批准,患者及家属均知情同意并签署书面协议。
1.2治疗方案
患者均接受放化疗综合治疗。先行诱导化疗,选用TP(多西他赛+顺铂)方案,多西他赛70mg/m2静脉滴注,dl;顺铂40mg/m2静脉滴注,d1~d2,每21d为1周期,持续2周期后行根治性放疗。放射源为6-MVX射线,总剂量为PGTVp、GTVnd69.96Gy,分33次照射,每周5次,每次放疗剂量2.12Gy,共持续7周4。于放疗开始约1周后行顺铂同步化疗,累积同步化疗剂量240~300mg,化疗周期2~3周;于放疗开始约2周后行希美纳增敏治疗。
1.3检查方法
1.3.1扫描参数于治疗前、治疗结束后1周内,分别行常规平扫、DWI扫描、DCE-MRI扫描及延迟增强扫描51。扫描参数:1)常规平扫:T1WI:TR660ms,TE9.3ms,信号平均次数2,带宽31.25,层厚5mm,层间距0.5mm,ETL6,横轴面视野24cm,矩阵288x224;横断位T2WI及T2WI预饱和脂肪抑制图像:TR5760ms,TE88.3ms,信号平均次数2次,带宽31.25,层厚5mm,层间距0.5mm,回波链长21,横轴面视野24cm,矩阵288x224。2)DWI:扫描层面与常规平扫相同,选取单次激发SE一EPI序列,TR4800ms,TE68.4ms,层厚5mm,层间距0.5mm,横轴面视野24cm,信号平均次数6次,矩阵96x128,b值选择500s/mm2,采集方向:层面选择、频率编码、相位编码。3)DCE-MRI:经肘静脉高压注人轧喷酸葡胺,剂量0.2mL/kg,注射速率2.0mL/s,以20mL0.9%氯化钠溶液注人,采用三维容积扰相梯度回波序列行横断位扫描,每期14s,共20期,TR3.3ms,TE1.5ms,翻转角15°,信号平均次数0.69次,带宽62.5,层厚3mm,层间距0,横轴面视野26cm,扫描矩阵160x160。4)延迟增强扫描:行横断位、冠状位、矢状位T1WI序列延迟增强扫描,TR275ms,TE4.2ms,信号平均次数2,带宽31.25,层厚5mm,层间距0.5mm,回波链长2,横轴面视野24cm,矩阵288x224。1.3.2图像分析DWI半定量参数:于横断面勾画肿瘤最大横截面积作为感兴趣区(ROI)-1,ROI-1面积需≥30mm',并避开出血、坏死区域。ROI-2为最小表观扩散系数(ADCmin)对应的ROI,即肿瘤最大横截面ADC伪彩图上ROI-1内扩散受限最明显的区域,ROI-2面积需≥10mm',并避开出血、坏死区域间。使用Funtool软件获取肿瘤平均ADC值(ADCmean)、最大ADC值(ADCmax)及最小ADC值(ADCmin)。
DCE-MRI定量参数:使用GenIQ软件及3DSynchroView软件获取DCE-MRI定量参数,包括容量转移常数(Ktrans)、速率常数(Kep)及细胞外f血管外间隙容积比(Ve),三项参数的计算关系为07:Kep=Ktrans/Ne。
1.4分析方法
1.4.1分组方法参照实体瘤疗效评价标准(RECIST)(8),对患者治疗结束后临床疗效进行评价,完全缓解(CR):所有目标病灶消失;部分缓解(PR):基线病灶长径总和缩小≥30%;稳定(SD):基线病灶长径总和缩小<30%或增加<20%;进展(PD):基线病灶长径总和增加≥20%。此外,结合喉镜检查结果,将喉镜未见明显肿物、MRI图像显示肿物完全消退且RECIST判定为CR者纳入CR组,将其他患者纳入非CR组。对比两组患者DWI半定量参数及DCE-MRI定量参数,并运用受试者工作特征曲线(ROC),计算各项参数预测喉癌和下咽癌放化疗效果的价值。
1.4.2统计学分析对本临床研究的所有数据采用SAS9.4进行分析,DWI半定量参数、DCE-MRI定量参数等计量资料以(x+s)表示,并采用t检验,以P<0.05为差异有统计学意义。
2结果
2.1临床疗效
109例患者均顺利完成治疗,治疗结束后,48例患者经喉镜、MRI检查,纳人CR组。CR48例,PR61例,CR率为44.04%。
2.2DWI半定量参数
CR组治疗前ADCmean、ADCmax低于非CR组,两组患者治疗后ADCmean均较治疗前上升,CR组治疗后ADCmean高于非CR组,差异有统计学意义(P<0.05)。见表1。
2.3DCE-MRI定量参数
CR组治疗前Kep高于非CR组,两组患者治疗后Kep均下降,Ve均上升,CR组治疗后Ktrans下降,非CR组治疗后Ktrans上升,差异有统计学意义(P<0.05)。见表2。
2.4评价效能分析
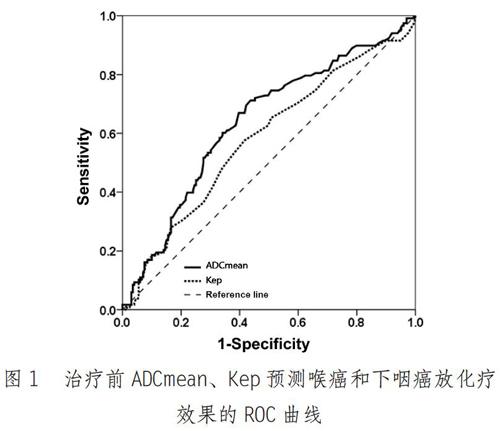
ROC曲线如图1所示,以治疗前ADCmean≤1.06预测CR的曲线下面积为0.642(灵敏度为91.57%、特异性为54.88%),以治疗前Kep≥1.105min预测CR的曲线下面积为0.581(灵敏度为93.65%、特异性为51.62%)。
3讨论
放化疗是目前临床治疗喉癌和下咽癌的主要手段,既往研究显示,非手术放化疗综合治疗能够在一定程度上提高患者喉部功能保全率,并达到降低肿瘤局部复发风险、确保肿瘤局部控制率及患者生存率的目的9。喉部、下咽部主要由喉软骨、喉内肌、疏松结缔组织组成,不同组织结构T1、T2弛豫存在明显差别,为MRI显示软组织结构奠定了良好的基础。
DWI是当前评价活體水分子微观扩散运动功能成像的唯一方法,ADC值的差异能够为病变性质的判断提供可靠参考:恶性肿瘤细胞繁殖旺盛,细胞密度较高、排列紧密且细胞核/质比高,加之间质成分偏少、细胞外间隙较小,以及细胞生物膜限制和大分子物质对水分子的吸附作用增强,均造成恶性肿瘤内水分子扩散运动抑制,并表现为ADC值下降(01。本研究CR组与非CR组治疗前ADCmean均较低,也证实了,上述结论。同时,与CR组相比,非CR组治疗前ADCmean较高,但其治疗后ADCmean低于CR组,说明治疗后恶性肿瘤细胞结构破坏多,ADCmean上升较多的可在放化疗中获益更多,本研究ROC曲线分析结果得出,以治疗前ADCmean≤1.06预测CR的曲线下面积为0.642,进一步显现出ADCmean为喉癌和下咽癌放化疗效果预测提供的可靠参考。
DCE-MRI主要借助血管内外以及血浆与细胞外间隙对比度浓度的差异,通过肿瘤强化方式及程度的判断,了解肿瘤组织的血管类型和数量变化12。DCE-MRI的各项参数中,Ktrans主要反映对比剂由血浆分布至血管外细胞外间隙(ESS)的速率,Kep与扩散至ESS的对比剂返回血浆的速率有关,Ve是反映单位容积组织内ESS容积的参数131。本研究CR组治疗前Ktrans、Kep高于非CR组,其Ve偏低,说明肿瘤容量转移常数和速率常数越高,肿瘤血浆与ESS血流交换量越丰富,其含氧量较高,对放疗的反应也更为敏感(1s]。与治疗前相比,CR组Ktrans、Kep均值下降,Ve均值上升,说明放化疗对肿瘤微循环的破坏引发了血管通透性和血管外细胞容积的改变[16。CR组与非CR组治疗前后Ktrans、Ve比较均未见明显差异,考虑与放疗50Gy时多数患者已达CR或接近CR有关[7-18],在今后的临床研究中,进一步提前DCE-MRI检查时间点,可能能够得到更有参考价值的研究结果19。总体而言,本研究也已证实治疗前Kep预测喉癌和下咽癌放化疗效果的参考价值,并为临床肿瘤放疗疗效的早期评估和个体化治疗方案的制定提供了一定参考。
综上所述,磁共振成像能够为喉癌和下咽癌患者放化疗效果的评价提供一定参考:DWI检查中,治疗前后ADCmean差值大意味着更为理想的放化疗治疗效果;DCE-MRI检查中,较高的Kep也往往伴随着更高的放化疗敏感性,患者更易在放化疗治疗中获益。
参考文献
[1] LIN P, HUANG X, ZHENG C, et al. The predictivevalue of MRI in detecting thyroid gland invasion inpatients with advanced laryngeal or hypopharyngealcarcinoma[J]. Eur Arch Otorhinolaryngol, 2017, 274(1):361-366.
[2] JAGER E A,LIGTENBERG H, CALDAS-MAGALHAES J, et al. Validated guidelines for tumordelineation on magnetic resonance imaging for laryngealand hypopharyngeal cancer[J]. Acta Oncol, 2016, 511):1305-1312.
[3] GUO W, LUO D, CHEN X, et al. Dynamic contrast-enhanced magnetic resonance imaging for pretreatmentprediction of early chemo-radiotherapy response inlarynx and hypopharynx carcinoma[J]. Oncotarget, 2017,8(20): 33836.
[4]ZHANGSC,ZHOUSH,SHANGDS,etal.Thediagnostic role of diffusion-weighted magnetic resonanceimaging in hypopharyngeal carcinoma[J]. Oncol Lett,2018, 15(4): 5533-5544.
[5]李依霞,马露,崔园园,等.非手术喉癌、下咽癌患者放化疗前后MRI检查的应用价值[J].中国癌症防治杂志,2015, 7(3): 157-161
[6] JAGER E A, KASPERTS N, CALDAS-MAGALHAESJ, et al. GTV delineation in supraglottic laryngealcarcinoma: interobserver agreement of CT versus CT-MR delineation[J]. Radiat Oncol, 2015, 10(1): 26.
[7] JULIANO A, MOONIS G. Computed TomographyVersus Magnetic Resonance in Head and NeckCancer: When to Use What and Image OptimizationStrategies[J]. Magn Reson Imaging Clin, 2018, 26(1): 63-84.
[8] BONNER J, GIRALT J, HARARI P, et al. Cetuximaband radiotherapy in laryngeal preservation for cancersof the larynx and hypopharynx: a secondary analysis ofa randomized clinical trial[J]. JAMA Otolaryngol HeadNeck Surg, 2016, 142(9): 842-849.
[9] RAZEK A A K A, NADA N. Correlation of choline/creatine and apparent diffusion coefficient values withthe prognostic parameters of head and neck squamouscell carcinoma[J]. NMR Biomed, 2016, 29(4): 483-489.
[10]李依霞,崔园园,崔豹,等.扩散加权成像对非手术喉癌和下咽癌患者同步放化疗前后的疗效评价[J].磁共振成像,2016,7(3):185-190.
[11] SU X, HE C, TANG T, et al. Sequential four-drugchemotherapy and intensity- modulated radiotherapy forlarynx preservation in resectable advanced larynx andhypopharynx cancer: A pilot study[J]. Am J Otolaryngol,2017, 38(1): 52-56.
[12]梁玲艳.MRI评估喉癌及下咽癌术前分期的价值[D].南宁:广西医科大学,2015.
[13] RAVANELLI M, AGAZZI G M, FARINA D, et al. NewDevelopments in Imaging of Laryngeal Cancer[J]. CurrOtorhinolaryngol Rep, 2017, 5(1): 49-55.
[14] JAGER E A, WILLEMS S M, SCHAKEL T, etal. Interobserver variation among pathologists fordelineation of tumor on H& E-sections of laryngealand hypopharyngeal carcinoma. How good is the goldstandard?[J]. Acta Oncol, 2016, 55(3): 391-395.
[15] YUAN J, LO G, KING A D. Functional magneticresonance imaging techniques and their development forradiation therapy planning and monitoring in the headand neck cancers[J]. Quant Imaging Med Surg, 2016,6(4): 430.
[16]孟祥水,柴相君,任庆国,等.MR灌注成像对喉癌和下咽癌术后放疗后并发症及肿瘤复发的诊断价值[J].中华放射学杂志,2016,50(10):758-761.
[17] WANG Y, LI D, LIU R, et al. Application of Ultrasound-guided Core Needle Biopsy in the Diagnosis of T3 orT4 Stage Laryngeal and Hypopharyngeal Cancer[J]. Anticancer Res, 2017, 37(8): 4563-4567.
[18] WONG W, FISCHER S, CRUICKSHANK H E. Resectionof the submandibular gland is generally undertaken asan integral component of level I neck dissection for oralcancer. However, it is unclear whether lymph nodesare present within the submandibular gland which mayform the basis of lymphatic spread. Our purpose wasto investigate the frequency of lymph nodes within thesubmandibular gland, and the incidence and mechanismof submandibular[J]. Eur Arch Otorhinolaryngol, 2017,274(1): 461-466.
[19]陳薪伊.MRI功能成像对喉癌和下咽癌同步放化疗的应用研究[D].北京:北京协和医学院,2014.
