新型遗传标记DIP-STR多重复合扩增体系的构建
2019-09-09郑文彦王致远罗高司梁桑华黄源坚
郑文彦,王致远,罗高司,符 晶,梁桑华,黄源坚,钱 水*
(1.广东华美众源生物科技有限公司,广东佛山528000;2.佛山市公安司法鉴定中心,广东佛山528000)
在法医物证学领域,微量DNA及混合DNA的检测一直是现场案件检测的重点与难点。随着DNA检测技术的发展,许多微量接触类生物检材通过STR、SNP等遗传标记可以获得稳定可靠的DNA分型[1]。但是对于主次成分差异比较大的混合样本,常规法医DNA检测方法只能提供非常有限的分型结果[2-3]。
为了克服这一难题,Castella V等[4]在2011年率先提出了一种由插入-缺失多态性(Deletion/Insertion Polymorphisms,DIP)和短串联重复序列多态性(Short Tandem Repeat,STR)两种遗传标记串联组合在一起形成的新型复合遗传标记DIP-STR。该遗传标记是STR序列上/下游500 bp范围内存在DIP位点,根据DIP位点的插入或缺失状态分别设计特异性引物,利用DIP双等位基因特异分型的优势,结合STR的多态性优势,能够在极不平衡的双源DNA混合物中检测出次要成分,同时保留了由连锁的多等位基因提供的强大识别能力[5]。
目前,国外已有利用DIP-STR标记检测不均衡样本的体系建立及案件应用的报道。Castella V等[4]建立了由7个DIP-STR位点组成的复合扩增体系。此后该团队陆续报道了经过改良的DIP-STR复合扩增体系及该体系在8宗案件上的应用[6-7],显示出DIP-STR遗传标记能够补充样本的分型结果或为调查提供新线索的作用。而国内针对DIP-STR遗传标记的研究起步晚、成果少,其中Tan Y等[8]在2017年选取了6个DIP-STR基因座对西南汉族人群的不平衡样本进行了研究。
综合上述情况,本研究在UCSC及NCBI数据库中查找、筛选了8个适合法医DNA检验的DIPSTR组合遗传标记,设计特异性扩增引物,构建复合扩增体系,设计分析方法,通过模拟样本评估验证其法医效能,从而建立一种同时检测人常染色体DIP和STR基因座的方法,为案件现场微量物证检验中不均衡混合样本的DNA检测提供有效的辅助方法。
1 材料与方法
1.1 主要试剂和仪器
扩增目的DIP-STR位点的引物由生工生物工程(上海)股份有限公司合成。其他试剂主要包括PCR master mix和热启动C-Taq酶均购自无锡中德美联生物技术有限公司。标准对照DNA 9948购自美国Promega公司。
样本采用Mastercycler®nexus PCR仪(Eppendorf公司,德国)进行扩增,产物用3130XL型遗传分析仪(ABI公司,美国)进行电泳检测。
1.2 方法
1.2.1 引物设计及标记
通过NCBI和UCSC查找筛选及参考相关文献,最终选定8个DIP-STR基因座。筛选参数包括:DIP位点插入/缺失片段大小为3~10 bp,STR基因座核心序列为3~5碱基,DIP与STR间距小于250 bp,DIP-STR片段大小在500 bp以内。对每个基因座分别设计两条带有不同荧光的用于识别DIP位点缺失(S)/插入(L)分型的上游引物及一条普通公共下游引物,其中rs35032587-STR、rs60194384-STR、rs72406828-STR和rs2308142-STR的S上游引物为FAM标记,L上游引物为HEX标记;rs34212659-STR、rs146332920-STR、rs145423446-STR和rs111478323-STR的S上游引物为TAMRA标记,L上游引物为ROX标记。DIP-STR基因座信息如表1所示,扩增产物排布图如图1所示。
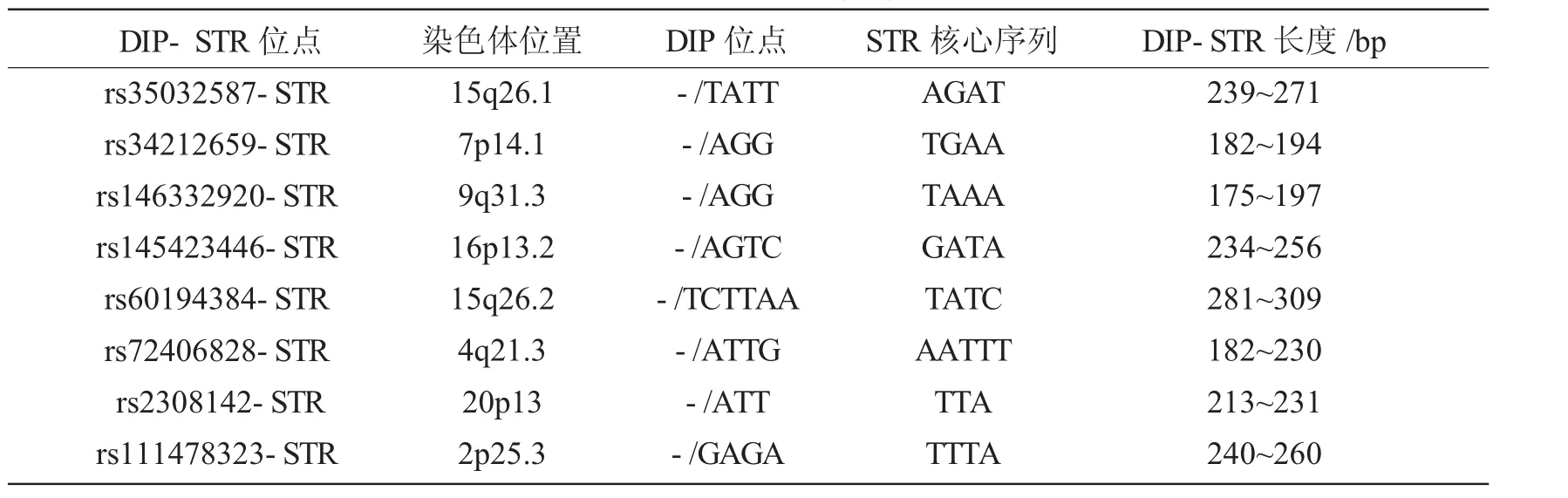
表1 DIP-STR基因座信息
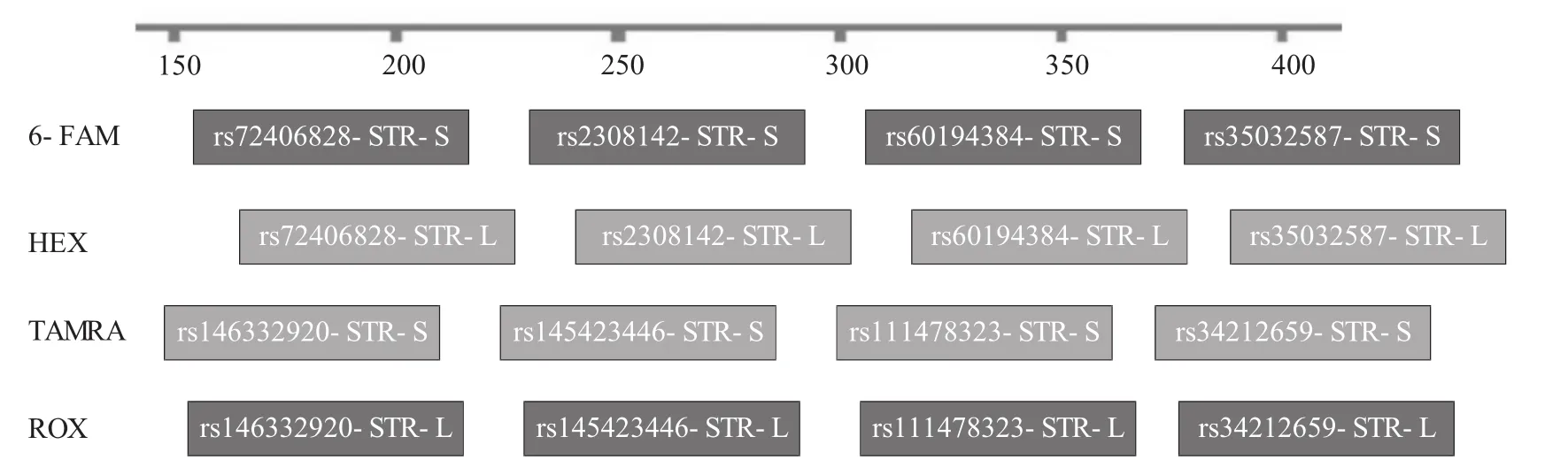
图1 DIP-STR扩增产物排布图
1.2.2 复合扩增体系的建立
DIP-STR复合扩增检测体系采用25 μL标准反应体系设置,其中含有12.5 μL Reaction Mix(各组分终浓度为 50 mmol/L KCl、10 mmol/L Tris-HCl、2.5 mmol/L MgCl2、0.25 mmol/L dNTP Mix),5 μL 混合引物以及1 μL热启动C-Taq酶(5 U/μL),加入1片1.2 mm人血斑样本或0.5~2.0 ng提取的人基因组DNA,加水补足至25 μL,充分混匀后短暂离心。体系内混合引物终浓度如表2所示。
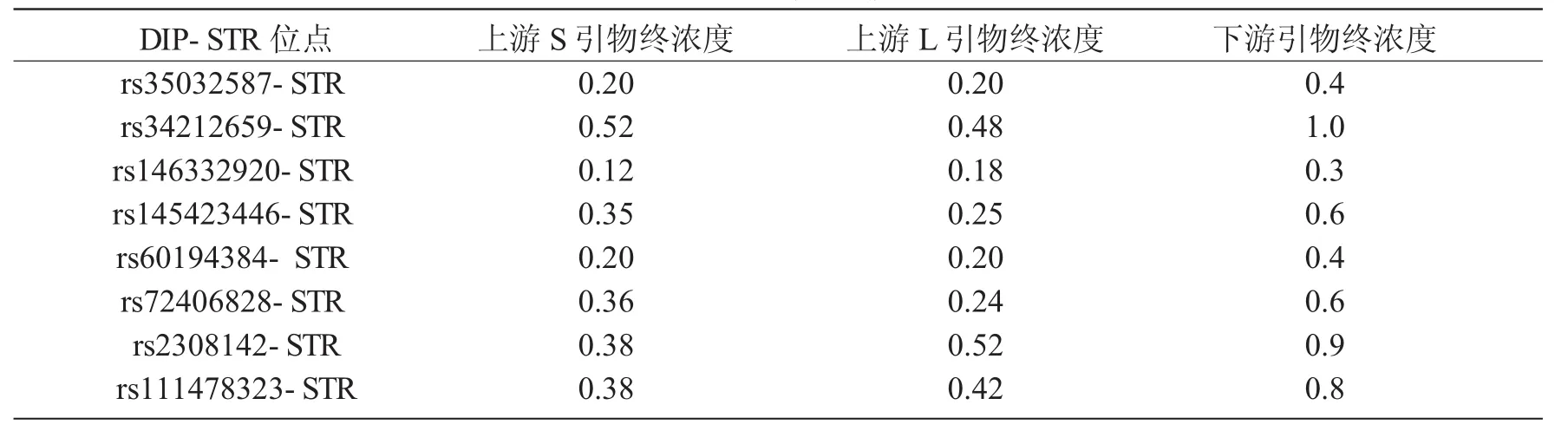
表2 引物终浓度 μM
1.2.3 聚合酶链式反应
95℃预变性2 min;94℃变性30 s,60℃退火45 s,72℃延伸45 s,共10个循环;90℃变性30 s,60℃退火45 s,72℃延伸60 s,共20个循环;最后72℃延伸10 min。
1.2.4 毛细管电泳检测
将12 μL去离子甲酰胺与0.5 μL分子量内标Marker SIZ-500(无锡中德美联有限公司,中国)混合。再加入1 μL PCR反应产物,涡旋混匀,3 500 r/min离心2 min,95℃变性3 min,冰浴3 min,用ABI3130XL遗传分析仪进行毛细管电泳。运用Gene Mapper®IDX(ABI公司,美国)软件结合产物排布设置对DIP-STR位点分型结果进行分析。
2 结果
2.1 复合扩增体系测试
选取两个样本的基因组DNA作为模板,按上述建立体系进行复合扩增及毛细管电泳,结果如图2、3所示。以样本1的rs72406828-STR位点为例(见图2),电泳图显示该位点在FAM和HEX各出一峰,分型为S9/L8,表明此位点的DIP分型是缺失(S)+插入(L),S型DIP位点后接9重复STR,L型DIP位点后接8重复STR。又以样本2的rs146332920-STR位点为例(见图3),电泳图显示该位点在ROX出2个峰,而TAMRA不出峰,分型为L13/L14,表明该位点的DIP分型是插入(L)+插入(L),L型DIP位点后分别接13和14重复的STR。
实验结果显示,该复合扩增体系扩增单一成分样本时能获得清晰准确的分型,且基因座间具有较好的均衡性。

图2 样本1 分型图

图3 样本2分型图
2.2 不均衡混合样本测试
采用前述复合扩增体系,模拟法医物证现场不均衡混合样本进行扩增测试。对两份实际提取样本标准品(女性样本与男性样本各一份),按一定比例混合模拟不同比例的男女混合斑,以此作为扩增模板进行复合扩增及毛细管电泳检测。样本混合比例分别为 1:10、1:25、1:50、1:100;10:1、25:1、50:1、100:1。
测试结果显示,当样本主次成分比值在50:1以内时,本方法能够获得较好的分型效果。当两种成分样本的DIP-STR位点没有相同的分型时,可准确得出两种样本各自的分型(见图4~5),其中图4样本分型分别为S7/S11与L12,图5样本分型分别为L12与S11/L13;但是若混合样本两者的DIP-STR位点存在分型重合,且没有其中一个样本的单独分型辅助拆分,则存在无法分辩出两者分型的可能(见图6)。在能够获得其中一个样本的分型时,才能对混合样本进行拆分。
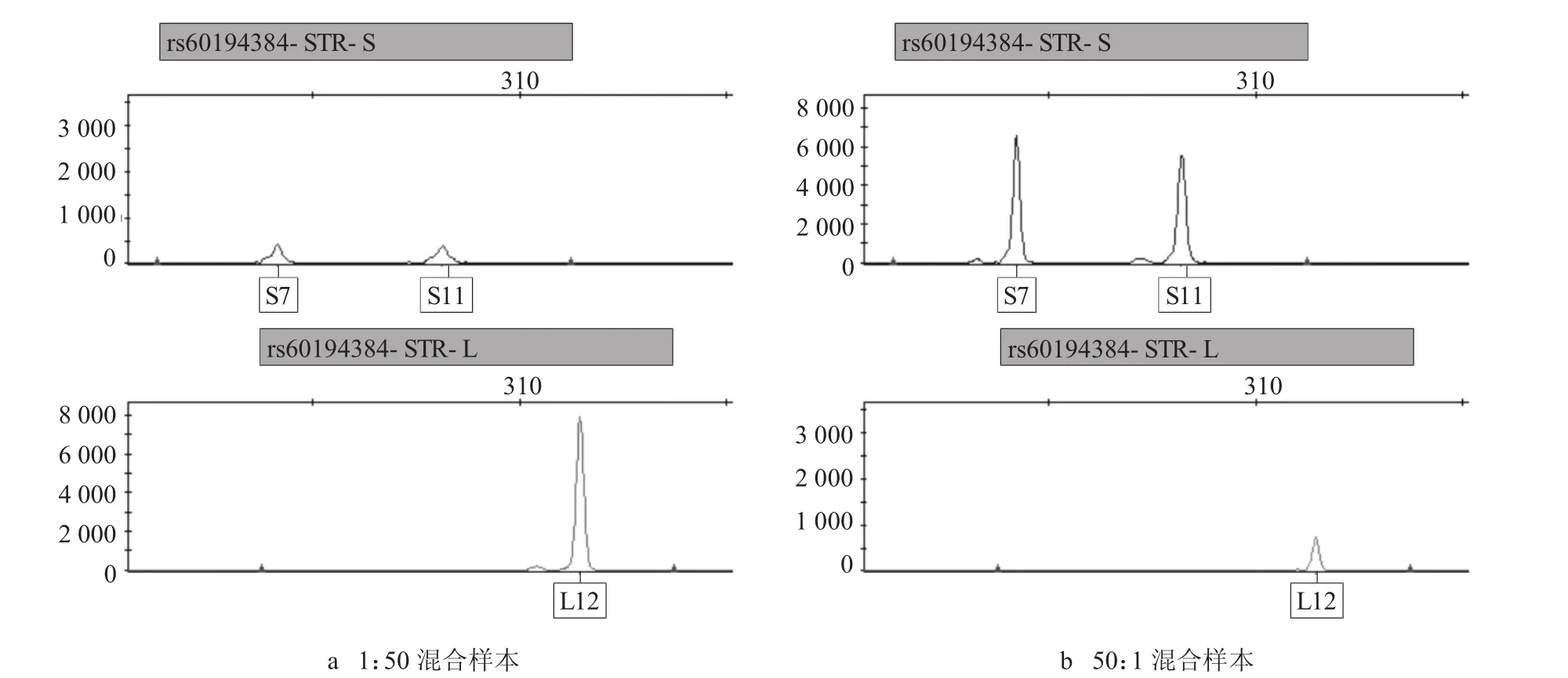
图4 混合样本的rs60194384-STR位点分型图
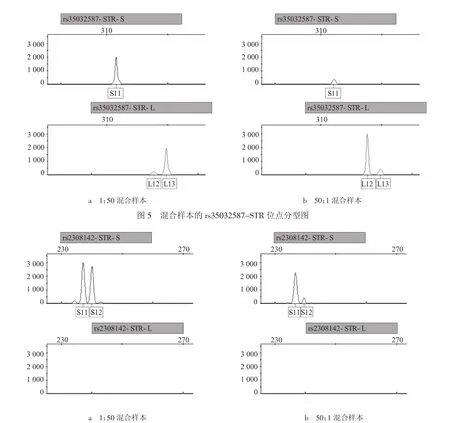
图6 混合样本的rs2308142-STR位点分型图
3 讨论
DIP-STR是基因组中两种遗传标记的串联组合,它既有STR高多态性的优势,又有DIP双等位基因特异分型的特点。与传统STR标记相比,DIP-STR检测不均衡样本的优势在于:1)当主次成分STR分型一致时,可以通过DIP位点加以区分;2)能够避免将主成分的stutter峰与次成分的主峰混淆的情况发生;3)可以对主次比例更悬殊的不均衡样本进行分型[8]。
本研究通过设计针对DIP位点插入或缺失的特异性上游引物及公共下游引物,运用聚合酶链式反应及毛细管电泳,建立了能够单管同时扩增8个DIP-STR基因座的复合扩增体系。测试结果显示,在检测主次成分相差50倍以内的不均衡样本时能获得较好的分型结果。此方法的建立,为法医现场混合样本的检测提供了新思路。
然而,DIP-STR遗传标记在用作法医DNA检测的方法时仍存在一些不足之处。由于结合了两种遗传标记,每个位点所需的分型位置增加了一倍,导致一个复合扩增里能够包含的基因座比STR要少,位点数量有限制。再者,当混合样本中不同个体的DIP-STR位点分型出现重叠时,仍然存在无法区分混合成分的可能。因此,在未来的研究中,需要对这些不足进行改进,让DIP-STR遗传标记在现场物证检验的应用更具优势、更有效。
