斑马鱼PKR的dsRBM1和dsRBM3重组及体外功能分析
2019-09-09柳铭山周细根欧湘滢高宗泽李婷婷胡有生
柳铭山,周细根,欧湘滢,高宗泽,李婷婷,冯 敏,何 康,胡有生
(井冈山大学医学部基础医学与药学院,江西,吉安 343009;)
双链RNA 依赖的蛋白激酶R(double-stranded RNA-dependent protein kinase R,PKR)是干扰素诱导的、环腺苷酸非依赖性的丝氨酸/苏氨酸蛋白激酶,在脊椎动物各组织细胞中均有组成性表达[1]。PKR结构包括两部分:N端的双链RNA结合结构域(double-stranded RNA Binding Domain, dsRBD)和C端的激酶结构域(Kinase Domain, KD)[2]。前者也称为激酶活性调节结构域,是PKR结合dsRNA后引起PKR单体二聚化激活的结构[3]。PKR的dsRBD往往串联两个(哺乳动物)或三个(少数鱼类)的dsRNA结合模体(double-stranded RNA Binding Motifs, dsRBMs),在进化上相对保守[3]。Nanduri等的研究表明哺乳动物 PKR结构呈哑铃状,两个dsRBM都为α-β-β-β-α结构,有助于与dsRNA结合[3]。PKR的KD为激酶催化功能区,被激活后能磷酸化真核翻译起始因子 2α(eukaryotic translation initiation factor 2α,eIF2α),从而引起蛋白质翻译的抑制[4]。
PKR属于eIF2α激酶家族,在正常机体中,PKR表达很低,处于无活性状态[3]。但当病毒感染时,PKR表达显著上调,通过N端dsRBD与病毒dsRNA相结合而引起整个 PKR分子的二聚化;二聚化后的激酶结构域发生自磷酸化而活化;活化的 PKR磷酸化 eIF2α[5-6]。eIF2α磷酸化一方面可以阻止病毒蛋白的翻译,抑制病毒增殖;另一方面,也可抑制宿主蛋白的合成,导致感染病毒细胞的凋亡;因此可有效控制病毒的繁殖和扩散[4,7,11,13-14]。
病毒dsRNA激活PKR的机制尚在探索之中,有研究提出了 PKR的自抑制学说,即自然条件下PKR 自身N端dsRBD与C端KD相互作用,使得PKR呈无活性状态,当病毒dsRNA与N端dsRBD结合时,C端KD得以暴露从而发挥催化活性[8]。最近的核磁共振和原子力显微镜证实,溶液条件下的PKR结构较为伸展,dsRBD并不与KD相互作用[9],因此PKR的激活机制仍然需要进一步研究。
然而,有学者认为某些病毒的 dsRNA能抑制PKR的激活,这可能与dsRNA的长短[10]和特殊空间结构等[12]密切相关。García等研究发现 dsRNA长度少于30 bp时不能激活PKR[15],当dsRNA的线性结构变为凸出的环状结构时也不能使 PKR有效活化[1,16],其具体作用机制仍需进一步研究.
除了参与抗病毒免疫外,有研究表明 PKR的活化与过度营养引起的肥胖、神经退行性疾病如阿尔茨海默病[13,17]、糖尿病[18-19]、心脑血管疾病[20-21]、肿瘤[22-23]的发生发展密切相关,但具体机制仍不清楚。因此进一步研究 PKR的结构与功能的联系,将会有助于研究这些相关疾病的发病机理[4,24]。
近年来,对不同鱼类 PKR的研究显示,绿色斑点河豚、斑马鱼和万安玻璃红鲤鱼等鱼类 PKR的 N端 dsRBMs存在种类和数量的多态性,与dsRNA的作用强弱、结合保守序列的保守性及结合后的效应也存在差异,如有研究表明草鱼 PKR(CiPKR)N端有3个dsRBM,其中dsRBM2和dsRBM3与哺乳动物PKR的dsRBM1和dsRBM2类似,而dsRBM1是少数鱼类所特有的。通过构建含不同数量dsRBM的PKR突变体并原核表达二聚化和 Poly I:C结合实验显示,仅含 dsRBM1或dsRBM2的PKR既能同二聚化又能同多聚化,而仅含dsRBM3的PKR只能同二聚化不能多聚化,研究还证明 PKR结合 Poly I:C至少需要含有两个dsRBM[25]。
斑马鱼 PKR基因首次克隆后,系统进化分析发现,其双链RNA结合结构域具有三个双链RNA结合模体,但一直缺乏对其进一步的鉴定和功能分析。本研究通过构建斑马鱼DrPKR的dsRBM13的重组体,并进一步原核表达其重组蛋白,体外分析其二聚化和dsRNA结合功能的差异,并分析DrPKR的dsRBM1和dsRBM3及dsRBM13的功能差异,以推测含有三个 dsRBM 的 DrPKR激活的分子机制。
1 材料和方法
1.1 材料
斑马鱼购于中国科学院水生生物研究所斑马鱼资源中心,在井冈山大学发育生物学实验室繁殖;大肠杆菌(E.coli.)DH5α 和 BL21、质粒 pET32a为本实验室保存;T4 DNA连接酶,限制性内切酶(XhoⅠ,EcolⅠ)、dNTP、DL2000 Marker,PCR产物纯化试剂盒(PCR Product Purification Kit),质粒小提试剂盒(EZ-10吸附柱 Mini-Preps Kit)均购自TaKaRa公司;总 RNA提取试剂盒(RNA simple Total RNA Kit)购自天根生化科技有限公司;180 Kda小分子蛋白质Marker购自Solarbio公司;PEG20000:Biotopped公司;poly I:C购自 Sigma 公司。
1.2 方法
1.2.1DrPKR基因结构分析与引物设计
根据斑马鱼PKR基因(GenBank序列号:AM421527.1)序列和氨基酸序列,通过在线系统SMART预测DrPKR蛋白N端3个dsRBM的氨基酸序列及其位置,后根据3个dsRBM的核苷酸序列设计定向删除和重叠PCR引物。
1.2.2 PCR扩增目的基因
利用RNA提取试剂盒及反转录试剂盒,提取斑马鱼肾脏细胞总RNA,琼脂糖电泳检测后,反转录成cDNA,以反转录得到的cDNA为模板,利用设计的引物(表 1),用Primestar 高保真DNA聚合酶PCR扩增PKR各目的片段。反应条件为:98 ℃10 min,98 ℃30 s,60 ℃30 s,72 ℃2 min,共 30个循环,72℃10 min。扩增产物进行琼脂糖电泳检测,利用SanPrep柱式PCR产物纯化试剂盒纯化产物后保存于4℃备用。

表1 研究用到的引物Table 1 Primers applicated in this study
1.2.3 重组质粒载体构建
将纯化PCR产物与pET32a载体分别经XhoⅠ和EcolⅠ双酶切,酶切产物纯化后经T4 DNA连接酶,4℃连接过夜。连接产物转化大肠杆菌DH5α,氨苄青霉素抗性平板筛选阳性克隆。经测序确定构建成功的克隆,命名质粒PPM1,PPM3,PPM13,PPM123。
1.2.4 重组蛋白小量诱导表达
提取构建成功克隆细菌的质粒,转化大肠杆菌BL21。氨苄青霉素抗性平板筛选阳性克隆。先进行蛋白小量表达检测构建蛋白的IPTG诱导效应和分子量大小。取活化后的阳性克隆细菌 200 μL加入20 mL培养基中,37 ℃,220 rpm培养4 h,取1.0 mL做诱导前对照,剩余菌液加入IPTG(1:100)诱导。与对照组一起37 ℃、220 rpm培养4 h,离心去上清,加入50 μL蛋白上样缓冲液混匀,100 ℃金属浴5 min,进行SDS-PAG蛋白电泳分析。
1.2.5 重组蛋白大量表达和纯化
取小量表达正常的细菌进行大量表达,活化后取2.0 mL加入200 mL培养基,诱导步骤同小量表达。诱导完成后200 mL分装4个50 mL离心管,12000 rpm离心 30 min。弃上清后加入 5.0 mL Binding Buffer,混合吹匀取出,再加入 3.0 mL Binding Buffer洗涤离心管,收集洗涤产物,用超声波破碎仪破碎30 min。离心取上清,上清过镍柱纯化,然后置于透析袋中透析过夜。次日用PEG 20000浓缩蛋白至1.0 mL,并进行SDS-PAG电泳检测。
1.2.6 原核表达蛋白的二聚化实验
原核表达dsRBM蛋白的二聚化实验。含3个dsRBM的蛋白dsRBM123和含2个dsRBM的重组蛋白dsRBM13的二聚化实验,反应体系参照文献[25]。
反应体系加完以后,短暂离心混匀,冰上放置1.0 h,加入无SDS含溴酚蓝的DNA电泳loading buffer 2.0 μL,进行非变性SDS-PAG电泳,电泳缓冲液为含1% SDS的1×Tris-Gly溶液。
1.2.7 原核表达蛋白的PolyI:C pull-down实验
利用人工合成的dsRNA PolyI:C与3种不同的dsRBM 蛋白进行体外结合实验。在含有 1个dsRBM,2个dsRBM的原核表达纯化蛋白中加入PolyI:C,并通过非变性的 PAG电泳来检测是否与PolyI:C结合而使蛋白电泳迁移距离减慢,同时对比分析结合dsRNA能力的差异。
2 结果
2.1 重组蛋白dsRBM13的生物信息学分析
在 NCBI基因数据库中检索到斑马鱼PKR的mRNA的完整cDNA核苷酸序列及其编码的氨基酸序列(NCBI Reference Sequence: NP_001108586.1)。将其氨基酸序列输入SMART进行结构域的预测。预测结构显示 斑马鱼PKR 的 N 端的 dsRBD 含有 3 个 dsRBM(图1 ),dsRBM1由第8位氨基酸残基到第74位氨基酸残基组成,共含67个AA;dsRBM2由第100位到第169位氨基酸残基组成,共含70个aa;dsRBM3由第213到第279位氨基酸残基组成,共含67个AA。

图1 斑马鱼PKR蛋白结构示意图Fig.1 Structure diagram of DrPKR
应用重叠PCR引物ZPM13F和ZPM13R构建重组基因dsRBM13并将构建结果进行测序,应用DNAMAN软件翻译为氨基酸序列导入SMART进行结构域的预测,同时和斑马鱼 PKR蛋白氨基酸序列进行比对,其预测结果(图2)显示第一个dsRBM1由67个AA组成,第二个dsRBM3由67个AA组成,氨基酸序列比对(图3)显示重组基因表达蛋白dsRBM13恰好比DrPKR少了dsRBM2的氨基酸序列,以上结果说明重组基因dsRBM13构建成功。
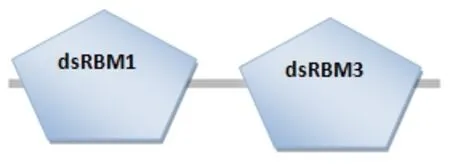
图2 重组基因表达蛋白dsRBM13结构示意图Fig.2 Structure diagram of recombinant gene expression protein dsRBM13

图3 重组基因表达蛋白dsRBM13与DrPKR的N端氨基酸序列比对Fig.3 Sequence alignment of N-terminal amino acid between dsRBM13 and DrPKR
2.2 DrPKR基因片段dsRBM1,dsRBM3的重叠PCR
斑马鱼组织提取的 RNA,反转录合成 cDNA作为模板,应用引物ZPOEF与ZPM1XR、ZPM3EF与ZPNXR、ZPM13F与ZPM13R,使用高保真DNA聚合酶Primestar,通过PCR对斑马鱼PKR基因片段dsRBM1,dsRBM3,dsRBM13进行扩增,dsRBM13片段长度理论上应为dsRBM1片段与dsRBM3片段长度之和,琼脂糖凝胶电泳结果(图4)符合进一步说明重组基因dsRBM13构建成功。

图4 斑马鱼PKR基因扩增的DNA片段的琼脂糖电泳Fig.4 Agarose electrophoresis of the amplified DNA fragments from DrPKR
2.3 重组蛋白dsRBM13的原核表达二聚化实验
实验结果表明dsRBM13,dsRBM123不仅能二聚化,同时还存在多聚化。
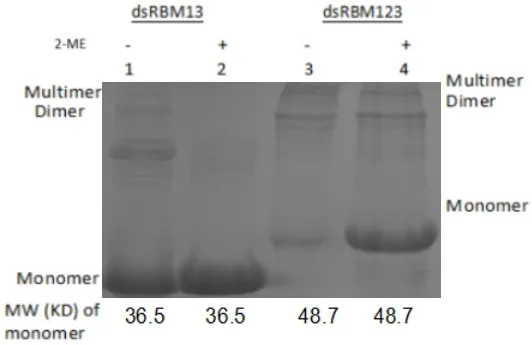
图5 原核表达的 dsRBM13,dsRBM123 的同二聚化Fig.5 Syndimerization of dsRBM13 and dsRBM123 expressed in prokaryotic cells
2.4 重组蛋白dsRBM13的Poly I:C pull-down实验
在该实验条件下,斑马鱼PKR的dsRBM1和dsRBM3在不加Poly I:C,加Poly I:C以及加10倍量的Poly I:C时,各dsRBM蛋白的非变性PAGE迀移距离尚无明显差异,说明单独1个dsRBM结合dsRNA的作用并不明显(图3.9)。
在同样条件下,重组基因表达蛋白 dsRBM13中加 PolyI:C 比不加 PolyI:C 具有明显电泳迀移的阻滞作用;并且在加10倍的Poly I:C比加1倍的Poly I:C有更多的蛋白被阻滞。结果显示,在本实验条件下,2个dsRBM具有明显的结合dsRNA的作用。或者说两个dsRBM比1个dsRBM明显具有更强与dsRNA结合作用(图6)。
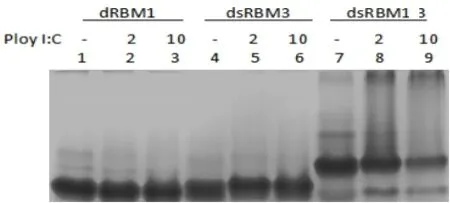
图6 dsRBMl, dsRBM3 和 dsRBM 13的Poly I:C pull-down实验Fig.6 Poly I:C pull-down experiment of dsRBMl, dsRBM3 and dsRBM 13
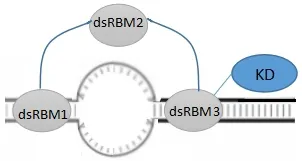
图7 dsRBM13结合dsRNAFig.7 dsRBM13 binding dsRNA
3 讨论
细胞内或细胞外来源的dsRNA能通过与PKR的N端dsRBD结合并激活PKR[2],因此,PKR的活性受 N端的 dsRBD 调控。所以,PKR-N端的dsRBD对细胞抗病毒免疫反应有着重要作用[26-27]。2个dsRBM串联是PKR的dsRBD常见的结构,但有研究发现,少数鱼类PKR的 N端dsRBD存在3个dsRBM,如斑马鱼,草鱼,绿色斑点河飩,鲫鱼等鱼类PKR[28-29]。三个dsRBM对其功能的影响,目前仍知之甚少[30]。
Hu等(2016)鉴定了草鱼PKR含3个dsRBM,分析其功能发现,只含有单个 dsRBM 不能明显的与dsRNA结合,两个或两个以上的dsRBM才能有效地结合dsRNA[25]。斑马鱼PKR被鉴定有3个dsRBM,但对其功能的研究还需进一步深入。斑马鱼PKR dsRBM的功能是否具有更强的抗病毒免疫功能?含有三个dsRBM的斑马鱼PKR是否存在由dsRBM1跨过dsRBM2与dsRBM3结合dsRNA而激活PKR的分子机制呢?比如dsRNA线性分子上存在部分二级结构,刚好占据dsRBM2的情况,在这种情况下仅靠 dsRBM1和 dsRBM3是否能激活PKR?
实验结果证实,DrPKR的dsRBM1和dsRBM3的重组蛋白 dsRBM13不仅能进行同二聚化,还能进行同多聚化。同时Poly I:C pull-down实验结果显示,只含一个dsRBM(只含dsRBM1或dsRBM3)的斑马鱼PKR突变体结合Poly I:C的作用不明显,而含两个dsRBM的重组蛋白dsRBM13可以有效地结合Poly I:C,这与Hu等的研究草鱼PKR的结果一致。而含有三个dsRBM的DrPKR的N端具有更强的二聚化作用,这种更强的作用可能使斑马鱼PKR与病毒dsRNA结合后更强地激活PKR,引起更强的抗病毒免疫反应。同时,重组的 dsRBM13具有功能,可能提示在斑马鱼抗病毒免疫中,或许存在 PKR的 N端 dsRBM1跨过 dsRBM2协同dsRBM3以dsRBM13的形式结合dsRNA并激活的分子机制(图8)。含有三个dsRBM的PKR具有更强的结合 dsRNA能力,并且可能具有结合某些含有二级结构的 dsRNA的能力,因此具有更强的激活效果和更多的激活形式,从而赋予含有三个dsRBM的PKR更强的抗病毒免疫反应功能[31]。
