Hp感染与胃炎类型及病理分型关系的探讨
2019-09-07吕亚丽王巧欢罗杰
吕亚丽 王巧欢 罗杰
摘要目的:分析不同类型胃炎幽门螺杆菌(Hp)感染情况与不同病理分型的关系。方法:收治行胃镜检查的胃炎患者1 314例;采用胃镜下黏膜活检,对活检标本进行病理分析,并对患者胃炎进行分型,采用病理组织学及13C呼气试验对Hp进行检测。结果:慢性萎缩性胃炎患者Hp阳性率84.36%,显著高于慢性非萎缩性胃炎组(45.64%)(P<0.05);重度及中度炎性反应患者Hp阳性率(80.81%、73.94%)均显著高于轻度炎性反应组患者(53.1%)(P<0.05);胃炎活动组患者Hp阳性率(68.82%)显著高于胃炎不活动组(39.27%)(P<0.05);肠上皮化生及上皮内瘤变患者Hp阳性率(93.97%)、95.37%)显著高于无明显病理学改变组患者(37.80%)(P<0.05)。结论:Hp感染与慢性胃炎的发生发展关系密切,慢性萎缩性胃炎及伴有上皮内瘤变、肠上皮化生的患者Hp阳性率较高。
关键词 胃炎;Hp感染;病理类型
随着内镜技术的不断进步,采用胃黏膜活检采集患者活体组织并进行病理学检查取得了明显进步,在临床中为胃炎的诊断及疾病类型的确诊以及为炎症的活动性评估提供依据[1]。目前有大量文献指出,幽门螺杆菌(Hp)在胃炎发生发展过程中起到十分重要的作用[2]。此外,随着Hp检测技术的不断普及和升级,Hp检测得以在临床中广泛应用。已有大量研究指出,Hp感染是胃炎、胃溃疡发病的重要诱因之一,并可能起到十分重要的作用[3,4]。但胃黏膜萎缩、胃炎反应程度等病理的相关性尚无定论。且胃黏膜上皮内瘤变及黏膜肠上皮化生与Hp的相关研究鲜有报道。本研究收治胃炎患者1314例,分析不同类型胃炎患者Hp阳性率与不同病理分型的相关性,为临床应用提供参考。
资料与方法
2016年1月-2018年1月收治胃炎患者1314例,男720例,女594例;年龄18 - 64岁,平均(44.82±8.39)岁;均行胃镜下黏膜活检。
入组及排除标准:(1)入组标准:①患者有胃镜检查意愿,身体素质允许其接受检查,且为首次胃镜检查;②均进行13C尿素呼气试验及病理组织学Hp检测;③患者临床资料完整;④患者对本研究知情并签署知情同意书。(2)排除标准:①检查前2周内服用过质子泵抑制剂,或4周内服用过抗菌药物或铋剂;②既往进行过抗Hp治疗;③合并胃溃疡、胃息肉或胃癌患者;④患者存在非上皮性肿瘤疾病;⑤心、肝、肾脏器功能异常;⑥不符合Hp检测标准患者。
胃镜活检及胃炎分级:本组研究中,采用胃镜下黏膜活检,胃镜型号OLYMPUS GIF-H260。当患者无明显病灶时,在患者胃窦处取2块活检,若患者存明显病灶则活检4-6块。对患者胃炎分级进行评估时,采用中华医学会消化病分会制定的《中国慢性胃炎共识意见》标准[5],将其分型,即慢性萎缩性胃炎及慢性非萎缩性胃炎,将炎性病理分型分为轻度、中度及重度3级。参照WHO分类标准对患者上皮内瘤变及肠上皮化牛病理进行诊断[6]。
Hp检测方法:本组研究中采用13C呼气试验及病理组织学进行Hp检测,若两项检测结果均阴性则判定Hp阴性,结果同时为阳性则判定Hp阳性,若出现其他情况则将患者排除。
统计学方法:本组研究中使用SPSS19.0存儲并处理原始数据,使用(x±s)表示计量资料,行t检验或方差检验分析组间数据差异;使用百分率表示计数资料,并行x2检验分析组间数据差异。若P<0.05则认为差异有统计学意义。
结果
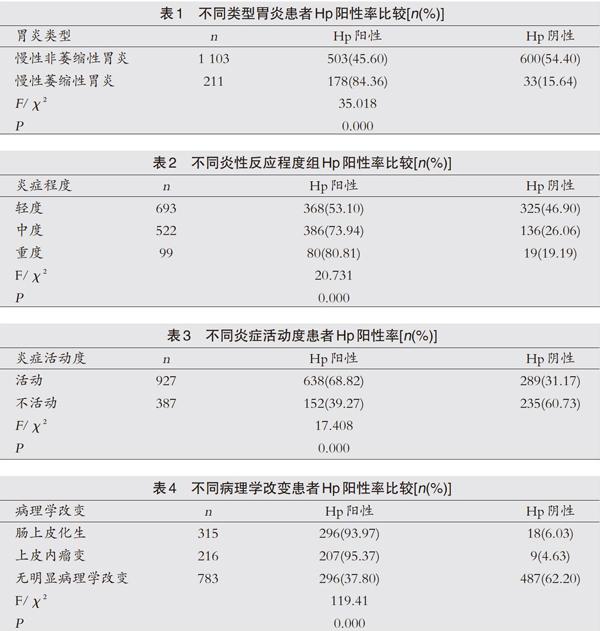
不同类型胃炎患者Hp阳性率:本组研究结果显示,慢性萎缩性胃炎组Hp阳性率显著高于慢性非萎缩性胃炎组,P<0.05,差异有统计学意义,见表1。
不同炎性反应程度患者Hp阳性率:本组研究结果显示,重度及中度炎性反应组Hp阳性率均显著高于轻度炎性反应组,P<0.05,差异有统计学意义,见表2。
不同炎症活动度患者Hp阳性率:本组研究结果显示,胃炎活动组Hp阳性率显著高于胃炎不活动组,P<0.05,差异有统计学意义,见表3。
不同病理学改变患者Hp阳性率:本组研究结果显示,肠上皮化生及上皮内瘤变患者Hp阳性率显著高于无明显病理学改变组患者,P<0.05,差异有统计学意义,见表4。
讨论
Hp感染是造成慢性胃炎的主要原因,Warren JR等研究表明70% - 90%的慢性胃炎患者有Hp感染,慢性胃炎活动性的存在高度提示Hp感染[7,8]。有研究结果显示当患者Hp感染后会进一步加重胃黏膜上皮的损伤,若不及时干预,并可能导致患者出现上皮内瘤变及肠上皮化生[9-11]。
本组研究结果显示,慢性非萎缩性胃炎、慢性萎缩性胃炎的Hp阳性率分别为45.60%及84.36%,表明患者病情进展及黏膜萎缩与Hp感染密切相关。对炎性反应程度进行分析发现,轻度、中度患者Hp阳性率分别为53.10%、73.94%,而重度患者Hp阳性率高达80.81%,表明患者炎性程度越高,Hp阳性率越高。表明Hp感染能加重胃黏膜炎症程度。对慢性胃炎活动度进行分析时发现,活动性胃炎患者Hp阳性率显著高于不活动性胃炎患者Hp阳性率。结果显示,当感染Hp后可进一步加重炎性反应,刺激胃黏膜出现持续性的炎性反应。也有研究结果表明,胃黏膜出现炎性反应后存在Hp感染,可能导致患者形成萎缩性胃炎,其与Hp的定植、产生毒素及酶、免疫反应等可能密切相关[12]。当胃黏膜出现感染后可能刺激机体出现炎性反应,破坏胃部腺体,导致出现胃萎缩。此外,本组研究对出现不同病理学改变的患者进行分析发现,肠上皮化生及上皮内瘤变的Hp阳性率分别为93.97%及95.37%,均显著高于无明显病理学改变患者的Hp阳性率,说明Hp感染在上皮内瘤变及肠上皮化生的病理过程中起到了重要的作用。近年研究结果显示,Hp感染是引发肠上皮化牛和胃黏膜萎缩的重要因素,其是引起宿主免疫反应、炎性反应的独立影响因素[13,14]。Hp感染后可导致胃黏膜出现异常的上皮细胞增殖,且其机制可能与炎性介质的释放及炎性反应密切相关,其均可引起细胞损伤,导致细胞增殖活性增强,增生更为活跃,其DNA合成活性更为旺盛,易受致癌物质影响,出现基因错配导致上皮内瘤变甚至可能出现癌变。当细胞增殖速度过快,使其明显快于凋亡速度时,导致细胞内的凋亡增殖平衡被打破,也可能是导致患者出现上皮内瘤变的主要因素之一[15]。李幕然等[16]的研究也表明,随着萎缩程度、肠化分级的加重,Hp阳性率增高。
综上所述,慢性胃炎的发生发展与Hp感染密切相关,中重度炎性反应、萎缩性胃炎及上皮内瘤变和伴肠上皮化生患者Hp阳性率较高,Hp感染能加重胃黏膜炎症程度,而对于Hp感染与肠上皮化生、上皮内瘤变程度的分析需要进一步研究。
参考文献
[1]Cao Q.Didelot X.Wu Z,et aLProgressive ge-nomic convergence of two Helicobacter pylo一ri strains during mixed infection of a patientwith chronic gastritis[J].Gut,2015,64(4):554-561.
[2] Hunt RH, Camilleri M, Crowe SE, et al. The stomach in health and disease[J]. Gut,2015,64(10):1650-1668.
[3] Genta RM, Sonnenberg A. Helicobacter-neg-ative gastritis:a distinct entity unrelated to Helicobacter pylori infection[J]. Alimentary Pharmacology & Therapeutics,2015,41(2):218-226.
[4] Roman LD, Lukyanchuk R, Sablin OA, et al. Prevalence of H. pylori Infection and Atro-phic Gastritis in a Population-based Screen-ing with Serum Biomarker Panel(Gastro Panel?) in St. Petersburg[J]. Anticancer Re-search,2016,36(8):4129.
[5]房静远.中国慢性胃炎共識意见(2017年,上海)[J].胃肠病学,2017,22(11):670-687.
[6]李增山,李青.2010年版消化系统肿瘤WHO分类解读[J].中华病理学杂志,2011,40(5):351-354.
[7]Warren JR.Gastric pathology associated withHelicobacterpylori[J]. Gastroenterol Clin North Am,2000,29(3):705-751.
[8] Sonnenberg A, Lash RH, Genta RM.A nation-al study of Helicobacter pylori infection ingastric biopsy specimens[J]. Gastroenterology,2010,139(6):1894-1901.
[9] Takeshi AMD, Shigeji IMD, Fukiko SMD, et al.The role of the HLA-DQA1 gene in resis-tance to atrophic gastritis and gastric adeno-carcinoma induced by Helicobacter pylori infection[J]. Cancer,2015,82(6):1013-1018.
[10] Endo S, Ohkusa T, Saito Y, et al. Detection of Helicobacter pylori infection in early stagegastric cancer.A comparison between intesti-nal-and diffuse-type gastric adenocarcino-mas[J]. Cancer,2015,75(9):2203-2208.
[11] Yanai H, Takada K, Shimizu N, et al. Ep-stein-Barr virus infection in non-carcino-matous gastric epithelium[J]. Journal of Pa-thology,2015,183(3):293-298.[12]Cicone F,Papa A,Lauri C,et al.Thyro-gastric autoimmunity in patients with differentiated thyroid cancer:a prospective study[J].Endo-crine,2015,49(1):1-7.
[13]Luo G,Guo M,Liu Z,et al.Blood Neutro-phil-Lymphocyte Ratio Predicts Survival in Patients with Advanced Pancreatic Cancer Treated with Chemotherapy[J].Annals of Surgical Oncology,2015,22(2):670.
[14]闵丛丛,石岩岩,丁士刚.高致病性幽门螺杆菌标志物的研究进展[J].实用医学杂志,2015,31(21):3478-3480.
[15]Rokkas,Liatsos,Petridou,et al.Relationship of Helicobacter pylori CagA(+)status to gas-tric juice vitamin C levels[J].European Jour-nal of Clinical Investigation,2015,29(1):56-62.[16]李幕然,刘艳迪,唐涛,等.幽门螺杆菌和慢性胃炎胃黏膜病理变化的关系研究[J].天津医药,2015,43(1):54-56.
