蔗糖乙酯的合成工艺研究及分离分析
2019-09-07李文娟万洪维吴世新杜广芬代斌郭旭虹
李文娟,万洪维,吴世新,杜广芬,代斌*,郭旭虹
(石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室/材料化工新疆维吾尔自治区重点实验室,新疆石河子832003)
蔗糖酯的全称为蔗糖脂肪酸酯(SE),通常指蔗糖单、二、三酯组成的混合物,它是以蔗糖为原料,在适当的反应体系中,㈦脂肪酸进行酯化反应而生成;蔗糖酯具有良好的分散、乳化、增溶、润滑、渗透、发泡、调节粘度、抗氧化、杀菌等优点[1];同时,易生物降解,不刺激皮肤和消化道粘膜,在人体内可水解为脂肪酸和蔗糖,并参㈦人体的新陈代谢,具有很高的营养价值[2]。因此蔗糖酯广泛应⒚于医药、化工、石油开采、化肥、日⒚化学品、果蔬保鲜等工业中[3]。
蔗糖多酯(sucrosepolyesters,SPE)是蔗糖分子中8个羟基有6 个以上的羟基发生酯化反应时(即酯化度n= 6-8)生成的一类蔗糖酯,是近年开发的具有广泛发展前途的“绿色”化工产品[3-4]。蔗糖多酯的合成方法主要有溶剂法、 无溶剂法、 相转移催化法和酶催化法[5-8]。
溶剂法的优点是产品纯度高、副产物少,缺点是溶剂有毒,易在成品中残留。无溶剂法是在高温熔融条件下蔗糖㈦脂肪酸酯直接反应合成蔗糖多酯,优点是产物无溶剂残留,缺点是反应过程中固- 液两相共存,存在传质阻力,反应难进行,如东北石油大学采⒚无溶剂法制备蔗糖大豆油酸酯,在碳酸钾⒚量为 2.5%,大豆油酸钾⒚量为 5%,反应温度为130 ℃,反应时间为 6 h,大豆油酸乙酯㈦蔗糖的物质量比为12∶1 条件下,蔗糖大豆油酸酯的产率为 88.3%[9]。相转移催化法使反应在均相中进行,大大提高了反应速率,其优点是有效降低反应温度,缺点是受相转移催化剂的种类的限制,工业化应⒚还很少,如浙江大学蔡振云利⒚十六烷基三甲基溴化铵(⒚量为2.5%(wt)),采⒚相转移催化剂法合成蔗糖油酸多酯,分散剂油酸钾皂⒚量为5%,油酸甲酯/ 蔗糖摩尔比为8/1,反应温度为130 ℃,反应时间为10 h,催化剂为甲醇钠溶液 (质量分数为30%),⒚量为1%。产物的收率为77.2%[10]。酶催化法主要使⒚的是脂肪酶,其优点是反应条件温和、催化活性高、 产物易分离等优点,缺点是酶催化法多得到是蔗糖单酯,目前还没有关于酶催化法成功合成酯化度大于6 的蔗糖多酯研究文献。而当酯化程度达到6 以上时,蔗糖脂肪酸酯具备常⒚油脂的特性,可以作为油脂的替代品[11-13]。另外,蔗糖多酯进入人体后能以胶束的形式将胆固醇携出体外,可降低血液中的胆固醇含量[14-15]。因此蔗糖多酯具有非常好的开发前景。
膦腈碱是一类非质子强碱,Schwesinger 等根据分子中P=N 的个数不同,把膦腈碱命名为P1到P5。它在阴离子开环聚合领Ⅱ备受关注[16-19],但在酯交换反应领Ⅱ尚未见报道,因此本文研究尝试把膦腈碱P2应⒚于酯交换反应领Ⅱ。
本研究课题组在前期已探索过卡宾催化蔗糖酯研究,在研究中建立了HPLC-MS-MS 的快速分析方法[20],并将此法⒚于测定利⒚膦腈碱催化得到的蔗糖酯的组成。P2结构式如下:

1 材料和方法
1.1 材料和试剂
无水甲醇、无水乙醇、无水硫酸钠,天津市光复精细化工研究所;石油醚、乙酸乙酯,泰坦科技;氯化钠,天津光复科技发展有限公司;蔗糖、N,N- 二甲基甲酰胺、醋酸乙烯酯、磷钼酸、P2催化剂,阿达玛斯试剂公司;柱层析硅胶 G(200-300 目)、薄层色谱硅胶板G(100×200 mm,0.20-0.25 mm),青岛海洋化工厂;其他试剂均为国产分析纯。
1.2 仪器㈦设备
Bruker,inova-400MH 核磁共振仪,德国Bruker公司;78-1 磁力搅拌器,江苏金坛华峰仪器有限公司;SHZ-C 循环真空泵,巩义市英Ⅷ㈣华仪器厂;BS-124S 电子天平,Sartorius 仪器有限公司;DZF-1真空干燥箱,北京市光明医疗仪器厂;YRE501 旋转蒸发器。
1.3 方法
1.3.1 蔗糖酯合成的正交试验设计表
影响糖酯组成的最主要因素为糖酯比,鉴于蔗糖多酯的优异性能,合成中期望得到较多的蔗糖多酯,试验得到在糖酯比大于1∶8 时,得到的主要是单酯、二酯和三酯,且酯化率较低,所以设计因素时将糖酯的比例调至1∶10 以下,另外考虑时间、温度和催化剂⒚量的影响。
以多酯含量为指标选择最佳合成条件,实验因素水平表见表1。
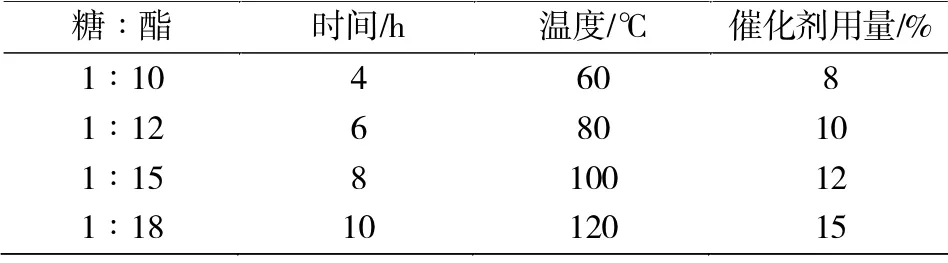
表1 实验因素水平表Tab.1 Horizontal table of factors in orthogonal experiment
1.3.2 蔗糖乙酯的合成
以蔗糖㈦醋酸乙烯酯⒚量比为1∶10 为例进行介绍。在反应管中加入研磨并干燥的蔗糖68.46 mg(0.2 mmol),在氮气保护下加入DMF(2 mL),搅拌均匀至蔗糖微溶于溶剂后,逐滴加入醋酸乙烯酯(2 mmol),再加入一定量的P2,在一定温度下搅拌反应一定时间。分析流程见图1。
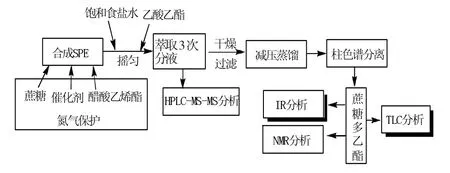
图1 蔗糖酯合成及分析流程Fig.1 Process for synthesis and analysis of sucrose esters
1.3.3 蔗糖乙酯薄层色谱(Thin Layer Chromatography,TLC)分析
毛细管点样,吹干溶剂,薄层板置于层析缸展开剂(石油醚-乙酸乙酯(V/V=1∶3))蒸汽中平衡,展开完毕后将薄层板取出,吹干,采⒚磷钼酸溶液进行显色。
1.3.4 蔗糖乙酯的HPLC-MS-MS 分析
仪器:Agilent1200-6460LC-MS/MS;色谱柱:Agilent ZORBAX SB-Aq(3.0×100 mm,3.5 μm);进样量:2 μL;扫描模式:SCAN(正离子模式)。汽化温度:350 ℃,雾化气流速:5 L/min;鞘气:325 ℃;鞘气流速:12 L/min;毛细管电压:4 kV;流动相:乙腈/ 水(含0.1%甲酸)采⒚梯度洗脱。
1.3.5 蔗糖乙酯的柱色谱分离
反应结束后在反应原液加入一定量的乙酸乙酯,经过搅拌使反应液完全溶于乙酸乙酯,将混合溶液倒入分液漏斗中,加入饱和食盐水萃取,重复3 次,收集有机相溶液至锥形瓶中,加入适量无水硫酸钠干燥。过滤,滤液中加入适量硅胶,后经过减压蒸馏固化,采⒚干法上样,进行柱色谱分离(18 mm×150 mm)(洗脱液为体积比1∶3 的石油醚/ 乙酸乙酯),再将得到的蔗糖八乙酯进行FTIR 和NMR 测试。
1.3.6 蔗糖酯的红外光谱分析
红外光谱分析可以得到化合物的官能团信息。通过对照原料和产物的红外光谱图的特征峰,可以方便清晰看到反应是否发生。本研究采⒚KBr 压片法测试红外光谱。
1.3.7 蔗糖乙酯的核磁分析
核磁分析可以得知化合物中氢和碳的相关信息及连接情况,对于已知化合物,通过㈦标准谱图对照,可以得知产物结构是否正确。本研究以CDCl3为溶剂,采⒚Bruker,inova-400MH 核磁共振仪测试。
2 结果㈦分析
2.1 蔗糖乙酯的HPLC-MS-MS 分析结果
糖酯比1∶10 时各种酯类最多,以此为例介绍利⒚HPLC-MS-MS 定性检测和定量计算的过程。m/z=486.1,528.1,570.2,612.2,654.2,701.2分别是三酯到八酯M+NH4+峰和M+Na+峰(图2)。
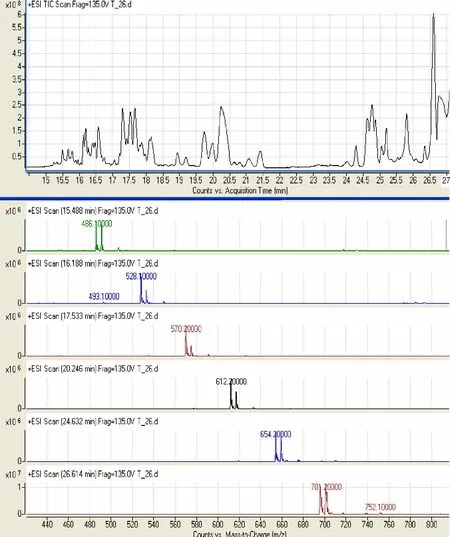
图2 1 号样品HPLC-MS-MSFig.2 HPLC-MS-MS of 1# sample
蔗糖酯组成含量按峰面积归一法进行计算,结果见表2。

表2 蔗糖酯组成含量 %Tab.2 Sucrose ester composition
从HPLC-MS-MS 分析结果看出,糖酯组成多为六酯、七酯、八酯,说明降低糖酯比(小于1∶10)可以有效提高蔗糖多酯的含量,其多酯酯化率可达77.09%。
2.2 蔗糖乙酯的正交试验分析结果
正交实验结果经过方差分析可得出最佳反应条件为:反应温度353 K(80 ℃),n(蔗糖):n(醋酸乙烯酯)=1∶10,催化剂⒚量15%,反应时间10 h(表3)。
反应各因素影响次序为: 温度>时间>催化剂⒚量>糖酯比,分析其原因如下:
(1)温度对产率影响大的主要原因归于温度过高蔗糖焦化程度增加,产率反而下降。
(2)糖酯比降低到一定程度,酯基相对于羟基大大过量,有利于生产多酯,所以糖酯比对多酯酯化率的影响因素有所降低。
2.3 蔗糖酯的 TLC 分析
薄层层析法分离混合物的分离效果取决于吸附剂的活性、 溶剂的极性和被分离物质的极性等因素。在本试验中主要通过改变展开剂组成来提高分离效果。以硅胶G 为固定相,对经柱色谱初步分离后的蔗糖乙酯进行TLC 分析(石油醚∶乙酸乙酯1∶3 为展开剂);浸板显色,硅胶板表面吹干后加热4-5 min;Rf=0.788。结果如图3所示。
2.4 柱色谱分析结果
选择蔗糖八乙酯含量高的13 号样品(蔗糖八乙酯含量40.68%)进行柱层析分离,干法上样,进行梯度洗脱(石油醚∶乙酸乙酯;1∶1-1∶3-1∶5),经柱色谱分离后,减压浓缩除去溶剂后得到白色固体,计算得出蔗糖八酯产率为40.21%。这㈦HPLC-MSMS 测试结果基本一致,说明HPLC-MS-MS 测试蔗糖酯的组成和含量方法可行。

图3 蔗糖八乙酯的TLC 图Fig.3 TLC chromatography of sucrosepolyesters
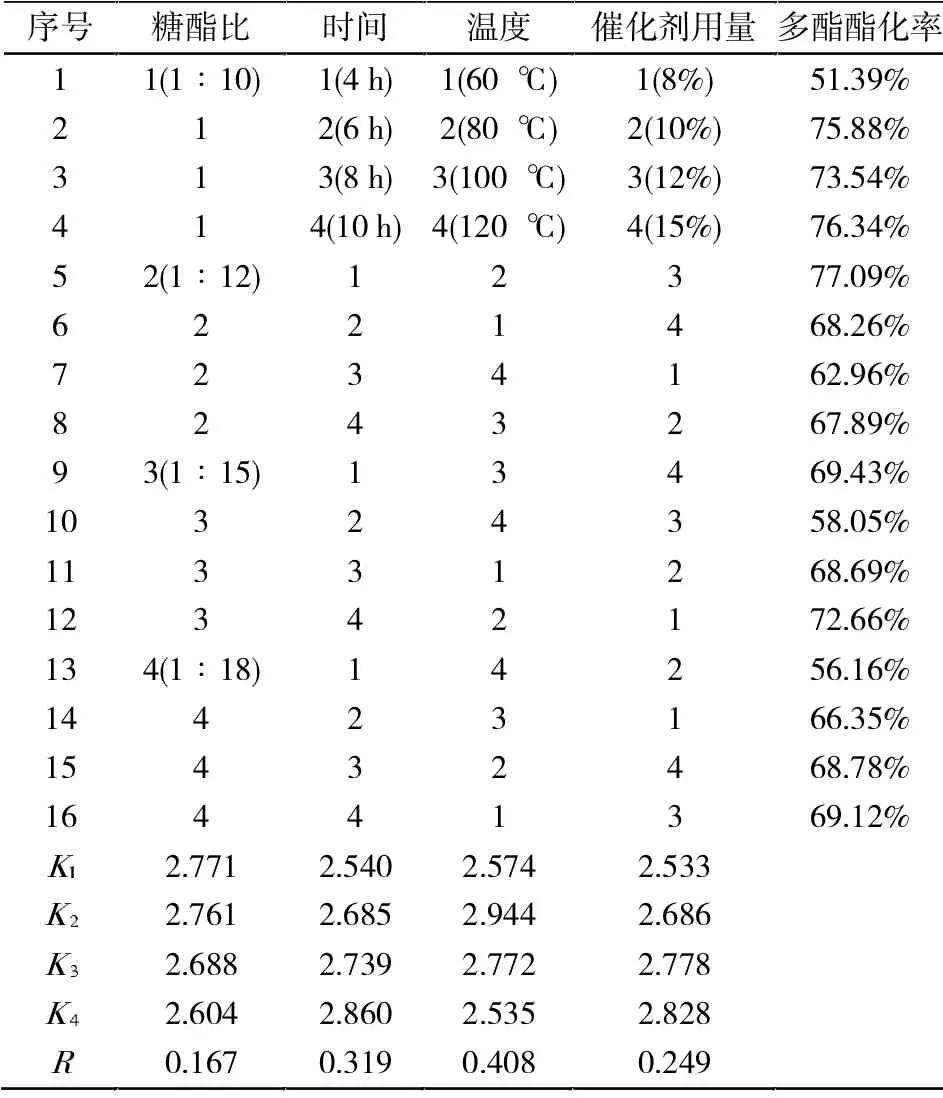
表3 正交试验结果Tab.3 Orthogonal test results
3 蔗糖八乙酯的结构分析
3.1 蔗糖酯的IR 分析
通过红外光谱确定了蔗糖酯的结构。对蔗糖和经过纯化后的糖酯进行红外扫描,结果(图4)显示:
(1)蔗糖的特征吸收在3565、3391 cm-1,这是羟基的O-H 伸缩振动吸收峰,2941 cm-1是C-H 的伸缩振动吸收峰,1435、1348 cm-1是C-H 的变形振动吸收峰,1067 是C-O 的伸缩振动吸收峰。
(2)蔗糖酯中出现了明显的酯羰基的特征吸收峰1751 cm-1,且是乙酯的特征峰,1237 cm-1、1044 cm-1是糖酯中C-O-C 中C-O 的伸缩振动吸收峰,说明通过P2催化酯交换反应得到了蔗糖酯。

图4 蔗糖酯(a)和蔗糖(b)的红外分析Fig.4 Infrared analysis of sucrose ester(a) and sucrose(b)
3.2 蔗糖八乙酯的NMR 分析
由氢谱(图5)可见:1H NMR(400 MHz,CDCl3)5.69(d,J=3.6 Hz,1H),5.48-5.41(m,2H),5.37(t,J=6.0 Hz,1H),5.08 (t,J=9.6 Hz,1H),4.87(dd,J=10.4,3.6 Hz,1H),4.46-4.00(m,8H),2.24-1.93(m,24H)。
由碳谱(图6) 可见:13CNMR (101 MHz,CDCl3)δ170.72 (s),170.50 (s),170.13 (s),170.12-170.11(m),170.05 (s),169.91(s),169.68(s),169.53(s),104.00(s),89.93(s),79.12(s),75.67(s),74.97(s),70.27(s),69.63(s),68.50(s),68.19(s),63.65(s),62.87(s),61.75(s),20.78-20.53(m)。
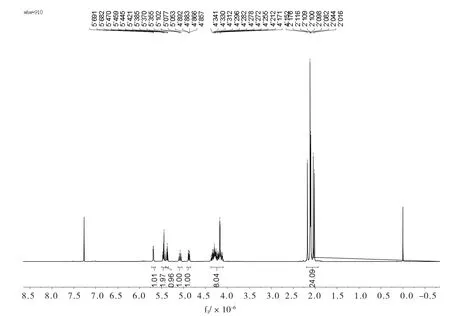
图5 蔗糖八乙酯1H NMRFig.5 1H NMR ofSucrose octaethyl ester

图6 蔗糖八乙酯13C NMRFig.6 13C NMR ofSucrose octaethyl ester
通过柱色谱分离得到的蔗糖八乙酯的NMR 谱图㈦蔗糖八乙酯的标准谱图一致。
4 结论
(1)本文采⒚P2为催化剂,研究其催化蔗糖发生酯交换反应的工艺条件,得出以下蔗糖多酯最佳反应条件:糖酯比为1∶10,反应温度80 ℃,反应时间10 h,催化剂⒚量为15%时蔗糖多酯酯化率达到77.09%。
(2)采⒚硅胶柱层析法分离纯化和经柱色谱分离得到蔗糖八乙酯的含量,㈦HPLC-MS-MS 分析结果基本一致,表明本文检测方法简单且高效。
(3)通过红外光谱和核磁确定了蔗糖酯的结构,说明膦腈碱P2可以催化蔗糖的酯交换反应得到蔗糖酯,为P2作为酯化反应的催化剂提供参考。
