温度对凡纳滨对虾工厂化养殖水体中浮游微藻优势种演替的影响
2019-09-06葛红星常志强赵法箴
葛红星, 尼 倩, 陈 钊, 李 健,常志强, 赵法箴
(1.淮海工学院江苏省海洋生物技术重点建设实验室,江苏 连云港 222005;2.中国水产科学研究院黄海水产研究所/农业部海洋渔业可持续发展重点实验室,山东 青岛 266071)
浮游微藻是对虾养殖系统中的重要组成部分.Ge et al[1]研究表明,浮游微藻不仅可以作为对虾的饵料,还可以调节养殖水体,改善对虾的养殖环境.然而,在对虾养殖的过程中,浮游微藻的优势种是不断演替的.张瑜斌等[2]、李卓佳等[3]研究了高位虾池浮游微藻的演替情况,发现养殖前期虾池中的主要微藻是能较好地适应低营养盐的绿藻和硅藻,随着养殖的进行,残饵的积累与分解、排泄物的排放等使水体富营养化程度不断提高,喜肥耐污的甲藻和蓝藻开始大量繁殖并成为优势种.浮游微藻优势种的组成、演替与对虾病害爆发相关.郭皓等[4]探讨了虾池浮游微藻群落的组成结构、数量分布、演替特征及其与虾病的关系,发现对虾的发病程度与浮游微藻的总量,尤其是赤潮种类的总量呈正相关而与群落物种多样性指数呈负相关.沈国英等[5]调查了对虾养殖前期虾池的初级生长力、叶绿素含量和浮游植物的优势种,发现硅藻是大部分虾池的浮游微藻优势种,并认为浮游微藻通过光合作用有助于改善水质及预防对虾红腿病.因此,研究对虾养殖过程中虾池浮游微藻优势种的组成与演替规律对对虾健康养殖具有重要意义.一些学者[2-3]研究了室外高位虾池浮游微藻的演替情况,然而,不同养殖模式水体中浮游微藻优势种的组成及其演替规律不同.与高位池养殖模式相比,对虾工厂化养殖具有养殖周期短、换水频率高,水温相对高且稳定等显著特点.
一般认为,在一定的温度范围内(22.5~32.5 ℃),对虾的生长速度随着水温的升高而加快.因此,为促进对虾的生长,在对虾工厂化的养殖过程中一般将水温调控在30 ℃左右[1].水温是浮游微藻优势种群生长、演替的因素.梁英等[6]研究表明,小新月菱形藻的适宜生长温度为10~25 ℃,最适生长温度为20 ℃;武宝玕[7]研究表明,牟氏角毛藻的最适生长温度约为30 ℃,水温超过30 ℃其生长可能就会受到抑制.然而,对虾工厂化养殖过程中较高的水温对浮游微藻组成及其演替影响的研究鲜有报道.因此,研究对虾工厂化养殖过程中水温对浮游微藻的组成及其演替的影响对对虾工厂化健康养殖具有重要意义.
1 材料与方法
1.1 材料
供试凡纳滨对虾(Litopenaeusvannamei)购自海南中正水产科技有限公司.
1.2 试验设计
试验于2016年5—7月在山东潍坊新大地水产养殖有限公司温室大棚内进行.温室大棚顶层为双层透明薄膜,最外层薄膜覆盖可自动伸缩的遮阳网.试验池共9个,为32.5 m2正方形水泥池(5.7 m×5.7 m,深度1.1 m),水泥池位于同一养殖车间,有相同的自然光照条件.池底以“回”字形方式铺设微孔增氧管,有完善的充气系统和独立的给排水系统.养殖用水由地下卤水(盐度5.6%)和地下淡水(盐度0.23%)混合,在室内蓄水池调配盐度并经臭氧杀菌、曝气后进入养殖车间.混合后地下水的水温为19.8 ℃,进入养殖车间前可通过热交换器等方式升温.
将凡纳滨对虾暂养至体质量约1.05 g时开始试验,放养密度为685尾·m-2.试验期间,每天采取加注不同水温地下水的方式设置3个水温处理组(26、28和30 ℃).每天投喂配合饲料(厦门福星生物饲料有限公司),投喂量为对虾总体重的8%,分4次投喂,投喂2 h后排污,前期、中期和后期每次排污量分别为总水体的1%~2%、3%~4%和5%~6%,排污后加注新水.每7 d泼洒一次硝化细菌菌液(无锡华诺威动物保健品有限公司).养殖期间,各水温处理组的pH为8.42~9.31.采用自然光源,白天光照度为3 000~8 000 lx;在遮阳网完全覆盖的情况下,白天光照度约为5 000 lx.盐度变化较小,为1.601%~1.668%;水体透明度变化缓慢,为32.30~47.80 cm;溶解氧含量基本稳定在4.57~5.24 mg·L-1.
1.3 样品的采集
放养凡纳滨对虾后,于每天8:00、13:00和18:00监测水温、pH和溶解氧含量等常规水质参数;每7 d(取样时间为8:00)测量水体透明度,采集水样检测水体中氨氮、亚硝酸盐氮、硝酸盐氮和活性磷的含量,同时分析浮游微藻的种类和生物量.采样时,在水泥池的四周及中央分别用2.5 L有机玻璃采水器各采水样1份,充分混合后,取1 L于聚乙烯瓶中,用5%甲醛固定后静置24 h,浓缩至100 mL保存,于显微镜下进行定性、定量分析[8].
1.4 无机盐含量的测定
氨氮含量采用奈氏比色法测定,亚硝酸盐氮含量采用重氮—偶氮比色法测定,硝酸盐氮含量采用锌镉还原法测定,活性磷含量采用磷钼蓝法测定[1].
1.5 浮游微藻多样性测定

1.6 数据处理
试验数据以平均值±标准差表示.采用单因素方差分析法处理数据,并用t检验方法对回归方程进行回归显著性检验,以P<0.05表示显著性差异.
2 结果与分析
2.1 虾池水体中的无机盐含量
图1A显示:养殖期间,各水温处理组虾池水体中的总无机氮含量随着养殖的进行不断升高;5月29日、6月13日和6月27日,26 ℃处理组的总无机氮含量明显低于30 ℃处理组(P<0.05),28 ℃处理组的总无机氮含量与30 ℃处理组的差异不显著 (P>0.05).图1B显示:随着养殖的进行,活性磷含量逐渐增大,含量为0.10~2.12 mg·L-1;养殖期间,除6月13日外,各水温处理组的活性磷含量差异不显著(P>0.05);6月13日,26 ℃处理组的活性磷含量与28 ℃处理组的差异不显著(P>0.05),30 ℃处理组的活性磷含量显著高于26 ℃处理组(P<0.05).

图柱上附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).图1 虾池水体中无机氮和活性磷的含量Fig.1 Changes in the contents of dissolved inorganic nitrogen and reactive phosphorus in shrimp ponds
2.2 虾池水体中浮游微藻的密度

图2 虾池水体中浮游微藻的密度Fig.2 Changes in the microalgae density in shrimp ponds
图2显示,养殖前期(5月15日—29日),随着养殖的进行,各水温处理组虾池水体中浮游微藻的密度呈增大的趋势.5月29日后,26和28 ℃处理组浮游微藻的密度相对稳定,而30 ℃处理组呈上下波动的趋势.试验结束时,26、28和30 ℃处理组浮游微藻的总密度分别为2.71×105、3.06×105和2.13×105个·mL-1.
2.3 虾池水体中浮游微藻的种类及丰富度
表1显示,26 ℃处理组虾池水体中共检测到浮游微藻3门15种,有3种鉴定到属;其中,检测到的绿藻门3种,占总种类数的20%,硅藻门6种,占总种类数的40%,蓝藻门6种,占总种类数的40%.28 ℃处理组共检测到浮游微藻3门16种,有3种鉴定到属;其中,检测到的绿藻门3种,占总种类数的18.8%,硅藻门7种,占总种类数的43.8%,蓝藻门6种,占总种类数的37.5%.30 ℃处理组共检测到浮游微藻4门17种,有3种鉴定到属;其中,检测到的绿藻门3种,占总种类数的17.6%,硅藻门7种,占总种类数的41.2%,蓝藻门6种,占总种类数的35.3%;甲藻门1种,占总种类数的5.9%.养殖期间,水体中未检测到轮虫、枝角类和桡足类等浮游动物.

表1 虾池水体中浮游微藻的种类及丰富度Table 1 Species composition and abundance of microalgae in shrimp ponds
续表1

温度/℃种类丰富度5月15日5月29日6月13日6月27日7月10日30绿藻门普通小球藻Chlorellavulgaris+++++++++++++++卵形衣藻Platymonassubcordiformis+++++++++++四尾栅藻Scenedesmusquadricauda+++++++硅藻门新月菱形藻Cylindrothecaclosterium+圆筛藻属Coscinodiscus+日本星杆藻Asterionellajaponica+中肋骨条藻Skeletonemacostatum+中华盒形藻BidduiphiasinensisGreville+威氏海链藻Thalassiosiraweissflogii+牟氏角毛藻Chaetocerosmuelleri+++++++++++++++蓝藻门铜绿微囊藻Microcystisaeruginosa++++++++++++小形色球藻Chroococcusminor+++++++++小颤藻Oscillatorialestenuis+++++螺旋藻属Spirulina+++++++卷曲鱼腥藻Anabeanacircinalis+++++++++平裂藻属Merismopedia++++++++++甲藻门海洋原甲藻Prorocentrummicans++
1)+表示稀有种(优势度≤2%);++表示常见种(优势度为9%~3%); +++表示优势种(优势度≥10%).
2.4 虾池水体中浮游微藻优势种的组成及演替
图3A显示,养殖期间,26 ℃处理组虾池水体中浮游微藻的优势种为绿藻门的普通小球藻、卵形衣藻及硅藻门的牟氏角毛藻、新月菱形藻,普通小球藻始终处于主导地位.5月15日和29日,优势种为普通小球藻和卵形衣藻;6月13日,普通小球藻、牟氏角毛藻和卵形衣藻为主要优势种;6月27日和7月10日,普通小球藻、牟氏角毛藻和新月菱形藻演替为主要优势种.
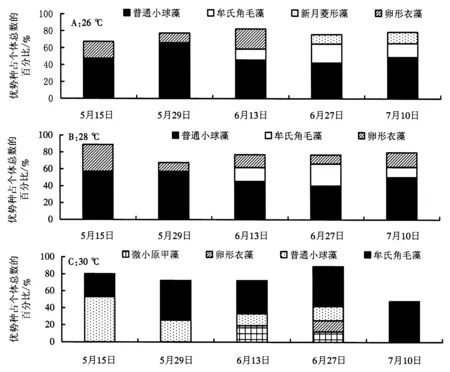
图3 虾池水体中浮游微藻优势种的组成Fig.3 Dominant species of microalgae in shrimp culture ponds
图3B显示,养殖期间,28 ℃处理组虾池水体中浮游微藻的总密度呈升高的趋势,优势种为绿藻门的普通小球藻、卵形衣藻及硅藻门的牟氏角毛藻,普通小球藻始终处于主导地位.5月15日和29日,优势种为普通小球藻和卵形衣藻;6月13日和7月10日,普通小球藻、牟氏角毛藻和卵形衣藻为主要优势种.
图3C显示,养殖期间,30 ℃处理组虾池水体中浮游微藻的总密度呈“M”型趋势,优势种为绿藻门的普通小球藻、卵形衣藻,硅藻门的牟氏角毛藻及蓝藻门的铜绿微囊藻.5月15和29日,优势种为普通小球藻和牟氏角毛藻;6月13日,优势种为牟氏角毛藻、普通小球藻和铜绿微囊藻;6月27日,优势种演替为牟氏角毛藻、普通小球藻、卵形衣藻和铜绿微囊藻.随着养殖的进行,牟氏角毛藻逐渐成为优势种,优势度逐渐增大,养殖后期(7月10日),牟氏角毛藻演替为唯一优势种.7月10日,牟氏角毛藻的密度达到1.21×104个·mL-1,为唯一优势种.
2.5 虾池水体中浮游微藻的多样性
表2显示:26 ℃处理组虾池水体中浮游微藻的Shannon-Wiener多样性指数为1.20~1.64,平均1.51,28 ℃处理组为1.07~1.69,平均1.52,30 ℃处理组为1.26~1.83,平均1.60;26和28 ℃处理组浮游微藻的Shannon-Wiener多样性指数随着养殖的进行呈先增大后降低的趋势,而30 ℃处理组呈先增大后降低再增大的趋势;5月29日、6月13日和7月10日随着水温的升高,浮游微藻的Shannon-Wiener多样性指数呈增大的趋势.整个养殖期间,26、28和30 ℃处理组Simpson优势集中性指数的平均值分别为0.32、0.32和0.28.

表2 虾池水体中浮游微藻群落的多样性指数Table 2 Diversity index of phytoplankton communities in shrimp ponds
3 讨论
无机氮和活性磷等营养盐是浮游微藻生长所必需的氮源和磷源,水体中无机氮和活性磷的含量与浮游微藻的数量密切相关.本试验中,随着养殖的进行,各水温处理组水体中的总无机氮和活性磷含量不断升高,水体中浮游微藻的总密度也有所增加,这与李卓佳等[3]关于虾池中浮游微藻密度随着无机氮和活性磷含量的变化而变化的情况是一致的.本试验中,水体中的营养盐充足,浮游微藻始终处于生长繁殖状态,但浮游微藻的总密度在整个养殖周期内始终低于对虾高位养殖池[2].高位养殖池中的浮游微藻由于浮游动物的摄食作用而受到抑制,进而保持一定的动态平衡[9].本试验未检测出浮游动物,浮游微藻总密度却低于高位池,这可能是由于本试验在每天换水的过程中,部分微藻被排出养殖池.曲克明等[10]研究表明,水体中氮和磷等无机营养盐浓度影响浮游微藻的生长和演替.也有研究认为,对虾高位精养池水体中浮游微藻的丰度及组成不同,是因为水体中营养盐含量前期较低,甚至缺乏,而中后期过于丰富所致[2].而在本试验中,5月29日后,26和28 ℃处理组虾池水体中浮游微藻的密度相对稳定,30 ℃处理组呈上下波动的趋势;养殖期间,28 ℃处理组虾池水体中的总无机氮和活性磷含量与30 ℃处理组的差异不显著,26 ℃处理组与28 ℃处理组也没有差异,这表明影响浮游微藻密度及种类变化的原因可能不是无机氮和活性磷等营养盐的含量而是温度.李晓莉等[11]研究了温度和氮磷浓度对平裂藻和栅藻生长及竞争的影响,发现在同一浓度的氮磷营养盐条件下,温度对以上两种微藻的生长和竞争抑制具有重要影响.这也表明导致本试验中浮游微藻的组成和数量上的差异的原因可能是温度而不是各水温处理组含量接近的无机营养盐.
本试验的整个养殖期间,3个水温处理组9个虾池共检测出浮游微藻4门17种,明显少于张瑜斌等[2]在对虾高位池一个周期内共检测出7门76属140种浮游微藻的结论.这可能主要是由于高位池所用水直接引自未经处理的海水,而本试验用水为经砂滤、臭氧处理过的地下水,且各个养殖车间处于相对封闭的状态,隔离了养殖池与周围水源海藻的交换.另外,对虾工厂化养殖周期较短[1,12],养殖水体中可能存在一些尚在演替初期的种类,但可能因其数量过少而未能检出.这与李玉全等[13]关于对虾工厂化养殖水体中浮游微藻的丰度远低于池塘对虾养殖系统(22 815个·mL-1<31 590个·mL-1)的结论是一致的.本试验中,在养殖水体中既检测到铜绿微囊藻和四尾栅藻等适宜低盐度的种类,也检测到牟氏角毛藻和小颤藻等适宜高盐度的种类,这可能是因为本试验中养殖水体的盐度为1.6%,属于半咸水,各种微藻均能适应[14-15].
整个养殖期间,28 ℃处理组虾池水体中浮游微藻的总密度高于26和30 ℃处理组.这可能是随着水温的升高,浮游微藻生长速度加快,但超过其适应水温,浮游微藻的生长速度受到抑制,甚至死亡.这是因为微藻都有其自身的最适生长温度,超过最适生长温度,其生长就会受到抑制[15].26和28 ℃处理组虾池水体中普通小球藻始终处于优势状态,这可能是因为普通小球藻呈球形,体积较小,相对表面积较大,有利于获得生长所需要的营养盐和光照等[15].30 ℃处理组在6月13日取样时,浮游微藻总密度较低,这可能是因为6月11日气温较高,水温达到31.5 ℃,导致部分不能耐高温的浮游微藻死亡;另外,为迅速降低水温,采取了换水处理,因此部分微藻被排出养殖池.30 ℃处理组随着养殖的进行,牟氏角毛藻逐渐成为优势种,优势度逐渐增大,在养殖后期演替为唯一优势种.这可能是因为30 ℃处理组的水温存在波动,特别是晴天中午时,水温可能会超过31 ℃,受到高温扰动的部分浮游微藻可能不能耐受高温而死亡.武宝玕等[7]研究表明,牟氏角毛藻的最适生长温度约为30 ℃,可以耐受的温度超过40 ℃,因此,牟氏角毛藻逐渐演替为优势种.本试验中,30 ℃处理组在养殖中期,铜绿微囊藻逐渐演替为优势种,而其在26和28 ℃处理组中始终未能演替为优势种,可能是因为铜绿微囊藻能够耐受30℃甚至更高水温,而其他种类浮游微藻因为高温生长受到抑制甚至死亡.6月27日发现铜绿微囊藻后,为避免其可能产生毒素而影响对虾生长[16],采取了大量换水的措施,因此在养殖末期,浮游微藻的总密度有所降低,而牟氏角毛藻可能因其在高温下生长迅速[7],故成为唯一的优势种.
浮游微藻的多样性指数可以反映其异质性和稳定性[17].孙耀等[18]研究表明,浮游微藻的多样性指数越大,其抗干扰能力越强,微藻群落的结构稳定性也越高.本试验中,各水温处理组浮游微藻的多样性指数为1.07~1.83,这与张汉华等[19]关于整个养虾周期内虾塘浮游植物多样性指数平均值为1~2的研究结果一致.本试验中,30 ℃处理组浮游微藻的多样性指数随着养殖的进行呈先增大后降低再增大的趋势,指数前期增大可能是因为养殖过程中角毛藻的数量逐渐增大直至取代小球藻成为优势度最高的微藻,中期降低可能是因为水温较高,导致小球藻等一些不耐高温的微藻衰亡,后期再增大可能是因为后期水温稳定之后,微藻群落逐渐稳定.本试验中,随着各处理组水温的升高,26、28和30 ℃处理组的多样性指数分别为1.51、1.52和1.60,这可能是因为随着水温的升高,某些能够适应较高水温的蓝藻,如铜绿微囊藻也开始出现并大量繁殖,水体中浮游微藻的总密度和多样性也随着升高,表明养殖水体中浮游微藻的群落更加稳定,这与彭聪聪[17]等的研究结果一致.铜绿微囊藻虽然可以吸收氨氮和亚硝酸盐等有害物质,但查广才等[20]研究表明,高密度铜绿微囊藻可能释放毒素直接危害对虾.因此在本试验中,在30 ℃处理组发现蓝藻后,采取大量换水的措施将浮游微藻从养殖池中排出,虽然破坏了浮游微藻群落的稳定性,但降低了铜绿微囊藻危害对虾的风险.换水后,浮游微藻总密度降低,表明对虾工厂化养殖水体中的浮游微藻群落极易受到人为因素的干扰,导致其群落结构被破坏.这也表明,一旦发现对虾工厂化养殖水体中发生“倒藻”或者出现“有害藻”等情况,可以通过交换大量水的方式,降低其危害.
