体质量指数与AECOPD患者糖皮质激素受体的相关性研究
2019-09-06聂晓红杜月君李雪梅张剑周玲熊沿
聂晓红 杜月君 李雪梅 张剑 周玲 熊沿
1成都医学院第二附属医院·核工业四一六医院呼吸与危重症医学科610051;2成都市第二人民医院呼吸与危重症医学科610017
COPD 是一种异质性疾病[1],除咳嗽、咳痰、呼吸困难等临床症状有所差别外,患者体型或体质量指数(body mass index,BMI)的差异也非常普遍。近年来对COPD 的表型研究成为热点[2],集中在肺气肿表型及慢性支气管炎表型研究更多:肺气肿表型多为低BMI,对吸入性糖皮质激素/长效β2受体激动剂的治疗反应相对较差[3]。慢性阻塞性肺疾病急性加重期 (acute exacerbation of chronic obstructive pulmonary disease,AECOPD)患者在应用支气管舒张剂的基础上,可短期全身使用糖皮质激素 (glucocorticoids,GC),而口服是优先的途径[4],可缩短患者病程及康复时间,改善肺功能和氧合,减少早期病情反复和治疗失败的风险[5],故全身使用GC尤其是口服泼尼松在临床中得到广泛应用。GC 主要的抗炎机制之一是GC 和细胞浆内的糖皮质激素受体 (glucocorticoid receptor,GR)结合并使其活化,活化的GR 从细胞浆转运至细胞核,与GC识别元件结合,导致核小体组蛋白赖氨酸残基乙酰化,使一些抗炎基因表达增加[6]。目前基于BMI差异的COPD 的相关临床研究不多,且多集中在炎性因子上[7],对口服激素治疗反应的差异性以及气道黏液高分泌状态本课题组前期已经进行了研究和报道。为进一步探讨BMI与AECOPD 患者GR 的相关性,本研究把AECOPD 患者分成低BMI组、正常BMI组及高BMI组,经泼尼松治疗7 d,探讨3种不同BMI的AECOPD 患者血气分析、炎性指标之间有无差异以及与GR 的相关性,为解释部分临床现象提供理论依据。
1 对象与方法
1.1 研究对象 选取2017年1月至2018年6月在成都医学院第二附属医院呼吸与危重症医学科住院的有完整资料的AECOPD 患者131例,其中男100例,女31例,年龄 (70.34±9.88)岁,年龄范围为46~91岁。其诊断符合 《慢性阻塞性肺疾病急性加重 (AECOPD)诊治中国专家共识(2017年更新版)》[4]。根据BMI把患者分为3组:BMI<18.5 kg/m2为低BMI组 (A 组)29例,BMI 18.5~23.9 kg/m2为正常BMI组 (B组)61 例,BMI≥24.0 kg/m2为高BMI组 (C组)41例。纳入标准: (1)入院前6个月内肺功能按GOLD 分级为Ⅲ~Ⅳ级; (2)患者入院前1周内因咳、痰和/或气喘加重入院;(3)住普通病房的AECOPD 患者;(4)住院期间能配合行肺功能检查及雾化等治疗。排除标准:(1)需要有创机械通气或需要住ICU; (2)合并明显肺炎、支气管哮喘、肿瘤未控制的糖尿病、充血性心力衰竭、心肌梗死; (3)入院前1 个月内使用全身GC;(4)不能站立测体质量、身高者;(5)有使用GC的明显禁忌证;(6)有认知障碍。退出标准:(1)住院期间因病情加重转入ICU 或因其他严重疾病转科治疗;(2)住院未满7 d而出院者;(3)患者因口服泼尼松出现明显不适,或出现药物相关性不良反应必须停药者。
1.2 方法
1.2.1 常规检查及治疗方法 所有患者入院时均测量身高与体质量,计算BMI。入院后均常规行血常规、生化全套、痰培养、胸部CT 等检查;并常规给予氧疗(或加用无创呼吸机)、抗感染、解痉平喘及对症治疗;并于第2天清晨饭后口服强的松30 mg,连续服用7 d,7 d后常规测定肺功能。
1.2.2 血气分析 采用美国雅培i-STAT 300型血气分析仪(以在激素治疗前及治疗7 d后两个时间点测定的数值作为统计依据),观察PaO2及PaCO2。
1.2.3 超敏C 反应蛋白 (hypersensitive C-reactive protein, hs-CRP )、 降 钙 素 原(procalcitonin,PCT)测定 入院时及治疗7 d后清晨抽取静脉血4 ml,肝素抗凝,1 h 内分离血浆。hs-CRP 由BECKMAN COULTER AU2700全自动生化分析仪测定,试剂盒为中国北京九强生物技术有限公司的“金斯尔”品牌试剂系列,其参考值为0~10 mg/L;PCT 由瑞士罗氏cobas e601全自动免疫分析仪经电化学发光法测定,试剂盒为罗氏诊断产品(上海)有限公司生产,参考值为0~0.046μg/L。
1.2.4 人GR 测定 (1)首先行外周血单个核细胞 (peripheral blood mononuclear cells,PBMCs)的分离:在入院时及激素治疗7 d后的第2天清晨抽取患者外周静脉血10 ml(10% EDTA 抗凝),用PBS缓冲液按1∶1稀释并在50 ml无菌离心管中充分混匀。另一50 ml离心管加入淋巴细胞分离液12 ml,然后加入上述稀释血,20℃恒温水平以2 000 r/min (离心半径14 cm)离心20 min,吸取白色云雾层,置入另一无菌离心管中。向收集的细胞中加入10 ml的PBS 缓冲液吹打混匀后,以1 800 r/min (离心半径10 cm,离心10 min),20 ℃恒温水平离心10 min。弃上清后,再用PBS缓冲液洗涤细胞2 次,20 ℃恒温水平以1 500 r/min (离心半径14 cm)离心10 min。弃上清,用PBS缓冲液重悬细胞。计算细胞活力及细胞计数。(2)通过酶联免疫吸附测定 (enzyme linked immunosorbent assay,ELISA)分别测定PBMCs中GRα 和GRβ 的蛋白表达含量及细胞核GRβ/GRα比值。GRα及GRβ的ELISA 试剂盒由中国上海博耀生物科技有限公司提供。B 组61例患者中,采用数字随机法分为2 组,一组30 例测定GR,另一组31例不测定GR。
1.3 统计学分析 采用统计软件SPSS 20.0处理数据,计量资料以±s表示,2组间均数比较采用两独立样本t检验,多组间均数比较采用单因素方差分析(ANOVA);计数资料采用χ2检验;相关性用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 3 组患者一般资料比较 3组患者在年龄及性别构成方面差异无统计学意义 (F=3.075,χ2=3.692,P值均>0.05);在住院天数方面,B 组低于A 组和C 组 (t=3.873、3.147,P值 均<0.05),但A组与C组之间差异无统计学意义(P>0.05)。见表1。
2.2 3 组治疗前后血气分析及炎性指标比较 治疗后各组的PaCO2、PaO2、PCT 和hs-CRP 均较入院时有明显下降或升高;入院时及治疗后A组的PaCO2均较B组要低(t=3.027、3.735,P值均<0.05);3组的PaO2在入院时B组最高,C组最低,3组之间差异有统计学意义(F=3.415,P<0.05);治疗后B组的PaO2高于A组及C组(t=2.693、3.107,P值均<0.05);治疗前C 组的PCT 和hs-CRP 均明显高于A 组及B 组,组间比较差异有统计学意义 (F=5.362、6.263,P值均<0.01);治疗后PCT 和hs-CRP在C组仍高于A 组和B组(F=3.728、4.141,P值均<0.01)。见表2。
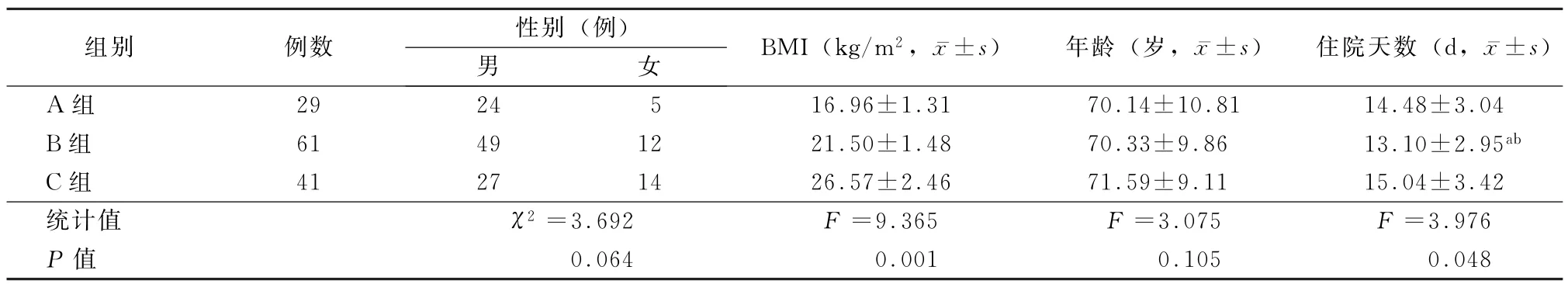
表1 3组慢性阻塞性肺疾病患者一般资料比较
2.3 3 组治疗前后GR 比较 在B 组61 例患者中,采用数字随机法分为2组,其中B1组30例测定GR,B2 组31 例不测定GR。治疗后各组的GRα均较入院时有明显增加而GRβ有所下降,但GRβ/GRα在治疗前后差异无统计学意义。入院时各组的GRα 总体之间差异有统计学意义 (F=3.472,P<0.05),且B组及C组均高于A组(t=3.115、2.741,P值均<0.05);治疗后3 组的GRα差异有统计学意义,C 组最高,A 组最低(F=5.020,P<0.05)。入院时C组的GRβ低于A 组(t=3.027,P<0.05),治疗后3组的GRβ之间差异有统计学意义 (F=2.642,P<0.05),且B组及C组均低于A 组(t=2.856、2.948,P值均<0.05)。入院时及治疗后3 组GRβ/GRα差异有统计学意义 (F=4.248、2.951,P值均<0.05),且B 组及C 组均低于A 组 (t=2.822、3.135,P值均<0.05)。见表3。
2.4 BMI与GRα、GRβ及GRβ/GRα相关性分析分析COPD 患者BMI与GRα、GRβ 及GRβ/GRα的相关性,发现BMI与入院时的GRα呈正相关、入院时及治疗后的GRβ/GRα呈负相关 (r=0.274、-0.341、-0.236,P值均<0.05)。BMI与治疗后GRα、入院时及治疗后GRβ无显著相关性。见表4。
表2 3组间血气分析及炎性指标比较 (±s)
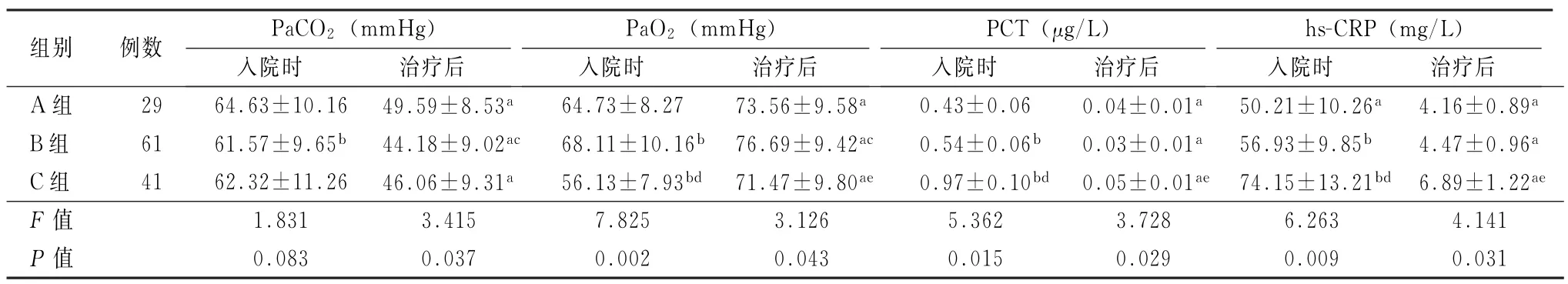
表2 3组间血气分析及炎性指标比较 (±s)
注:1 mmHg=0.133 kPa;A、B、C组分别为低BMI组、正常BMI组和高BMI组;PCT 为降钙素原;hs-CRP为超敏C 反应蛋白;与同组入院时比较,a P <0.01;与A 组入院时比较,b P <0.05;与A 组治疗后比较,c P <0.05;与B组入院时比较,d P <0.01;与B组治疗后比较,e P <0.01
组别 例数 PaCO2 (mmHg)PaO2 (mmHg)hs-CRP (mg/L)入院时 治疗后PCT (μg/L)入院时 治疗后入院时 治疗后入院时 治疗后A 组 29 64.63±10.16 49.59±8.53a 64.73±8.27 73.56±9.58a 0.43±0.06 0.04±0.01a 50.21±10.26a 4.16±0.89a B组 61 61.57±9.65b 44.18±9.02ac 68.11±10.16b 76.69±9.42ac 0.54±0.06b 0.03±0.01a 56.93±9.85b 4.47±0.96a C组 41 62.32±11.26 46.06±9.31a 56.13±7.93bd 71.47±9.80ae 0.97±0.10bd 0.05±0.01ae 74.15±13.21bd 6.89±1.22ae F 值 1.831 3.415 7.825 3.126 5.362 3.728 6.263 4.141 P 值 0.083 0.037 0.002 0.043 0.015 0.029 0.009 0.031
表3 3组GR 及比值比较 (±s)
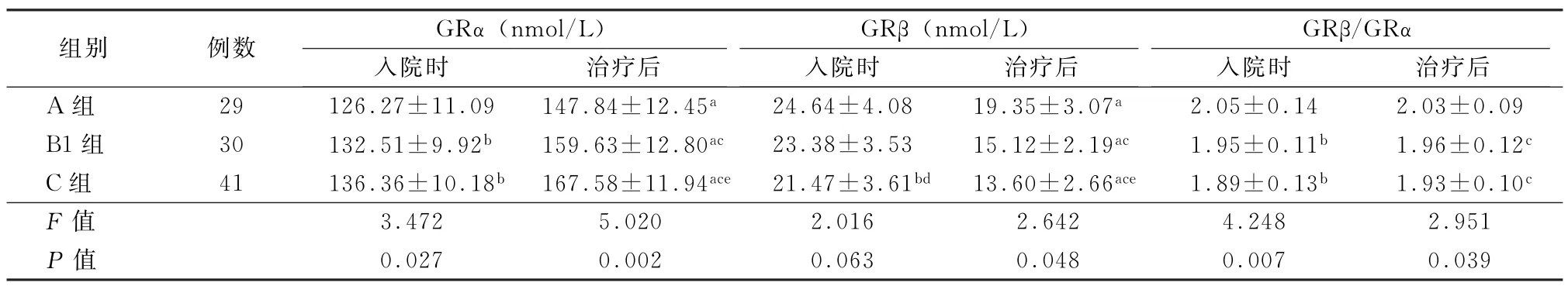
表3 3组GR 及比值比较 (±s)
注:A、B1、C组分别为低BMI组、正常BMI组和高BMI组;GRα为糖皮质激素受体α;GRβ为糖皮质激素受体β;与同组入院时比较,a P <0.05;与A 组入院时比较,b P <0.05;与A 组治疗后比较,c P <0.05;与B组入院时比较,d P <0.05;与B组治疗后比较,e P <0.05
组别 例数 GRα(nmol/L)GRβ(nmol/L)入院时 治疗后GRβ/GRα入院时 治疗后入院时 治疗后A 组 29 126.27±11.09 147.84±12.45a 24.64±4.08 19.35±3.07a 2.05±0.14 2.03±0.09 B1组 30 132.51±9.92b 159.63±12.80ac 23.38±3.53 15.12±2.19ac 1.95±0.11b 1.96±0.12c C组 41 136.36±10.18b 167.58±11.94ace 21.47±3.61bd 13.60±2.66ace 1.89±0.13b 1.93±0.10c F 值 3.472 5.020 2.016 2.642 4.248 2.951 P 值 0.027 0.002 0.063 0.048 0.007 0.039
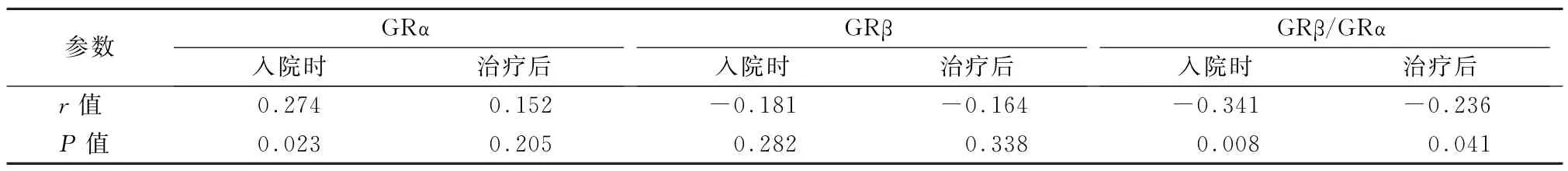
表4 BMI与GRα、GRβ及GRβ/GRα相关性分析
3 讨论
COPD 是全球常见病和多发病,其特征是持续存在的呼吸系统症状和气流受限,具有较高的致残率和致死率,严重威胁患者的生命健康。COPD 为全身系统性炎性疾病,它最主要的靶器官是肺,同时也可以出现许多肺外疾病,主要合并症为高血压、代谢综合征及糖尿病、骨质疏松、支气管扩张、外周血管疾病等[8]。其中低体质量及骨骼肌功能不良在COPD 患者中尤为多见[7]。研究发现稳定期COPD 患者中低体质量尤为常见,而急性加重期患者的体质量及BMI下降更明显[9-10]。这与COPD 患者在急性期食欲下降,能量摄取减少,呼吸道阻力、呼吸肌负荷、基础代谢率及耗氧率均增加,出现营养能量负平衡等有关。BMI是目前国际上常用的衡量人体体型胖瘦以及是否健康的一个指标,COPD 患者BMI降低是导致其疗效低差、病死率增高和病情加重的独立危险因素[11]。
COPD 急性发作期,机体会释放多种炎性介质,导致气道腺体分泌增加,血管通透性增加,黏膜充血水肿,使气道的反应性增高,气管收缩,肺功能急剧下降及临床症状加重。研究发现,不同BMI的患者的炎性指标有差异,高BMI患者的hs-CRP水平与低BMI和正常BMI患者相比有明显增加[12],与我们本次的研究结果一致:肥胖的患者无论是治疗前还是治疗后,其hs-CRP 和PCT均高于其他2组,可能与高BMI患者更多属于支气管炎型,易发生呼吸道感染;且高BMI患者的细胞免疫功能下降更显著或失常,使其感染相对难控制有关[12]。本研究发现,无论是入院时还是治疗后,高BMI组的PaO2最低,证实了肥胖COPD患者更易发生低氧血症,同时低BMI组PaCO2最高,与文献[13]报道一致;而BMI正常的COPD 人群,其血气指标PaCO2、PaO2均处于最好的状态,推测其发生呼吸衰竭的比例更小,病情相对更轻。
GC具有很强的抗炎作用,可抑制炎症介质的释放、干扰各种细胞因子的产生,起到舒张气道的作用;同时还能抑制炎症细胞的活化,阻止炎症细胞对气管的浸润,减少微血管的渗出,抑制黏液分泌;并通过腺苷环化酶增强β2 受体激动剂的临床效应,进而降低气道高反应性[14]。GR 基因可生成GRα和GRβ2种不同GR 蛋白质形式。GRα在机体有核细胞均有一定数量的表达,位于细胞浆中,其数量占总GR 表达的绝大多数,是GC的主要功能性受体,与GC结合后转位进入细胞核发挥其生物学效应。GRβ主要分布于T 淋巴细胞、巨噬细胞和嗜碱粒细胞,位于细胞核,其数量明显低于GRα,且不具有与GC 结合的能力[15]。但GRβ是GRα的内源性抑制因子,并呈浓度依赖性地抑制GRα对靶基因转录激活功能[16]。近年来多数研究表明,GC抵抗与GRα的低表达、GRβ的高表达或GRβ/GRα比值的升高有关[17-18],GRα核内转移受抑制可能是造成GC在COPD 患者中发挥抑制炎性作用欠佳的原因之一[19]。本研究发现治疗后COPD 的GRα均较入院时有明显增加而GRβ有所下降,说明患者对泼尼松均有一定的敏感性和治疗效果。低BMI组GRα 低于其他2 组,治疗后高BMI 组最高,低BMI 组最低,提示体瘦的AECOPD 患者GRα蛋白表达更少。入院时低BMI组的GRβ高于高BMI组;治疗后A 组仍高于B组及C 组,表明不同BMI 的AECOPD 患者体内GRβ表达有差异,体瘦者GRβ表达更多;入院时及治疗后低BMI组的GRβ/GRα均高于其他2组,说明低BMI组GRβ对GRα 的抑制程度更显著。无论是GRα的低表达、GRβ的高表达以及GRβ/GRα比值的升高,均表明低体质量患者对激素治疗的敏感性相对较差,这可能与细胞因子如血清瘦素、TNF-α、IL-6、IL-8等有一定的关系[4,10]。研究还发现,BMI与入院时的GRα呈正相关、与入院时及治疗后的GRβ/GRα呈负相关。
本研究发现,正常BMI组患者的住院时间明显短于其他2组,表明合适范围的BMI对疾病控制最有利。高BMI组住院时间略长于低BMI组,与黄蕾等[20]的研究提示低BMI可能导致AECOPD患者住院时间延长不完全一致,分析原因可能与发生低氧血症更重、感染指标更高,需要使用无创呼吸机或抗生素的时间更长有一定关系。
综上所述,BMI的差异影响着AECOPD 患者感染指标、血气分析、GR 及住院时间:高BMI患者感染指标更高且缺氧更显著,低BMI组患者二氧化碳潴留更明显、GRα蛋白表达更低、细胞核内GRβ/GRα更高且治疗后GRβ最高,正常体质量组患者的住院时间最短。BMI与入院时的GRα呈正相关,与GRβ/GRα呈负相关。过低或过高的BMI均不利于病情,保持在合适的BMI范围对COPD 患者的病情的预后及治疗效果有重要的意义。
利益冲突所有作者均声明不存在利益冲突
