DUSP6通过负向调控ERK1/2通路抑制IBV的增值
2019-09-06刘定祥
王 欢 ,丁 铲 ,刘定祥 ,廖 瑛
(1.中国农业科学院上海兽医研究所,上海200241;2.华南农业大学 群体微生物中心,广东 510642)
禽传染性支气管炎(avian infectious bronchitis,IB)是由禽传染性支气管炎病毒(Avian infectious bronchitis virus,IBV)引起的一种鸡的急性、高度接触性传染性疾病,给养禽业造成了严重的经济损失[1]。根据临床症状不同IB可划分为呼吸型、肾病变型、腺胃型等。IBV属于冠状病毒科(Coronaviridae)、冠状病毒属(Coronavirus)的γ型冠状病毒。病毒颗粒外有囊膜,内含不分节段的单股正链RNA基因组,具有侵染性,长为27.6 kb,有5'帽子结构和3'polyA尾巴结构。病毒基因组可转录出6条亚基因组mRNA,编码nsp2~nsp16等15个非结构蛋白、纤突蛋白(spike protein)、膜蛋白(membrane protein)、核衣壳蛋白(nucleocapsid protein)和小包膜蛋白(envelope protein)4种结构蛋白以及3a、3b、5a和5b四种附属蛋白。IBV感染宿主细胞,先以正链基因组为模板首先翻译出包括蛋白酶、RNA依赖性RNA复制酶和RNA解旋酶在内的nsp2~nsp16,再在复制酶的作用下,以基因组为模板转录负链RNA,进而以负链RNA为模板复制和转录出正链基因组和6条亚基因组mRNA,mRNA翻译结构蛋白,最后组装成成熟的病毒粒子。
病毒进入宿主细胞的增殖受到多种胞内分子的调控。促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是其中的一种,它涉及多种细胞过程,包括转录调控、细胞增殖、细胞凋亡、mRNA稳定性、蛋白质翻译和促炎细胞因子的产生等[2]。病毒可以利用这些细胞过程来完成自身蛋白和核酸的复制。在哺乳动物细胞中,MAPK包括3条信号通路:ERK(extracellular signal-regulated protein kinases)1/2通路、JNK(c-Jun N-terminal kinase)通路和p38(p38 kinases)通路。ERK1/2通路由有丝分裂原和增殖刺激因子激活,而JNK和p38通路由环境压力激活。越来越多的证据表明,病毒感染过程利用MAPK通路,帮助自身在宿主细胞中完成自身复制[3-5]。研究报道,肠道病毒71型(enterovirus 71,EV71)感染细胞可激活ERK1/2信号通路,引起免疫学损伤,有利于病毒复制[6]。
MAPK通路在许多细胞过程中发挥重要作用,同样其作用也受到其他分子的调节。双特异性磷酸酶家族(dual specificity phosphatase,DUSPs),是蛋白酪氨酸磷酸酶的一个子类,有11个特征明显的家族成员。目前已发现,该家族的大部分成员都参与负向调节MAPK信号转导活性,从而参与基因转录调控、细胞增殖、细胞凋亡和应激反应[7],调节生长发育和内环境稳态[8]。研究发现,IBV感染细胞后可通过DUSP1负向调控p38的活性,减少IL-6、IL-8的表达,从而抑制过度炎症反应[9]。DUSP6是MAPK磷酸酶家族的一员,可以针对酪氨酸或丝氨酸/苏氨酸残基去磷酸化并使ERK1/2失活[10-11]。
本研究发现IBV感染细胞引起ERK1/2的磷酸化,从而激活MEK/ERK1/2信号通路。在IBV病毒感染过程中,用MEK(MAPK/ERK kinase)1/2抑制剂U0126处理细胞,阻断MEK/ERK信号通路,ERK1/2的磷酸化水平下调,同时抑制了病毒的复制。Northern blot 和Western blot结果显示,IBV感染细胞引起DUSP6的转录和表达水平上调。利用siRNA干扰DUSP6的表达,或者用药物BCI抑制DUSP6活性,均能增强ERK1/2的磷酸化,并且抑制病毒增殖。
1 材料与方法
1.1 病毒和细胞本实验所用的IBV-Beaudette毒株、IBV-N抗体以及Vero细胞均由华南农业大学刘定祥教授赠予。人肺癌细胞系(H1299)购于美国菌种保藏中心(American type culture collection,ATCC)。Vero细胞培养于含10%胎牛血清(fatal bovine serum,FBS)的DMEM培养基,H1299细胞培养于含10%FBS的RPMI 1640培养基,均置于37℃、5%CO2培养箱中培养。病毒通过Vero细胞扩增,以0.1 MOI感染细胞24 h后,收取细胞和培养液,反复冻融3次,离心取上清,测定TCID50后,-80℃保存备用。
1.2 主要试剂和抗体Trizol试剂购自Life Technologies公司;氯仿、异丙醇、甲醛购自美国Thermo Fisher公司;乙醇购自上海泰坦科技股份有限公司;逆转录酶AMV购自Roche Diagnostics公司;Oligo dT由金唯智公司合成;地高辛标记试剂盒、DIG Wash and Block Buffer Set、DIG easy Hyb、Anti-digoxigenin-AP Fab fragments和CDP-Star均购自德国罗氏公司;溴化乙锭试剂购自Bio-Rad中国公司;HybondTM-N+膜、硝酸纤维素膜购自Amersham Biosciences公司;DEPC水、冰醋酸、柠檬酸钠、三(羟甲基)氨基甲烷购自生工生物(上海)股份有限公司;DUSP6、p-ERK1/2、ERK1/2抗体购自CST公司;β-tubulin抗体购自美国Eptiomics公司;抑制剂U0126和BCI购自美国Sigma公司;siRNA由上海吉玛公司合成。
1.3 RNA提取将Vero和H1299细胞分别接种在10 cm培养皿中,待细胞长成单层时接种IBV,IBV感染细胞1 h后,更换新鲜维持液继续培养。在指定的时间点(感染后第0、4、8、12、16、20、24、28 h),用10 mLPBS缓冲液清洗细胞,1 mL Trizol室温裂解5 min。将细胞裂解物转移至干净的EP管,加入五分之一体积的氯仿,振动15 s后温育3 min,然后以4℃、12 000×g离心15 min。取上清水相于干净EP管中,加入等体积的异丙醇混合,置于-20℃冰箱静置30 min,使RNA沉淀。然后以4℃、12 000×g离心15 min,弃上清,用1 mL 70%乙醇溶液洗涤RNA沉淀物2次,每次以4℃、7500×g离心15 min。弃上清后风干沉淀,在70℃溶解于100 μL DEPC水中,-80℃冰箱保存备用。
1.4 探针合成探针cDNA模板制备:混合2 μg RNA和10 μL oligo dT(10 pmol/μL),终体积10.5 μL。65℃变性10 min,冰浴冷却;加入10 mmol/L dNTPs、20 IU RNA酶抑制剂、2 μL 10×反转录酶缓冲液和50 IU反转录酶,终体积为20 μL,置于43℃反应1 h,合成cDNA,再以65℃加热10 min,终止反应。以DUSP6为引物,探针制备:其序列为5'-CCGTCACGGTGACAGTGGCTTA-3'(正向)和5'-CTGCTGTGCGGGGACACGATT-3'(反向),通过PCR扩增获得DUSP6探针。PCR反应体系:32.25 μL ddH2O、5 μL PCR buffer、5 μLPCR DIG labeling mix、5 μL正向引物、5 μL反向引物、0.75 μL enzyme mix、2 μL模板cDNA,终体积为50 μL。PCR反应条件:95℃预变性2 min,95℃变性10 s,60℃退火30 s,72℃延伸2 min,共30个循环。72℃延伸7 min。探针制备完成后,置于-80℃冰箱保存备用。
1.5 Northern blot30 μg RNA 65℃变性10 min后加入RNA上样缓冲液进行琼脂糖凝胶电泳,电泳完成后使用半干转仪恒压20V转膜30 min,转膜后1200J紫外交联2 min,然后将杂交膜使用1.4制备的探针68℃杂交过夜,杂交后洗膜并封闭30 min,封闭结束后用DIG抗体(Dilute anti-DIG-AP 1∶10000)孵育30 min,洗膜2次,每次5 min;然后利用CDP-Star系统和Tanon 5200全自动化学发光图像分析系统检测信号。
1.6 Western blot将Vero和H1299细胞分别接种在6孔板中,待细胞长成单层时接种IBV,IBV感染细胞1 h后,换维持液继续培养。在指定的时间点(感染后第0、4、8、12、16、20 h),分别用1 mL PBS缓冲液清洗细胞。每孔加入200 μL 2×蛋白裂解缓冲液裂解1 min后,收取细胞裂解液于干净的EP管,100℃金属浴8 min,12 000×g离心2 min后,取10 μL上清上样跑胶。恒流250 mA转印90 min,5%脱脂乳室温封闭1 h后,分别孵育p-ERK、ERK、IBV-N、DUSP6和β-tubulin抗体,并孵育相应种属的二抗,显影前避光配制ECL发光显色液,NC膜在ECL发光显色液中孵育30 s后用Tanon 5200全自动化学发光图像分析系统检测信号。
1.7 U0126抑制实验将Vero和H1299细胞分别接种在6孔板中。待细胞长成单层后接种IBV,IBV感染细胞1 h后,去除未结合的病毒,加入维持液继续培养,并加入不同浓度的U0126或者BCI。感染后12 h用1 mL PBS缓冲液清洗细胞,每孔加入200 μL 2×蛋白裂解缓冲液,裂解5 min后收取细胞置于干净的EP管。100℃金属浴8 min,12 000×g离心2 min。样品保存于-20℃备用。
1.8 siRNA干扰实验将H1299细胞按照5×105个/孔接种于6孔板,培养至细胞密度达到60%时进行siRNA转染试验。取两个EP管分别加入250 μL的Opti-MEM培养基,其中一个加入5 μL的转染试剂Lipofectamine 2000,另一个EP管加入5 μL 20 mmol/L的siRNA,室温静置5 min。将上述两管轻柔混匀,室温静置20 min,形成siRNA/Lipofectamine 2000复合物。预先铺好细胞的6孔板用预冷的PBS清洗3遍,每孔加入1 mLOpti-MEM培养基,并将siRNA/Lipofectamine 2000复合物加入到6孔板中,混匀,置于37℃、5%CO2培养箱培养4 h后弃上清,加入含1%FBS的RPMI1640培养基继续培养32 h,收取蛋白样品,采用Western blot检测相应蛋白的表达情况以确定干扰效果。

表1 siRNA序列Table1 siRNA sequences
2 结果
2.1 IBV感染引起ERK1/2的磷酸化许多病毒感染都会引起ERK1/2的磷酸化,该信号通路的激活在病毒的感染性复制中发挥一定的作用[12]。本实验以1 MOI的IBV分别感染Vero和H1299细胞,在感染后不同时间点收取细胞裂解液,通过Western blot检测细胞中ERK1/2的磷酸化水平(p-ERK1/2),每个时间点设置模拟感染(无病毒感染)为对照组。如图1所示,跟模拟感染组相比较,随着感染时间变化,Vero和H1299细胞内的ERK1/2蛋白表达量保持不变。然而,ERK1/2的磷酸化水平在感染后4 h开始上调,并随着感染时间的延长逐渐升高,分别在感染后16和20 h时达到顶峰。综上,IBV感染能够激活ERK1/2信号通路。
2.2 U0126抑制IBV-N蛋白的表达为了进一步研究ERK1/2信号通路的激活在IBV感染过程中的作用,先利用药物U0126处理受感染的细胞,再检测病毒增殖情况。U0126是一种MEK/ERK通路特异性抑制剂,通过抑制MEK1/2的活性,抑制ERK1/2的磷酸化。本实验首先用IBV分别感染Vero细胞和H1299细胞,以10 μmol/L或15 μmol/L U0126处理的感染后的细胞为实验组,以溶剂DMSO处理的感染后细胞为对照组,并以模拟感染(无病毒感染)为负对照组。感染后12 h时收取蛋白样品,采用Western blot检测ERK1/2的磷酸化水平以及IBV-N蛋白表达情况。如图2所示,与负对照组相比,对照组的ERK1/2磷酸化水平明显上调;而与对照组相比,在U0126处理组中,ERK1/2的磷酸化水平下调,即ERK1/2的激活受到U0126的显著抑制,且U0126实验组中IBV-N蛋白表达量比对照组的表达量明显减少,这种减少情况在H1299细胞中尤其明显。综上,U0126能显著抑制ERK1/2的磷酸化,同时也抑制IBV-N蛋白的表达,表明ERK1/2的磷酸化有促进IBV复制的作用。
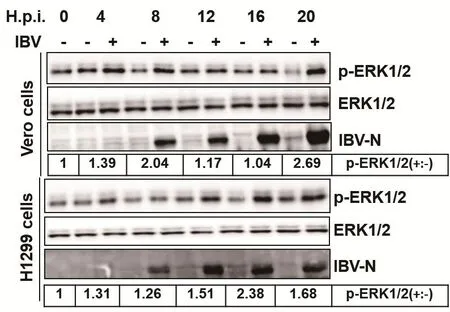
图1 IBV感染激活ERK1/2信号通路Fig.1 IBV infection activated ERK1/2 pathway

图2 U0126抑制ERK1/2信号通路,抑制了IBV的增殖Fig.2 U0126 inhibits ERK1/2 phosphorylation and IBV proliferation
2.3 IBV诱导DUSP6的表达DUSP6是双特异性磷酸酶家族(DUSPs)的成员,可使ERK1/2通路上的酪氨酸或丝氨酸/苏氨酸残基去磷酸化,从而使ERK1/2失活。本研究发现,IBV感染细胞后引起ERK1/2的磷酸化,而MEK激酶抑制剂U0126能够特异性的抑制MEK1/2,阻断ERK1/2通路的激活,抑制IBV的增殖。通常,MAPK通路需要激酶和磷酸酶来调节其活性,从而根据细胞生理需要来调节和平衡相关基因的表达。在Microarray数据中,我们发现DUSP6在转录水平被IBV感染诱导表达,因此,我们预测IBV感染细胞可能会通过促进DUSP6的表达来负向调节ERK1/2通路的活性。本研究采用IBV感染Vero和H1299细胞,收集感染后不同时间点细胞样品,通过Northern blot检测细胞中DUSP6的mRNA水平变化。如图3所示,在Vero细胞中,DUSP6 mRNA在IBV感染后0 h时有少量表达,从感染后4 h时,DUSP6 mRNA信号有明显的上调,并逐渐增强,在感染后16~20 h达到顶峰,感染后24~28 h,由于细胞开始死亡,RNA发生降解(如rRNA开始降解变少),DUSP6 mRNA信号开始减弱,直到消失。在感染H1299细胞4~16 h后,DUSP6 mRNA信号逐渐增强,感染后8 h时达到顶峰,在感染后20~28 h,由于mRNA开始降解(rRNA开始降解变少),DUSP6信号逐渐消失。以上结果表明,IBV感染能促进DUSP6 mRNA的转录。进一步利用Western blot检测IBV感染过程中DUSP6的蛋白表达情况。由于在感染后24 h时细胞死亡,mRNA 降解,因此本研究仅选取感染后0~20 h的时间点做检测,并设模拟感染组做对照。如图4所示,与模拟感染组相比,无论是在Vero细胞还是在H1299细胞中,IBV感染后4 h时,DUSP6蛋白表达水平均开始上升,并持续到感染后20 h。综上,IBV感染可诱导DUSP6蛋白的表达。
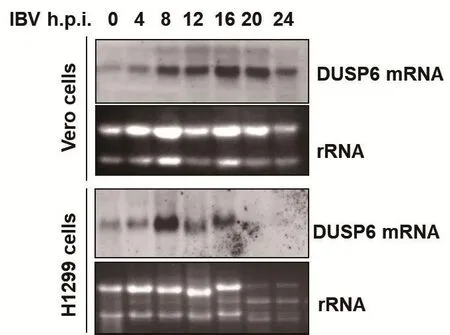
图3 IBV感染增强DUSP6 mRNA的转录Fig.3 IBV infection induced DUSP6 mRNA transcription

图4 IBV感染诱导DUSP6的蛋白表达Fig.4 IBV infection induced high expression of DUSP6 protein
2.4 药物抑制DUSP6活性或者siRNA干扰DUSP6表达,均能上调ERK1/2磷酸化水平,并促进IBV增殖采用DUSP6特异性抑制剂BCI处理细胞,抑制DUSP6的磷酸酶活性。IBV感染Vero和H1299细胞后1 h时,去除未结合的病毒,用10 μmol/LBCI处理细胞12 h。以溶剂DMSO处理细胞为对照组,模拟感染组为负对照组。如图5所示,在Vero和H1299细胞中,与对照组相比,在BCI处理组中,DUSP6表达水平下降(BCI处理导致DUSP6表达下调机制尚不清楚),而ERK1/2的磷酸化水平上升,IBV-N表达水平上升。该结果表明,DUSP6发挥着去磷酸化ERK1/2的作用,不利于病毒复制增殖。为了进一步检测DUSP6对ERK1/2信号通路的调控和对病毒增殖的影响,我们针对DUSP6设计特异性siRNA。siRNA转染H1299细胞后36 h,且IBV感染后8 h,Western blot结果(图6)显示,与sic组相比,siDUSP6的3条siRNA单转染,能够抑制DUSP6的表达,而3条siRNA混合转染,能够明显抑制DUSP6的表达。在所有的siDUSP6转染细胞中,p-ERK1/2的水平均有上调,说明DUSP6的表达量与ERK1/2的磷酸化水平呈负相关。在DUSP6基因沉默的细胞中,IBV-N的表达量呈现上调趋势,说明DUSP6的表达,负向调控IBV的复制增殖。综上,通过特异性抑制剂处理或siRNA干扰的方法降低DUSP6的活性或者减少DUSP6的表达,可导致ERK1/2的磷酸化水平升高,进一步促进IBV的增殖,说明DUSP6在病毒感染过程中负向调控ERK1/2信号通路,DUSP6的上调表达不利于IBV的感染和增殖。
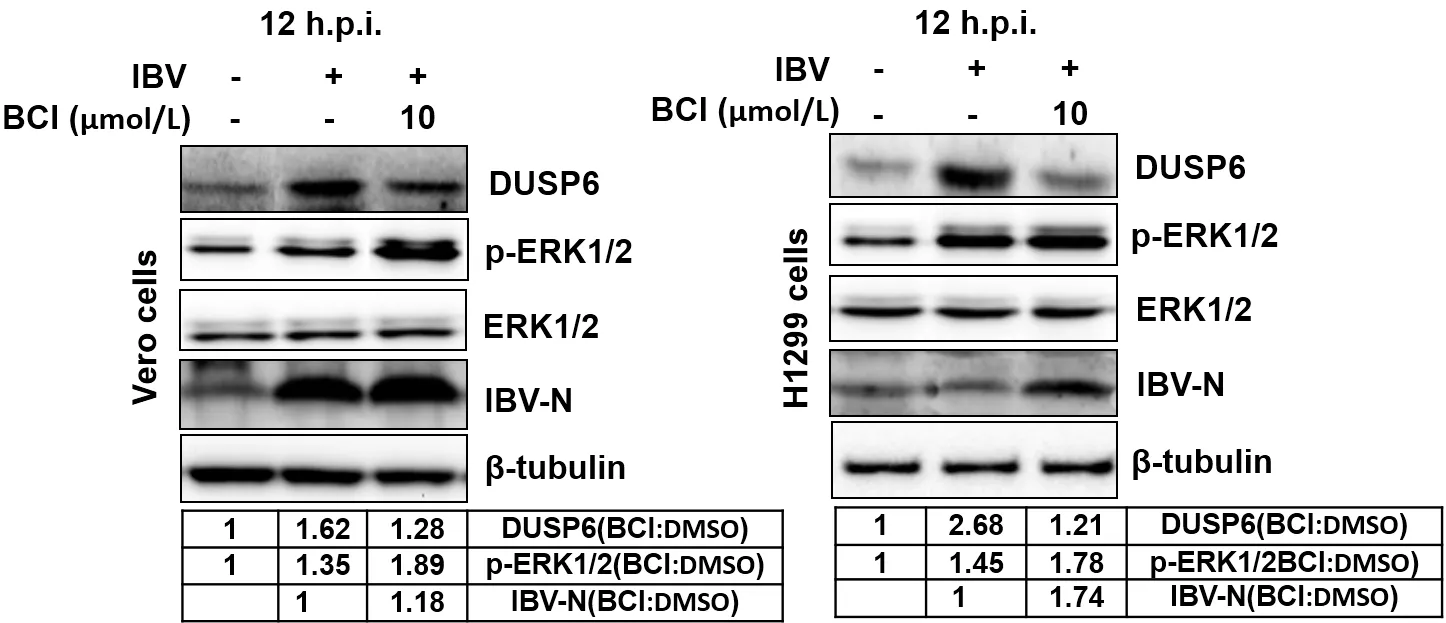
图5 DUSP6抑制剂BCI影响IBV-N的表达Fig.5 DUSP6 inhibitor BCI dampened the expression of IBV-N

图6 siDUSP6抑制IBV-N的表达Fig.6 siDUSP6 inhibited the expression of IBV-N
3 讨论
在众多信号转导途径中,ERK1/2通路几乎参与了所有的细胞活动[2,13-14],因此,ERK1/2能够影响细胞的生理环境。在病毒生命周期的入胞、病毒基因转录、蛋白质表达或子代病毒粒子释放等过程,ERK1/2均发挥重要作用[15-17]。病毒感染细胞激活ERK1/2是一个普遍现象,通常有利于病毒增强自身的感染,例如:ERK1/2因其调节HIV感染性而被定性为病毒相关激酶[18],ERK1/2的激活是肠道病毒71和痘病毒有效复制所必需的[6,19]。然而,也有研究表明,某些病毒可在细胞ERK1/2磷酸化水平低下时发生病毒感染或持续性感染,例如:单纯疱疹病毒可利用病毒自身编码的Us3丝氨酸/苏氨酸蛋白激酶抑制ERK1/2的活性调节MAPK信号通路的激活[20],登革热病毒2型感染细胞不能引起ERK1/2的磷酸化,甚至抑制ERK1/2的活性[21]。因此,针对ERK1/2信号通路,不同的病毒采取了不同的策略,来帮助自身感染。
本研究发现,IBV感染能够激活ERK1/2信号通路,引起ERK1/2的持续磷酸化。用药物U0126抑制ERK1/2的磷酸化,能够明显减少IBV-N的表达,此结果在H1299和Vero细胞中均得到了验证,说明ERK1/2的磷酸化有利于IBV感染和增殖。
双特异性磷酸酶家族(DUSPs),是蛋白酪氨酸磷酸酶的一个子类,属于有丝分裂原活化蛋白激酶(MAPK)磷酸酶家族,主要参与反馈性负向调控MAPK型号通路活性[11,22]。在先前的报道中,我们发现DUSP1在IBV感染过程中被上调表达,负向调控p38信号通路,减少炎症因子的产生[9]。此家族的另外一个磷酸酶DUSP6,定位于细胞质中,可以靶向性去磷酸化p-ERK1/2的酪氨酸或丝氨酸/苏氨酸磷酸基团而使其失活[10-11]。在本研究中,我们发现IBV感染能够促进DUSP6的上调表达。用DUSP6抑制剂BCI抑制其活性,或者用siRNA干扰其表达,降低此磷酸酶的功能,能够导致ERK1/2的磷酸化持续累积,同时有利于IBV病毒蛋白的表达。以上结果说明,在IBV感染过程中,DUSP6的上调表达能够负向调控ERK1/2的活性,且不利于病毒复制增殖,其有可能是宿主细胞的抗病毒反应策略之一。
综上,我们认为ERK1/2是影响IBV感染和复制的胞内信号之一。IBV感染后促进DUSP6的表达,去磷酸化p-ERK1/2,是细胞本身对信号通路的反馈性调节机制,同时发挥抗感染的作用。然而,ERK1/2促进病毒蛋白表达的具体机制,尚不清楚,将是以后研究的方向。
