Btk/NF-κB信号通路在视神经脊髓炎谱系疾病中变化及意义
2019-09-05王素欢李世平侯慧清吴冰洁
王 炜,王素欢,李世平,侯慧清,杨 静,吴冰洁,董 梅
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)是体液免疫为主的中枢神经系统(central nervous system,CNS)自身免疫性疾病,反复发作,主要侵犯视神经和脊髓,是青壮年致残的重要原因之一。
水通道蛋白4(Aquaporin 4,AQP4)抗体(AQP4-Ab)是由B细胞产生的NMOSD特异性抗体,B细胞是疾病发生的重要参与者。B细胞的活化、增殖和分化主要受B细胞抗原受体(B cell antigen receptor,BCR)信号通路调控。当BCR受到抗原或B细胞活化因子刺激后,将信号传至胞内,胞质中多种蛋白酪氨酸激酶可激活下游效应器,其中很重要的一种激酶就是Bruton酪氨酸激酶(bruton’s tyrosine kinase,BTK),它是B细胞发育成熟并行使免疫功能的关键因素,在炎症反应中发挥重要作用[1]。BTK首先激活与之紧密联系的磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K),产生“第二信使”,促进B细胞正常分化发育或参与炎症反应, PI3K通过激活核因子κB抑制蛋白激酶(inhibitor of nuclear factor kappa B Kinase,IKK),介导NF-κB核因子κB(nuclear factor kappa B,NF-κB)入核,NF-κB通过调控靶基因转录,影响B细胞增殖、分化和抗体产生,并促进炎症因子产生[2]。
B细胞可以分化为调节性B细胞(Breg)、浆细胞(产生抗体)及效应B细胞等不同细胞亚群,分泌多种抗炎和促炎因子,维持免疫平衡,而BTK/NF-κB 通路中相关各激酶异常可能是介导B细胞异常分化、导致免疫失衡的关键因素。 故本文拟通过测定NMOSD急性期患者与健康对照组中的BTK/NF-κB信号通路中BTK、NF-κB、PI3K、IKK mRNA表达水平,探讨其在NMOSD急性期的变化及对疾病可能的影响作用。
NMOSD患者长节段性横贯性脊髓炎(longitudinally extensive transverse myelitis,LETM)更常见,病灶多大于3个脊髓节段。AQP4-Ab血清阳性状态对孤立性LETM或视神经炎(optic neuritis,ON)患者具有重要的预后和治疗意义[3]。故本文通过检测NMOSD急性期患者AQP4-Ab血清阳性与否及其滴度水平,及脊髓MRI中受累节段数,探讨AQP4-Ab对脊髓受累的影响。
1 材料和方法
1.1 研究对象 选取2018年1月-2019年1月就诊于河北医科大学第二医院东院区神经内科的33例急性期视神经脊髓炎谱系疾病患者为实验组[急性期:患者出现新的神经系统症状体征,持续时间大于24 h不缓解,扩展残疾状态量表(Expanded Disability Status Scale,EDSS)评分增加≥1分],同期选取性别、年龄相似的33位健康志愿者作为对照组。所有患者均经由我科主治及以上资质的医师诊断,符合最新NMOSD指南制定的诊断标准。本实验征得研究对象或家属同意后签署知情同意书后进行,所有患者在给予任何免疫治疗前抽取外周血。
1.2 标本采集 所有受试对象征得知情同意后,抽取空腹急性期激素治疗前静脉血2 ml,置于EDTA管中,1500 rpm,离心5 min,分离出血细胞。将血细胞用PBS以1∶1的比例稀释,将稀释的血细胞缓缓加入5 ml的Ficoll淋巴细胞分离液的上方,置于离心机中2000 rpm密度梯度离心20 min,离心管第二层云雾状细胞层为单个核细胞层。吸取第二层云雾状细胞于新的离心管中,加入细胞洗涤液12 ml,摇匀后以1500 rpm离心10 min,舍弃上清液去沉淀得外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)悬液。将其分为两份,分装于EP管内,每管细胞数大致相当,约1×106个。而后将PBMCs悬液分别存于-80 ℃冰箱保存备用。
1.3 研究方法
1.3.1 临床资料收集 记录所有研究对象的基本信息,包括:姓名、性别、年龄、病程、EDSS评分,复发次数,血AQP4-Ab结果、脊髓MRI平扫及强化结果,依据强化结果确定此次发病的脊髓受累节段数。
1.3.2 采用SYBR GreenⅠReal Time PCR方法进行检测人外周血PBMCs中BTK、NF-κB、PI3K、IKK的mRNA含量,实验操作按产品说明书进行。
1.3.2.1 Real Time PCR检测目的基因引物在北京Invitrogen公司合成。
1.3.2.2 提取样本总RNA采用TRNzol总RNA提取试剂提取样本RNA,使用NanoDrop®ND-2000测定RNA浓度和纯度。
1.3.2.3 逆转录合成cDNA采用PrimeScriptTMRT reagent Kit with gDNA Eraser进行,具体操作如下:(1)去除基因组DNA反应,于冰上配制反应混合液,5×g DNA Eraser Buffer 2.0 μl,gDNA Eraser 1.0 μl,Total RNA 1 μg,RNase Free H2O Up to 10 μl,42 ℃孵育2 min;(2)反转录反应:上述反应液加入PrimeScript RT Enzyme Mix Ⅰ 1.0 μl,RT Primer Mix 1.0 μl,5×PrimeScript Buffer 2 4.0 μl,RNase Free H2O 4.0 μl,共20 μl,37 ℃孵育15 min,之后放入85 ℃ 5 s,cDNA保存至-20 ℃冰箱备用。
1.3.2.4 Real Time PCR样本检测 将所有cDNA样品分别配置RT-PCR反应体系。体系配置如下:2 × Master Mix 10 μl,10 μmol的PCR特异引物F 0.5 μl,10 μmol 的PCR特异引物R 0.5 μl,加水至总体积为18 μl 5000 rpm短暂离心;将18 μl混合液、2 μl cDNA依次加入96-PCR板对应的每个孔中,粘上封口膜,混匀,置于冰上;将96-PCR板置于Realtime PCR仪上,以95 ℃,30 s;40个PCR循环[95 ℃,5 s;60 ℃,40 s(收集荧光)]。建立PCR产物的熔解曲线,从60 ℃缓慢加热到99 ℃来进行PCR反应。将目的基因和内参分别进行Realtime PCR反应,每个样本进行3个复孔检测。仪器自动汇总荧光值后进行分析。
1.3.3 血液AQP4-Ab水平测定 患者抽取的柠檬酸钠管静脉血送至北京协和医院行免疫组化染色法测定AQP4-Ab水平。
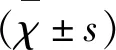
2 结 果
2.1 研究对象的一般资料 NMOSD患者共33例,女性30例,男性3例,发病年龄19~67(42±14.75)岁;患者均符合NMOSD诊断标准,EDSS评分2.0~9.0分,中位数为3.5分,四分位数间距为2.8分,复发患者占69.70%。行脊髓MRI平扫及强化检查24例,脊髓MRI受累阶段数0~17(5.67±4.36),累及颈段、上胸段23例,累及下胸段、腰段4例,受累节段≥3个椎体节段17例;行AQP4-Ab水平检测25例,女性23例,男性2例,AQP4-Ab阳性率80%;对照组33例,各组间在性别、年龄方面无统计学差异。
2.2 NMOSD急性期患者与健康对照组BTK、PI3K、IKK、NF-κB mRNA水平相比明显升高,差异有统计学意义(P<0.05)(见图1~图4)。
2.3 NMOSD急性期患者AQP4-Ab阳性者较阴性者脊髓受累节段数多,差异有统计学意义(P<0.05);AQP4-Ab滴度与脊髓受累节段数无线性相关关系(P>0.05)(见图5、图6)。

图1 NMOSD急性期患者为病例组,健康者为对照组,两组血液PBMCs中BTK mRNA对数水平比较,病例组明显增高P<0.05
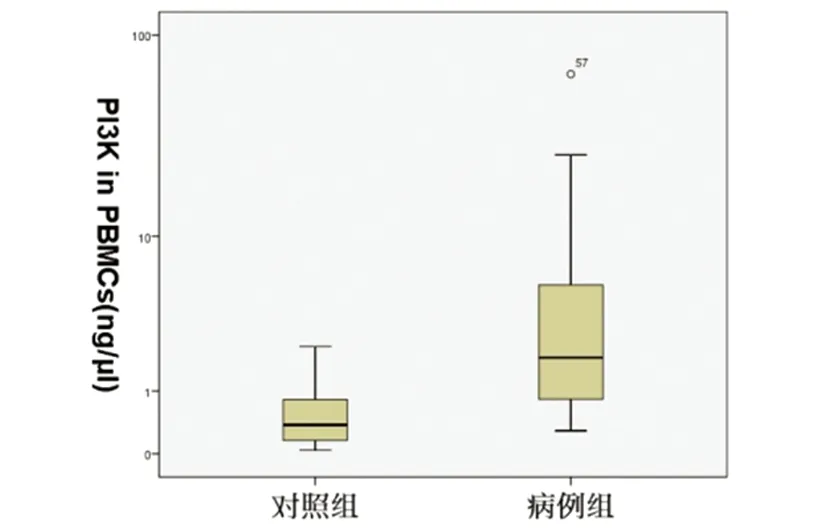
图2 NMOSD急性期患者为病例组,健康者为对照组,两组血液PBMCs中PI3K mRNA对数水平比较,病例组明显增高P<0.05

图3 NMOSD急性期患者为病例组,健康者为对照组,两组血液PBMCs中IKK mRNA对数水平比较,病例组明显增高P<0.05
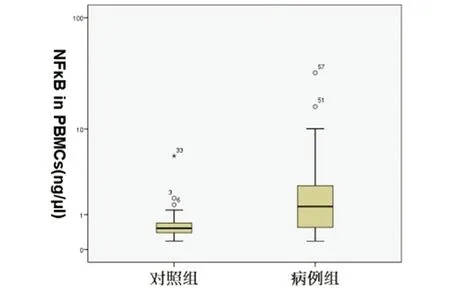
图4 NMOSD急性期患者为病例组,健康者为对照组,两组血液PBMCs中NF-κB mRNA对数水平比较,病例组明显增高P<0.05

图5 NMOSD急性期患者血清AQP4-Ab阳性为阳性组,阴性为阴性组,两组脊髓MRI受累节段数比较,阳性组明显增高P<0.05
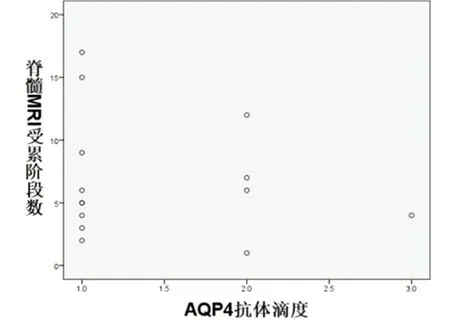
图6 NMOSD急性期患者血清AQP4-Ab阳性组中抗体滴度与脊髓MRI受累节段数关系,无相关关系P>0.05
3 讨 论
B细胞是重要的体液免疫细胞,其功能异常时产生特异性AQP4抗体,并分泌多种炎症因子,导致NMOSD发生,但具体发病机制尚不清楚。BCR是B细胞特征性标志之一, BTK激酶是BCR信号通路重要组成部分,表达于B细胞。 BTK通过激活下游核转录因子PI3K、 IKK、NF-κB信号通路,参与调控B细胞,介导B细胞成熟、增殖、分化,发挥免疫保护功能。研究表明,BTK/NF-κB信号通路中不同激酶异常激活后,参与自身免疫性疾病发生,但B细胞在NMOSD发病中的作用机制尚不清楚。
B细胞表达BTK增高可能会引起对BCR刺激的高度反应,而BCR信号通路的活化可以引起NF-κB信号通路的活化以及抵抗Fas介导的凋亡,引起B细胞活化和分化异常,从而参与的发病过程。类风湿关节炎(rheumatoid arthritis,RA)及原发性干燥综合征(primary sjogren’s syndrome,PSS)患者的B细胞中,BTK蛋白和磷酸化BTK显著增加[4]。系统性红斑狼疮(systemic lupus erythematosus,SLE)患者外周血BTK过表达会导致SLE样疾病,产生自身抗体[5]。本研究表明,NMOSD患者急性期外周血PMBCs中BTK mRNA较对照组明显升高,提示其参与了NMOSD发病。应用BTK抑制剂可显著减缓SLE、RA的进展[6]。BTK抑制剂Ibrutinib可显著降低小鼠CNS小胶质细胞和AS激活及促炎因子产生,改善CNS炎症反应[7]。
PI3K激活的信号通路在协调促炎和抗炎通路等方面具有重要作用。PI3Kδ和PI3Kγ可作为抗炎治疗的潜在靶点[8],减轻SLE小鼠模型的疾病进展[9]。本研究中,PI3K mRNA在NMOSD患者中显著升高,提示其参与了促炎病程。有数据显示临床试验和临床前小鼠模型表明,抑制PI3K/Akt信号通路可避免肿瘤恶化,及CNS炎症和疾病进展[10]。
IKK、NF-κB是连接促炎信号通路与细胞存活、增殖和细胞因子产生的信号通路的中心枢纽。IKK是介导NF-κB通路激活的重要环节,NF-κB入核调控基因表达[11],NF-κB在炎症和自身免疫疾病中通过过度表达效应分子导致疾病进展[12]。IKKε可促进RA发展和炎症发生[13]。在SLE小鼠模型中,抑制IKK/NF-κB通路,可减轻小鼠肾脏损伤[14]。Lee[15]等提出IKK/NF-κB诱导骨髓细胞活化,加剧EAE病情,特异性抑制剂可能将作为MS的免疫疗法。Yang[16]等检测NMOSD患者中IKK通路下的NF-κB基因表达较MS与正常对照组增高,与本研究一致。 由于多种刺激能激活NF-κB信号通路, 故必须精确控制NF-κB活性, 避免异常的免疫应答。 研究表明抑制BTK、NF-κB信号通路可显著控制炎症和减轻疾病[17,18]。
NMOSD典型的脊髓病变多累及3个或以上椎体节段,尤其是颈、胸段[19]。AQP4-Ab血清阳性患者比阴性患者脊髓损伤程度可能更为明显[20]。多项研究提出AQP4-Ab阳性LETM的NMO转化率较高,AQP4-Ab血清水平与脊髓损伤长度、大于3个节段以上病变的存在之间存在相关性[21,22]。本研究中,血清AQP4-Ab检测阳性患者脊髓受累节段多于阴性患者,且≥3个节段者占70.83%,病灶多广泛,多有脊髓肿胀,与多数研究者报道一致。而血清AQP4-Ab抗体滴度与脊髓受累节段数无线性相关关系,Isobe[23]等学者根据不同检测方法均未发现AQP4-Ab滴度与临床参数的相关性,与本研究一致,分析可能与一些患者体内AQP4-Ab滴度虽高但此次发病与ON有关而非脊髓炎。Kessler[24]等多中心队列研究表明AQP4-Ab滴度对NMOSD患者临床病程无预测作用。
本研究表明,NMOSD患者急性期外周血B细胞BTK、NF-κB、PI3K、磷酸化IKK表达水平较健康人明显增高,表明BTK/NF-κB信号通路参与了NMOSD急性期B细胞的增殖、分化、抗体产生及炎症的发生,可能在NMOSD发病中具有重要的作用,为寻找新的治疗靶点提供了理论基础。另外,NMOSD患者血清AQP4-Ab阳性可能提示脊髓受累节段较广泛。
