苹果白绢病防治药剂的筛选及使用方法
2019-09-04高常燕李栋李保华张俊丽董向丽
高常燕 李栋 李保华 张俊丽 董向丽
摘要 白絹病是苹果苗期和幼树期的重要病害,可导致死树和死苗。为了筛选有效的杀菌剂,提供有效的病害防控技术,通过花盆土壤施药、撒施药土等方法测试了9种杀菌剂和生石灰对白绢病菌的抑制效果。结果表明,95%甲基立枯磷 TC和99%噁霉灵TC两种药剂能有效抑制白绢病菌的生长和菌核的形成,抑制率在80%以上;25 g/L咯菌腈FSC和45%抑菌脲SC对白绢病菌的生长和菌核形成也有抑制效果,但其抑制率不足50%。9种杀菌剂都不能杀死菌核中的病菌。生石灰能有效抑制白绢病菌生长扩展,其抑菌范围超过5 cm,但不能抑制病菌形成菌核。将生石灰撒于根围或土表,或混入育苗基质、锯末或土壤中,可预防苹果苗期和幼树期的白绢病。甲基立枯磷和噁霉灵可用于苗木消毒、浇施、地面喷雾或随滴灌使用。
关键词 苹果白绢病; 药剂筛选; 防治方法
中图分类号: S 436.611.1+9
文献标识码: B
DOI: 10.16688/j.zwbh.2018114
苹果白绢病(southern blight of apple tree)是苹果树的重要病害,苗木和幼树受害严重[1]。受害树体叶片变黄,新生叶片小,叶缘卷曲,节间缩短,最终枝干失水皱缩,继而整株死亡[23]。病部菌丝层产生褐色油菜籽状菌核[4]。白绢病菌为无孢菌目的齐整小核菌Sclerotium rolfsii Sacc[5],有性态是担子菌门的罗耳阿太菌Athelia rolfsii,自然条件下不常见[6]。菌丝白色,有绢丝般光泽,羽毛状,呈放射状扩展;菌核初为白色,后至淡黄色,成熟菌核为深褐色,油菜籽状,大小不等,一般在0.5~3 mm之间[68]。除危害苹果外,白绢病菌还危害柑橘、油桐、油茶、核桃等多种木本植物,以及花生、甘薯、大葱、辣椒等多种农作物[6,914]。
近年来,随苹果矮砧密植栽培模式的大面积推广和苗木的频繁调运,白绢病的危害逐年加重,部分苹果园和苗圃每年因白绢病导致死树达10%以上[15]。白绢病菌寄主范围广,菌核能在土壤中长期存活[16],导致土壤带菌量大。病菌菌核在土壤中萌发后很快扩展至苹果树的根茎部,沿根茎向下扩展,并很快环绕树体根茎部,形成白色菌丝层,侵入枝干皮层内,严重时造成皮层腐烂。树体发病早期不易发觉[12],当地上部出现明显症状时,树体已进入垂死状态,难以救治。
生产上对苹果树白绢病的防治以发病后灌药治疗,或春季根部灌药预防为主。例如,在发病初期,将根茎处土扒开,用50%多菌灵WP灌根[15],或在早春用2%硫酸铜溶液[2]浸透浅层根部,以抑制土壤中病原菌生长扩展。对于花生白绢病,生产上也采用25%咯菌腈FSC进行拌种或灌根处理[1718]。由于有关白绢病的防治药剂研究报道很少,药剂的选择存在盲目性,上述措施都难以有效控制病害的发生。
本试验测试了9种药剂和生石灰对白绢病菌的抑菌和杀菌效果,研究了不同施药方法对苹果白绢病的防治效果,旨在为苹果树白绢病的防治提供药剂和防控方法。
1 材料与方法
1.1 供试病菌及杀菌剂
2016年8月从山东省沂源县的一个果园选择感染白绢病的苹果幼树,连根拔起,从根茎部挑取菌丝转入马铃薯葡萄糖琼脂(PDA)培养基中,25℃下培养2 d,用直径0.8 mm的毛细管从菌落边缘挑取单菌丝,获得纯培养菌种,在4℃冷藏柜中保存。使用前将保存菌种转接到PDA中,25℃下活化培养2 d,从菌落边缘打取菌饼,用于接种。
取适量大麦粒洗净,在清水中浸泡2 h,分装到250 mL的三角瓶中,每瓶70 g,加入12%的蜂蜜水12.5 mL,2%的蛋白胨水溶液12.5 mL,121℃灭菌1 h备用。打取12个直径5 mm白绢病菌菌饼,均匀地混入大麦粒中,25℃下培养,培养期间每隔2 d摇瓶1次,使病菌能更充分地接触大麦粒;2周后获得染有白绢病菌的大麦粒。
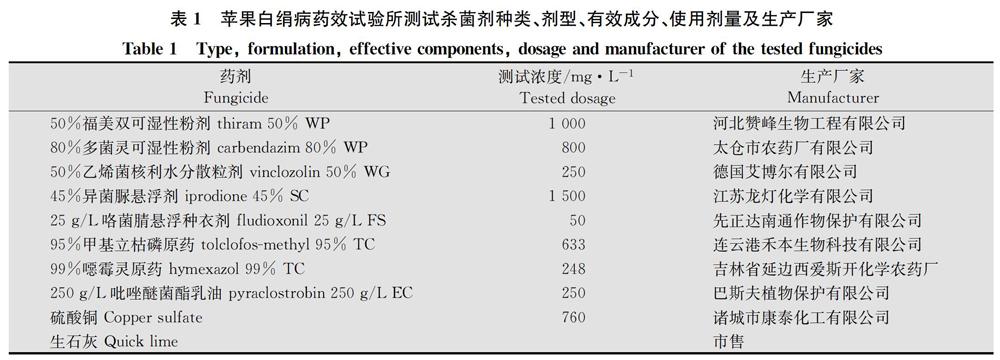
选取生产上常见的9种杀菌剂和生石灰作为供试药剂,测试浓度为厂家推荐浓度(表1)。
1.2 9种杀菌剂对菌丝生长和菌核形成的抑制效果
将草炭土与田土按体积比1∶1混合,制成培养基质,装入口径15 cm,高13 cm的花盆中,每盆1 L左右,压平压实。以清水为对照,每种药剂2盆,全部试验共20盆。将药剂配成相应浓度(表1)的药液,每盆浇施500 mL药液,使药液浸透盆内基质。每盆均匀放置6个带菌大麦粒,将大麦粒压入基质内,一半露在表面。将花盆放入塑料袋中密封,保持袋内相对湿度在95%以上,转入25℃的恒温箱中培养。24 h 后检查能够萌发出菌丝的大麦粒的数量,5 d后测量大麦粒周围所形成的菌落直径,并记录大麦粒上及菌落内产生的菌核数量。当带菌大麦粒上或菌落内菌丝集结形成质密的白色球状菌丝组织时,记为1个菌核。全部试验在不同的时间重复3次。杀菌剂对菌丝生长和对菌核形成的抑制率按如下方法计算:
菌丝生长抑制率=(对照组菌落平均直径-处理组菌落平均直径)/对照组菌落平均直径×100%;
菌核形成抑制率=(对照组菌核平均数量-处理组菌核平均数量)/对照组菌核平均数量×100%。
1.3 9种杀菌剂对病菌的致死效果
将草炭土和田土按体积比1∶1混合,装入口径15 cm,高13 cm的花盆中,每盆1 L左右。将100个带菌大麦粒均匀混于基质中。将9种药剂按照厂家推荐浓度(表1)配制成药液,每个花盆浇施500 mL,每种药剂处理3盆。以清水为对照,室外自然条件下放置。分别于1、2、3和4周时从每个花盆中取出10个大麦粒,用清水充分清洗,然后转入PDA培养基上25℃条件下培养,24 h和72 h后检查大麦粒上有无白绢病菌菌丝长出,若有菌丝长出,表明大麦粒中的菌丝仍然存活,并依此计算杀菌剂对白绢病菌的致死效果。
杀菌率=(对照组产生菌丝的大麦粒数平均值-处理组产生菌丝的大麦粒数平均值)/对照组产生菌丝的大麦粒数平均值×100%。
1.4 药土对白绢病菌生长的抑制和阻隔效果
将草炭土与田土按1∶1比例混合,装入直径15 cm的培养皿中,每皿250 mL,浇透水,中央放置2个带菌的大麦粒,并紧靠在一起。试验药剂为95%甲基立枯磷TC、50%福美双WP、生石灰与硫酸铜混合物、生石灰4种。95%甲基立枯磷TC设3个浓度处理:950、4 750和9 500 mg/L,每个浓度配100 mL药液;50%福美双WP设3个浓度处理:500、2 500和5 000 mg/L,每个浓度配100 mL药液;生石灰与硫酸铜的混合物设3个配比,即100 mL水中加入10 g生石灰,配成石灰乳,然后分别加1 g、5 g和10 g硫酸铜,并充分混匀。将100 mL药液与250 mL土壤混合制成药土,将药土撒施于培养皿近边缘处,药土距离带菌大麦粒5~7 cm。生石灰处理则直接将10 g生石灰粉撒于培养皿边缘。全部试验共设10个药剂处理,以清水为对照,每处理5个培养皿。将培養皿密封,转入25℃的恒温箱中保湿培养5 d,测量带菌大麦粒形成菌落的直径,记录每个带菌大麦粒周围菌落内形成菌核的数量,计算杀菌剂对菌丝生长和对菌核形成的抑制率。全部试验在不同时间重复3次。
1.5 盆栽药效试验
盆栽药效试验设置95%甲基立枯磷TC 633 mg/L、99%噁霉灵TC 248 mg/L和生石灰3个药剂处理,以清水为对照,接种病菌的位置设置两个,即在基质内和在基质表面。全部试验共8个处理,每处理设置1个50 cm×35 cm×25 cm的育苗穴盘,每个穴盘内扦插12支直径为0.5~1.0 cm、长度为30 cm的苹果矮化自根砧品种‘M9T337的枝段。全部试验重复3次。
将草炭土与田土按1∶1比例混合,装入育苗盘内,压实,厚度20 cm。在每个盘中均匀扦插12枝‘M9T337枝段,枝段与枝段相距10 cm以上。在离枝段3 cm和6 cm处分别摆放2圈带菌的大麦粒,每圈4粒,作为接种病菌。接种病菌后,再均匀撒入一层基质,压实,厚度为2 cm,作为病菌在基质内的处理。以不撒基质,病菌直接露在基质表面作为病菌在基质表面的处理。将甲基立枯磷与噁霉灵按推荐浓度配好后,均匀浇于枝段周围,形成一个半径4.0 cm的施药圈,药剂用量为30 mL。生石灰处理将生石灰直接撒施于枝段周围形成半径4.0 cm的石灰圈,生石灰用量为2 g。将处理枝段放置在室外(20~30℃),每天喷淋浇水,保持基质湿润,上方遮盖黑色园艺地布,防止阳光直射。2周后,将全部枝段取出,检测枝段上有无白绢病菌的菌丝。若有菌丝,表明该枝段已受白绢病菌侵染。药剂防治效果按如下公式计算:防治效果=(对照组受侵染枝段数-处理组受侵染枝段数)/对照组受侵染枝段数×100%。
1.6 数据分析
以每个带菌大麦粒萌发后生长形成菌落的直径、菌核的数量、每个培养皿中有存活菌丝的大麦粒数量和受侵染的枝段数量为基本数据单元,采用通用线性模型(GLM)进行方差分析,假设菌落直径和菌核数量呈正态分布,有存活菌丝的大麦粒数量和受侵染的枝段数量为二项分布,在GLM模型中选用gaussian和binomial分布函数。用multcomp模块中的glht函数对GLM的预测值进行多重比较,判定杀菌剂对病菌生长、菌核形成的抑制效果和药剂对白绢病的防治效果。全部的数据分析在R统计软件中完成。在方差分析之后,以每个处理的平均值计算药剂的抑菌效果。
2 结果与分析
2.1 9种杀菌剂对白绢病菌菌丝生长和菌核形成的抑制效果
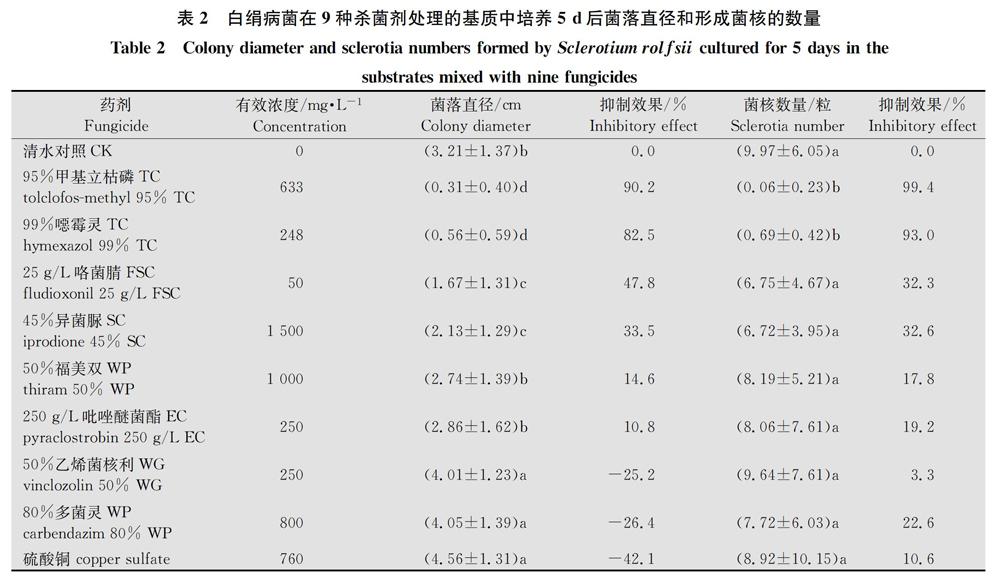
带菌的大麦粒在用杀菌剂处理的基质中培养1 d后,除633 mg/L的95%甲基立枯磷TC和248 mg/L的 99%噁霉灵TC两个药剂浓度处理外,其他处理中,约79.0%的带菌大麦粒能萌发长出明显的菌丝。在25℃下培养5 d后,药剂处理的带菌大麦粒所形成菌落的直径最大为7.0 cm(硫酸铜),单个大麦粒所形成菌落内产生菌核的数量最多可达44粒(硫酸铜)。在未施药的清水处理基质中,36个大麦粒所形成菌落直径的平均值为(3.21±1.37)cm,每个菌落所形成菌核数量平均值为(9.97±6.05)粒(表2)。
在633 mg/L的95%甲基立枯磷TC和248 mg/L的99%噁霉灵TC处理的基质中,白绢病菌菌落直径分别为(0.31±0.40)和(0.56±0.59)cm,显著小于清水处理和其他7种药剂处理的菌落直径,每个菌落内所形成菌核数量分别为(0.06±0.23)和(0.69±4.17)粒,也显著少于清水处理和其他药剂处理中每个菌落所形成的菌核数量(表2),说明95%甲基立枯磷TC和99%噁霉灵TC能显著抑制白绢病菌菌丝生长和菌核的形成。在50 mg/L的25 g/L咯菌腈FSC和1 500 mg/L的45%异菌脲SC处理的基质中,白绢病菌菌落的直径显著小于清水处理基质中菌落的直径,每个菌落形成的菌核数量与清水处理中的菌核数量无显著差异,说明这两种药剂对菌丝生长有显著的抑制作用,但不能抑制菌核的形成。在250 g/L吡唑醚菌酯EC和50%福美双WP处理的基质中,菌落直径和每个菌落形成菌核数量都与对照无显著差异,表明其对菌丝生长和菌核形成均无抑制作用。在800 mg/L的80%多菌灵WP、250 mg/L的50%乙烯菌核利WG和760 mg/L硫酸铜处理基质中,菌落生长的直径分别为(4.05±1.39)、(4.01±1.23)和(4.56±1.31)cm,显著大于清水处理中形成菌落的直径;每个菌落所形成的菌核数量分别为(7.72±6.03)、(9.64±7.61)和(8.92±1015)粒,与对照无显著差异(表2),说明这三种杀菌剂对菌核形成无作用,且能够促进菌丝生长。
2.2 9种杀菌剂对病菌的致死效果
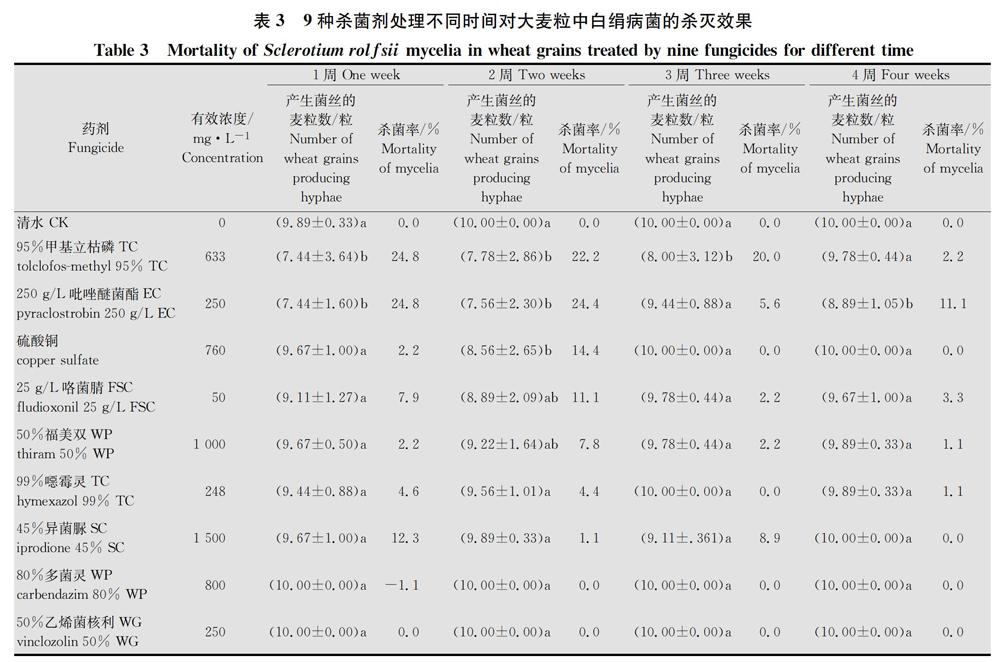
将带菌大麦粒从杀菌剂处理过的基质中取出,接种到PDA上培养24 h后,绝大部分大麦都能萌发长出典型的白绢病菌的菌丝。只有633 mg/L的95%甲基立枯磷TC和250 mg/L的250 g/L吡唑醚菌酯EC两种药剂处理的基质中有少量大麦粒没有萌发产生菌丝,与清水对照存在显著差异(P<0.05)。其他7种药剂处理基质中大麦粒携带的病菌存活率都接近100%,与清水处理没有显著差异。培养72 h后,所有药剂处理基质中的大麦粒均长出白绢病菌的菌丝,大麦粒中的病菌存活率达100%,与对照无差异。这表明,95%甲基立枯磷TC和250 g/L吡唑醚菌酯EC两种药剂也只是对大麦粒表面或浅层的病菌有杀灭效果,而不能杀灭大麦粒内部的菌丝(表3)。
2.3 药土对白绢病菌生长的抑制和阻隔效果
在撒施生石灰,以及生石灰与硫酸铜的混合物配制药土的处理中,白绢病菌不能在基质中生长,没有形成明显的菌落或仅形成微小菌落,但病菌能在大麦粒上生长,形成大量菌核,且其数量显著高于对照所形成的菌核数量(P<0.01)(表4)。
95%甲基立枯磷TC配制的药土能有效抑制白绢病菌的生长,但不能抑制菌核的形成。95%甲基立枯磷TC 3个浓度处理中大麦粒所形成菌落的直径分别为(2.62±2.77)、(2.87±1.95)和(3.33±1.65)cm,显著小于(P<0.05)清水处理中带菌大麦粒所形成的菌落直径(6.96±2.95)cm。带菌大麦粒在50%福美双WP配制的药土中所形成菌落的直径和菌核数量与对照都无显著差异,表明50%福美双WP配制的药土既不能抑制白绢病菌的菌丝生长,也不能抑制白绢病菌形成菌核(表4)。
2.4 盆栽药效试验
在距离扦插枝段3 cm和6 cm的基质内部和表面接种白绢病菌,经2周的培养,对照处理分别有11个和12枝段受到白绢病菌的侵染,侵染率分别为30.5%和33.3%。浇施95%甲基立枯磷TC(633 mg/L)和99%噁霉灵TC(248 mg/L)处理的枝段没有受白绢病菌的侵染,防治效果达100%。在根茎部撒施生石灰的处理,各自有2个枝段受白绢病菌的侵染,侵染率为5.5%,与对照有显著差异,防治效果分别为达81.8%和83.3% (表5)。
3 讨论
本试验所测试的9种杀菌剂中,95%甲基立枯磷TC和99%噁霉灵TC两种药剂能有效抑制白绢病菌的生长和菌核的形成,抑制率大于80%,在实际生产中可用于白绢病的防控,但药剂需直接接触病菌才能发挥其应有的效果。25 g/L咯菌腈FSC和45%异菌脲SC两种药剂虽然对白绢病菌的生长和菌核形成也有一定的抑制效果,但抑制率不足50%。其他5种药剂不但不能有效抑制白绢病菌的菌丝生长和菌核形成,部分药剂还能促进病菌的生长。
白绢病菌很容易形成菌核,菌核是白绢病菌的主要初侵染菌源,而成熟的菌核具有极强的抗逆能力,在土壤中能长期存活,存活时间长达5~6年[15]。本试验所测试的9种杀菌剂都不能有效杀灭大麦粒中的白绢病菌,推测也难以杀死白绢病菌的菌核或菌核内的白绢病菌。因此,在生产实践中难以通过杀菌剂消灭在土壤中长期存活的菌核。
白绢病菌喜酸性环境,菌核萌发和菌丝生长需要pH为4~7的环境[16],弱碱性环境能抑制病菌菌丝生长[17]。生石灰作为一种安全经济的材料常用来改良土壤,调节土壤的酸碱度,用于土壤消毒。本研究发现,虽然生石灰不能杀灭白绢病菌,而且能促进病菌形成大量菌核,却能有效抑制白绢病菌的菌丝生长,而且能有效抑制5 cm以外的白绢病菌的菌丝生长,能有效防止病菌接近树体根茎部,其效果优于95%甲基立枯磷TC。在实际生产中可用于处理土壤以预防白绢病的发生。生石灰与硫酸铜的混合物也能有效抑制白绢病菌的生长,其抑菌效果不及生石灰,实际生产中不建议使用。
苹果白绢病主要发生在6—8月高温多雨季节。对于有白绢病菌或已发生白绢病的果园或苗圃,于雨季之前,在果园土表或围绕根茎部撒施生石灰,可有效预防白绢病菌侵染树体和苗木;在降雨或浇水后,立即撒施生石灰也能有效预防白绢病的发生;在土壤或育苗基质中拌施生石灰,虽不能杀菌白绢病菌,但可抑制病菌扩散到达寄主植物,预防白绢病的发生。95%甲基立枯磷TC和99%噁霉灵TC对白绢病菌的生长和菌核的形成也有很好的抑制效果,可用于苗木消毒、浇施、地面喷雾或随滴灌使用。
參考文献
[1] 杨宇红,刘勇.防治白绢病的特效药剂根霉灵的研制及药效试验[J].湖南农业科学,1996(6):31.
[2] 阎守忠.苹果树白绢病发生规律及对策[J].烟台果树,1997(1):4445.
[3] 宋开平.果树上使用农药的技术[J].落叶果树,1996(2):39.
[4] 刘永杰,王延兵,宋炜.苹果根腐病的识别与综合防治技术[J].河北农业,2017(9):4546.
[5] PUNJA Z K,GROGAN R G. Hyphal interactions and antagonism among field isolates and single basidiospore strains of Athelia (Sclerotium) rolfsii[J]. Phytopathology, 1983, 73(9): 12791284.
[6] 金苹, 高晓余. 白绢病的研究[J]. 农业灾害研究, 2011, 1(1): 1422.
[7] PUNJA Z K, ADAMS G C. Influence of nutrition, environment and the isolate, on basidiocarp formation, development, and structure in Athelia (sclerotium) rolfsii[J]. Mycologia, 1982, 74(6): 917926.
[8] 过赋文,张绍升.烟草白绢病病原鉴定及生物学特性[J].安徽农业科学,2015,43(35):184186.
[9] 宋国华,吴微微.花生白绢病的发生规律与防治对策[J].辽宁农业职业技术学院学报,2008,10(1):12.
[10]游景茂,王磊,唐其,等.博落回白绢病的病原鉴定及防治[J].中国现代中药,2017,19(10):14291433.
[11]聂志钦,黎启明,陈忠,等.不同药剂防治辣椒白绢病田间效果试验[J].长江蔬菜,2016(4):8788.
[12]JOSEPH E, HEPPERLY P R. First report of southern blight of common barley in Puerto Rico [J].European Journal of Plant Pathology, 1995, 101(5): 497501.
[13]罗禄怡,沈仲宁,丁应生,等.三叶草白绢病的研究[J].中国草地,1996(1):6466.
[14]茹水江,王汉荣,王连平,等.白术白绢病病原生物学特性及其防治药剂筛选[J].浙江农业学报,2007(6):439443.
[15]主春福.沂水县矮砧苹果树白绢病暴发原因及防治措施[J].北方果树,2017(1):36.
[16]胡琼波.作物白绢病的研究进展[J].岳阳职工高等专科学校学报,2003(3):5860.
[17]楚发美,刘江山.防治苹果白绢病的试验总结[J].烟台果树,1994(2):29.
[18]李建涛,范怀峰,王建美,等.四种杀菌剂对花生白绢病菌的毒力及田间控制作用[J].中国油料作物学报,2013,35(6):686691.
(责任编辑:杨明丽)
