美人蕉黄斑驳病毒巢式PCR检测方法的建立
2019-09-04陈细红杨小龙廖富荣高芳銮沈建国
陈细红 杨小龙 廖富荣 高芳銮 沈建国

摘要 本文以我国台湾进境美人蕉病株为材料,根据已报道的美人蕉黄斑驳病毒Canna yellow mottle virus(CaYMV)基因序列设计2对特异性引物(外侧引物1对、内侧引物1对),建立了巢式PCR快速检测CaYMV的方法,并对进境的50份美人蕉样品进行了检测。结果显示,该方法特异性强,且灵敏度高于常规PCR,是常规PCR的1 000倍,表明该方法能够实现对CaYMV的快速、准确、灵敏检测,适用于口岸快速检测CaYMV。
关键词 美人蕉黄斑驳病毒; 巢式PCR; 检测
中图分类号: Q 503, S 41-30
文献标识码: A
DOI: 10.16688/j.zwbh.2018283
美人蕉Canna indica L.是美人蕉科Cannaceae美人蕉属Canna的一种多年生草本花卉,主要分布于热带和亚热带地区,具有一定的观赏价值和药用价值,在我国常作为一种园林观赏植物进行引种栽培[14]。美人蕉在生长过程中易受病毒侵染,国内外关于美人蕉病毒病的研究较少,目前已报道的美人蕉病毒有菜豆黄花叶病毒Bean yellow mosaic virus(BYMV)[5]、黄瓜花叶病毒Cucumber mosaic virus(CMV)、美人蕉矮化类病毒Canna stunt viroid[67]、美人蕉黄斑驳病毒Canna yellow mottle virus(CaYMV)[8]、美人蕉黄条病毒Canna yellow streak virus(CaYSV)[9]等。
美人蕉黄斑驳病毒(CaYMV)是美人蕉上的一种重要病毒,属于花椰菜花叶病毒科Caulimoviridae杆状DNA病毒属Badnavirus成员。其病毒粒体呈杆状,长约120~130 nm,直径约28 nm[10],基因组为不完全环状双链DNA,含3个开放阅读框(open reading frame,ORF)。该病毒最早出现在日本和美国中北部[1113],随后在意大利、荷兰[14]、印度[2]、肯尼亚[15]、中国[16]等国家陆续出现报道。CaYMV的寄主范围较窄,已报道的自然寄主为美人蕉。受侵染的美人蕉生长出现异常,典型症状为叶脉黄化,叶片、茎秆和花上出现条斑,组织逐渐坏死、变褐等,其观赏价值和经济价值均受到影响[1011]。CaYMV主要通过无性繁殖材料传播,可随美人蕉种苗的运输进行远距离传播,其传播介体尚未明确,且目前尚缺乏有效的防治该病的方法。
为有效降低CaYMV的传播和扩散,急需建立针对该病毒快速、灵敏的检测方法。国内外针对CaYMV检测方法的研究较少,沈建国等[10]报道了常规PCR检测该病毒的方法。与常规PCR相比,巢式PCR方法检测植物病毒具有更强的特异性和更高的灵敏度。张巧萍等[17]设计了凤仙花坏死斑病毒的特异性引物,建立了巢式PCR检测方法,提高了检测的灵敏度。闻伟刚等[18]通过建立烟草环斑病毒和番茄环斑病毒的半巢式RT-PCR检测方法,灵敏度较常规RT-PCR方法提高了10 000倍以上。本文以我国台湾进境美人蕉病株为材料,根据已报道的CaYMV基因序列设计了2对特异性引物(外侧引物1对、内侧引物1对),建立了巢式PCR快速检测CaYMV的方法,以期进一步提高检测灵敏度和准确性,以满足口岸快速、准确检测CaYMV的需要。
1 材料与方法
1.1 材料
CaYMV毒源为我国台湾进境的美人蕉病株。菜豆黄花叶病毒(BYMV)、黄瓜花叶病毒(CMV)以及番茄不孕病毒Tomato aspermy virus(TAV)的毒源(叶片)由本实验室保存。所有毒源均保存于-80℃冰箱中。
1.2 主要试剂
Plant Genomic DNA kit购自天根生化科技(北京)有限公司,2×Easy Taq PCR Supermix、TRIzol試剂购自北京全式金生物技术有限公司,随机引物、5×RT buffer、M-MuLV 反转录酶、RNasin、10 mmol/L dNTPs 购自Promega 公司,10×PCR Buffer、2.5 mmol/L dNTPs、MgCl2、Taq DNA 聚合酶购自TaKaRa 公司。
1.3 引物设计与合成
杆状DNA病毒属通用引物BadnaFP/BadnaRP:ATGCCITTYGGIAARAAYGCICC/CCAYTTRC-AIACISCICCCCAICC,目的片段576 bp[19]。
根据已报道的CaYMV基因序列设计2对特异性引物,外侧引物为:上游引物CaYMVF1:5′-TAG-GGCAGTCAAGGATTAAGC-3′;下游引物CaYMVR1:5′-CAATCTTGGCGTAGAACGAG-3′,预期扩增片段大小为540 bp。内侧引物为:上游引物CaYMVF2:5′-ACTGCGTCAGTTTCTCGG-3′;下游引物CaYMVR2:5′-GGCCTGGATCTCAGCATCTA-3′,预期扩增片段大小352 bp。引物委托生工生物工程(上海)股份有限公司合成。
1.4 总核酸的提取
利用Plant Genomic DNA kit提取样品总DNA,方法参照试剂盒说明书。
1.5 PCR鉴定
以提取的DNA为模板,PCR反应体系(25 μL)为:2×Easy Taq PCR Supermix 12.5 μL,无菌水8.5 μL,BadnaFP(10 μmol/L)1 μL,BadnaRP(10 μmol/L)1 μL,DNA 2 μL。扩增条件为:94℃预变性7 min;94℃变性30 s,50℃退火30 s,72℃延伸30 s,共40个循环;最后72℃延伸7 min。PCR产物在1.5%琼脂糖凝胶电泳。
1.6 巢式PCR检测
第一轮PCR以提取的DNA为模板,PCR反应体系(25 μL)为:10×PCR Buffer (Mg2+free) 2.5 μL,MgCl2(25 mmol/L)2.5 μL,dNTPs(2.5 mmol/L)2 μL,CaYMVF1(10 μmol/L)1 μL,CaYMVR1(10 μmol/L)1 μL,无菌水13.8 μL,Taq DNA聚合酶(5 U/μL)0.2 μL,DNA 2 μL。扩增条件为:94℃预变性3 min;94℃变性30 s,53℃退火45 s,72℃延伸1 min,共35个循环;最后72℃延伸10 min。第二轮PCR扩增以第一轮PCR产物为模板,反应体系为:10×PCR Buffer(Mg2+free)2.5 μL,MgCl2(25 mmol/L)2.5 μL,dNTPs(2.5 mmol/L)2 μL,CaYMVF2(10 μmol/L)1 μL,CaYMVR2(10 μmol/L)1 μL,无菌水15.6 μL,Taq DNA聚合酶(5 U/μL)0.2 μL,第一轮PCR产物0.2 μL。扩增条件为:94℃预变性3 min;94℃变性30 s,54℃退火45 s,72℃延伸1 min,共30个循环;最后72℃延伸10 min。PCR产物在1.5%琼脂糖凝胶电泳。
1.7 序列测定及分析
PCR产物经回收纯化后送生工生物工程(上海)股份有限公司进行测序。测得的核苷酸序列在NCBI中运用BLAST程序进行同源性比较分析。
1.8 巢式PCR的特异性验证
菜豆黄花叶病毒(BYMV)、黄瓜花叶病毒(CMV)、番茄不孕病毒(TAV)提取总RNA后,反转录为cDNA,同携带CaYMV的样品DNA一起进行巢式PCR扩增,同时以健康美人蕉植株的DNA为模板设阴性对照,以无菌水为模板设空白对照,反应体系及扩增条件同1.6。
1.9 巢式PCR的灵敏度测定
将CaYMV的DNA原液进行10倍梯度稀释,分别以10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9不同稀释度的DNA为模板,利用建立的巢式PCR方法进行扩增,同时设阴性对照,测定其灵敏度。
1.10 样品检测
利用建立的巢式PCR方法对口岸送检的一批美人蕉样品(共50份)进行检测。检测方法同1.4~1.7。
2 结果与分析
2.1 PCR鉴定
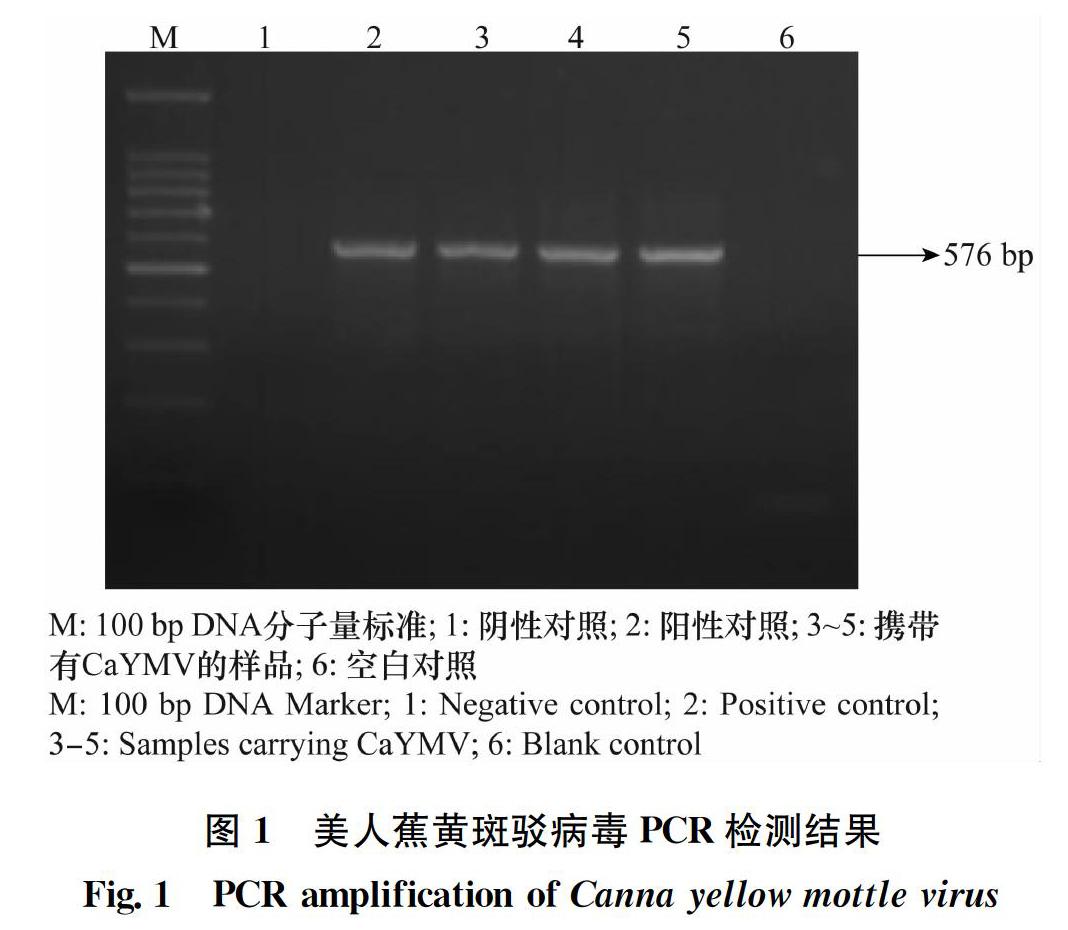
以提取的DNA为模板,以引物BadnaFP/BadnaRP进行扩增,结果从美人蕉病株中扩增出与预期大小一致的条带,约576 bp,而空白对照和阴性对照均未扩增出相应的特异性条带(图1)。将所得的目的片段进行克隆和测序,测得的序列进行BLAST比对,与已报道的CaYMV序列一致性达97%以上,证实样品携带有CaYMV。
2.2 巢式PCR检测
以第一轮PCR产物为模板,利用设计的内侧引物进行第二轮PCR,结果从带毒样品中扩增出与预期大小一致的条带,约352 bp,而空白对照和阴性对照均未扩增出相应的特异性条带(图2)。将所得的目的片段进行克隆和测序,测得的序列进行BLAST比对,与已报道的CaYMV序列(GenBank登录号:KT447042)一致性达99%。
2.3 巢式PCR的特异性验证
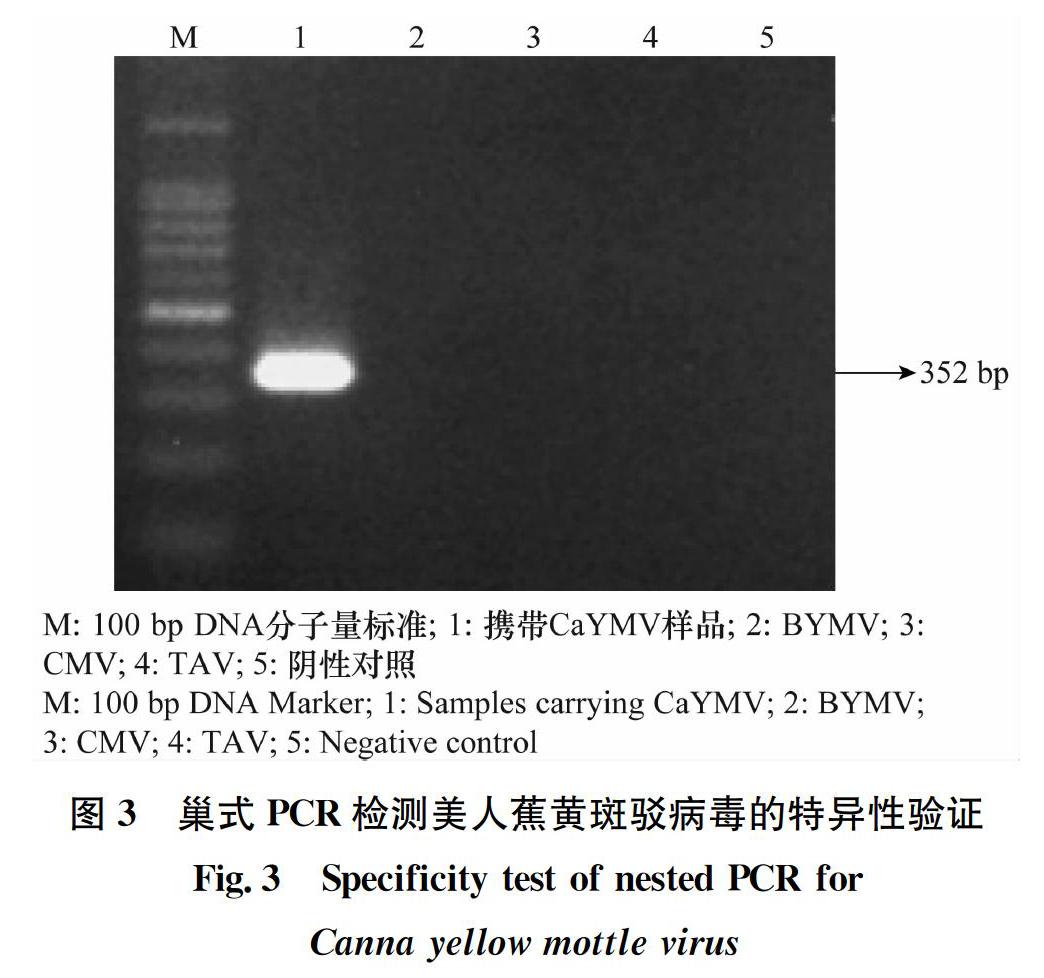
分别以BYMV、CMV、TAV的cDNA以及携带CaYMV的样品DNA为模板,在相同条件下进行巢式PCR,同时设阴性对照,结果从图3可见,仅携带CaYMV的样品在352 bp处出现明亮的DNA条带,其他病毒样品和健康样品均无条带,表明建立的巢式PCR方法具有较强的特异性。
2.4 巢式PCR的灵敏度测定结果
将携带CaYMV样品的DNA按10倍梯度稀释后,分别作为模板,单独使用CaYMVF1/CaYMVR1进行扩增,在1~3泳道均能扩增出540 bp的单一条带(图4a),而使用CaYMVF2/R2进行第二轮PCR扩增,在泳道1~6均能扩增出352 bp的条带(图4b)。第二轮PCR的检测灵敏度比第一轮PCR高103倍,即巢式PCR使检测灵敏度提高了103倍,由此表明,该病毒的巢式PCR的灵敏度明显高于常规PCR,前者的灵敏度是后者的103倍。
2.5 样品检测
检测结果表明,采用巢式PCR法能够从50份美人蕉样品中检测出CaYMV 9份(检出率为18%),比常规PCR检出率(8%)高10个百分点,表明本文建立的巢式PCR方法具有更高的灵敏度。
3 讨论
美人蕉黄斑驳病毒(CaYMV)是美人蕉上发生率较高的病毒之一,在美國、日本等美人蕉大面积种植的地区发生较为普遍,导致美人蕉的观赏价值和经济价值下降。目前尚未有针对CaYMV有效的防治方法,在美国曾被迫采取销毁病株的方式来防止其进一步扩散,给当地带来较大的经济损失[10]。因此,加强病毒检测,建立针对CaYMV快速、准确的检测方法,对有效防止该病毒随带病植株的远距离运输而扩散,保护我国观赏作物的生产安全意义重大。本文根据已报道的CaYMV序列设计了内、外侧2对特异性引物,在常规PCR的基础上,建立了可用于CaYMV快速检测的巢式PCR方法。
本文建立的巢式PCR方法仅能够从感染CaYMV的样品中扩增到特异性目的片段,而从其他病毒样品及健康样品中均未扩增到相应的目的片段,提高了PCR扩增的特异性,有效避免了非目的片段的扩增。与常规PCR相比,本文建立的巢式PCR方法经过2轮PCR反应,检测灵敏度得到显著提高,使整个PCR检测灵敏度提高了1 000倍(第一轮、第二轮的检测下限分别为10-2和10-5倍稀释的DNA)。应用本文建立的巢式PCR方法对进境的美人蕉样品进行CaYMV检测,检出率为18%,明显高于常规PCR的检出率,因此当CaYMV含量较低时,该方法能弥补常规PCR方法可能存在的漏检问题,使检测结果更为准确可靠。本文建立的巢式PCR检测CaYMV的方法具有快速、简便、特异和灵敏的优点,能够有效应用于CaYMV检测。
参考文献
[1] 刘晓俊, 周婵虹. 深圳地区美人蕉病虫害调查及综合防治[J].生物灾害科学, 2005, 28(4): 180184.
[2] KUMARI A, KUMAR S, RAJ S K. First report of Canna yellow mottle virus on canna from India [J]. Gastroenterologia Japonica, 2014, 29(3): 9.
[3] 张立红,王海燕,杜志游,等.侵染美人蕉的CMV基因组全序列及其致病性分析[J].植物病理学报,2011,41(2):178187.
[4] 傅本重,王政又,伍建榕,等.美人蕉叶斑病病原菌的生物学特性及其抑菌药剂筛选[J].中国农学通报,2011,27(31):105108.
[5] 陈集双,吴林福,周雪平,等.美人蕉黄瓜叶花病毒研究[J].浙江农业学报,1994,6(3):272275.
[6] 陈集双,李德葆.侵染半夏的两种病毒的分离纯化和初步鉴定[J].生物技术,1994(4):2428.
[7] 陈炜,田波,朱王香,等.美人蕉矮化病植株中发现的一种类似类病毒的RNA[J].病毒学报,1985(3):7579.
[8] BRUNT A, CRABTREE K. Viruses of tropical plants[M]. Wallingford, UK: CAB International, 1990.
[9] MONGER W A, HARJU V, SKELTON A, et al. Canna yellow streak virus: a new potyvirus associated with severe streaking symptoms in canna [J]. Archives of Virology, 2007, 152(8): 15271530.
[10]沈建国, 王念武, 张东斌, 等. PCR方法检测美人蕉黄斑驳病毒[J]. 植物检疫, 2008, 22(5):287289.
[11]YAMASHITA S, NATSUAKI T, DOI Y, et al. Canna yellow mottle virus, a non-enveloped small bacilliform virus in Canna sp.[J]. Annals of the Phytopathological Society of Japan, 1985, 51(5): 642646.
[12]MOMOL M T, LOCKHART B E L, DANKERS H, et al.Canna yellow mottle virus detected in canna in Florida[J]. Plant Health Progress, 2004,5(1):70017008.
[13]LOCKHART B E L. Occurrence of Canna yellow mottle virus in North America [J]. Acta Horticulturae, 1988, 234: 6972.
[14]MARINO M T, RAGOZZINO E, LOCKHART B E L, et al. First report of Canna yellow mottle virus (CaYMV) in Italy and in the Netherlands [J]. Plant Pathology, 2008, 57(2): 394.
[15]AGNEROH T A, BRATSCH S A, LOCKHART B E. First report of Canna yellow mottle virus in Kenya [J]. Plant Health Progress, 2015, 16(1):3435.
[16]SHEN Jianguo, GAO Fangluan, CHEN Xihong, et al. First report of Canna yellow mottle virus in China [J/OL]. Journal of Plant Pathology, 2018: doi:10.1007/s4216101801445.
[17]張巧萍,丁元明,王云月,等.凤仙花坏死斑病毒的RT-PCR和巢式PCR检测[J].华中农业大学学报,2009,28(1):2326.
[18]闻伟刚,崔俊霞,盛蕾.烟草环斑病毒和番茄环斑病毒的半巢式RT-PCR检测[J].植物保护学报,2007,34(1):6166.
[19]YANG I C, HAFNER G J, DALE J L, et al. Genomic characterisation of Taro bacilliform virus [J]. Archives of Virology, 2003, 148(5): 937949.
(责任编辑:田 喆)
