亚热带区4种林地土壤微生物生物量碳氮磷及酶活性特征
2019-09-04张雅茜冼应男王振鹏项文化
张雅茜,方 晰,2,*,冼应男,王振鹏,项文化,2
1 中南林业科技大学,生命科学与技术学院,长沙 410004 2 湖南会同杉木林生态系统国家野外科学观测研究站,会同 438107
为保护生物多样性和提升森林生态系统生态功能,20世纪90年以来,中国政府实施了“天然林保护”、“退耕还林”、“长江中上游防护林体系建设”等系列林业生态工程,亚热带地区森林植被恢复迅速,但由于受到不同强度的人为干扰,形成了多种次生植物群落。在特定的土壤类型和气候条件下,根据干扰强度和恢复程度及其物种组成的差异,沿着亚热带森林恢复演替梯度,这些次生植物群落可以划分为灌草丛、灌木林、针阔混交林、落叶常绿阔叶混交林和常绿阔叶林等不同恢复演替阶段[1]。植被恢复过程中,生物多样性和生态系统健康的变化已受到多个学科专家、学者的普遍关注[2]。土壤微生物和酶是指示生态系统健康状况的重要指标[3],两者均作用于土壤物质转换、能量平衡和生物地球化学循环,对土壤养分、结构、稳定性和植被恢复有重要的影响[4]。此外,微生物生物量周转快,与土壤酶活性一样对环境变化响应敏感[5],能反映土壤质量在时间序列或不同环境条件下的变化[6];土壤酶活性可代表土壤中物质代谢的旺盛程度,反映微生物对养分的吸收利用状况,不仅能反映土壤微生物活性,而且能表征土壤养分转化能力。
随着人们对地下生态过程认识不断深入,越来越多的学者关注植被恢复对土壤微生物和酶活性及其对各种生态学过程的影响[7]。研究表明,土壤微生物群落多样性和酶活性受许多环境因子的影响,其中由于植物组成不同所致的土壤理化性质(碳源、pH值、养分、水分)变异,导致土壤微生物群落结构及功能、酶活性的改变已有很多研究报道[8- 10]。但是土壤养分含量与酶活性之间的关系至今仍没有一致的结论[10]。尽管有关亚热带地区随着次生林植被恢复演替,群落组成结构趋于复杂,生物量提高,凋落物、根系的数量和质量改变,土壤理化性质、微生物生物量和酶活性的变化趋势有了一定的认识[11]。然而,土壤微生物生物量与酶活性具体呈现怎样的相关关系,以及结合土壤化学性质深入探讨土壤微生物生物量、酶活性与土壤环境因子的相互关系仍缺乏研究报道[10,12];而且现有研究多采用简单相关分析探讨土壤微生物生物量、酶活性与土壤养分之间的关系,而数学统计理论认为,在多变量简单相关分析过程中,任意两个变量的线性相关系数都会受到其他变量的影响,不能真实反映一个变量(原因)对另一个变量(结果)的直接作用,往往不能准确地反映两个变量之间的真正关系,甚至常常会得出错误的结论。通径分析在群落植被格局、土壤微生物生物量、酶活性与营养元素之间关系研究等方面已有成功应用[13-14]。本研究采用空间代替时间的方法,在湘中丘陵区选取地域毗邻、环境条件(立地、土壤、气候)基本一致,由处于不同演替阶段树种组成的4种林地作为一个恢复序列,研究土壤微生物生物量、酶活性的变化趋势,结合通径分析方法分析4种林地土壤微生物生物量、酶活性与土壤化学性质的关系,以验证以下假设:(1)土壤微生物生物量、酶活性随着森林植被恢复而提高;(2)土壤化学性质的变化对土壤微生物生物量影响显著;(3)土壤微生物生物量、化学性质的变化对土壤酶活性影响显著。在理论上明确植被恢复对土壤微生物学特性的影响机制,在实践上为亚热带森林植被恢复和保护以及森林开发利用提供科学依据。
1 材料与方法
1.1 研究样地概况
研究样地设置在湖南长沙县大山冲林场(28°24′—28°25′N,113°18′—113°19′E),为典型低山丘陵区,地形起伏较大,海拔为55—350 m,属于幕阜山余脉的西缘,地势大体从东南向西北倾斜,坡度多在20°—30°;属于亚热带东南季风湿润气候区,1954—2010年平均气温17.3 ℃,7—8月份极端高温为39.8 ℃,1—2月份极端低温-10.3 ℃,无霜期216—269 d,雨量充沛,年降水量约为936.4—1954.2 mm,年平均降水量为1416.4 mm,主要集中于4—7月份,相对湿度较大,平均年日照时间约1440 h。地带性植被为常绿阔叶林,土壤以板岩和页岩等变质岩发育而成的酸性粘土质红壤为主。该林场经过60—70年的封山育林,现保存有杉木(Cunninghamialanceolata)、马尾松(Pinusmassoniana)、毛竹(Phyllostachysheterocycla)等人工林群落以及处于不同恢复演替阶段的次生林群落,林场内次生林群落人为干扰少,为开展亚热带次生林植被恢复演替研究提供了良好的场所。
根据人为干扰程度和森林恢复过程,在林场内选取地域毗邻、环境条件(立地、土壤、气候)基本一致,由处于不同演替阶段树种组成的4种林地:(1)由杉木单一针叶树种组成的人工林(为对照林地);(2)由60%马尾松、25%柯(又名石栎,Lithocarpusglaber)和15%其他树种组成的针阔混交次生林;(3)由65%南酸枣(Choerospondiasaxillaries)、6%檵木(Loropetalumchinensis)、6%四川山矾(Symplocossetchuensis)和23%其他树种组成落叶阔叶次生林;(4)由37%柯、16%青冈(Cyclobalanopsisglauca)、16%马尾松和31%其他树种组成的常绿阔叶次生林组成一个恢复序列,分别设置1块面积为1 hm2的长期观测固定样地(分别简写为CL、PM-LG、CA和LG-CG,下同)。对样地内胸径≥ 1 cm的所有木本植物挂牌编号,记录植物种类,测定胸径、树高和冠幅,并计算Shannon-Wiener多样性指数。4种林地样地的基本特征及其树种组成详见Liu等[15]的文献。
1.2 土壤样品采集、处理
2016年5月中旬,在4种林地代表性地段分别随机设置5个20 m × 20 m的样地(每种林地构成5个重复),每个样地沿着对角线均匀设置3个采样点,用土壤钻(内径约6 cm)按0—15、15—30 cm分层采集土壤样品。在室内,清除土壤样品中的动植物残体、石砾,将同一个样地3个采样点同一土层样品混合均匀,过2 mm土壤筛,分成2份。其中1份放入冰箱0—4 ℃下保存,用于测定土壤微生物生物量碳(BC)、氮(BN)、磷(BP);另1份自然风干后,磨碎过1、0.25 mm土壤筛。过1 mm土壤筛的样品用于测定土壤pH值、水解性氮(AN)、有效磷(AP)含量和4种酶活性;过0.25 mm土壤筛的样品用于测定有机碳(SOC)、全氮(TN)、全磷(TP)含量。
1.3 土壤微生物生物量、酶活性和化学性质的测定
土壤BC、BN采用氯仿熏蒸,0.5 mol/L K2SO4溶液浸提(水土比为4∶1),用TOC- 1020A分析仪测定浸提液中SOC和TN含量,土壤BC=EC/kEC(EC为熏蒸与未熏蒸土壤SOC含量差值;kEC为转换系数,取值0.45[16])。土壤BN=EN/kEN(EN为熏蒸与未熏蒸土壤TN含量差值;kEN为转换系数,取值0.45[16]);土壤BP采用氯仿熏蒸,0.5 mol/L NaHCO3溶液提取(水土比为4∶1),用钼蓝比色法测定浸提液中TP含量,土壤BP=EP/kEP(EP为熏蒸与未熏蒸土壤TP含量差值,kEP为转换系数,取值0.40[16])。
土壤蔗糖酶(Invertase,INV)活性用3,5-二硝基水杨酸比色法,脲酶(Urease,URE)活性用苯酚钠比色法,酸性磷酸酶(Acid phosphatase,ACP)活性用磷酸苯二钠比色法,过氧化氢酶(Catalase,CAT)活性用高锰酸钾滴定法测定[17]。
土壤pH值用土水比1∶2.5pH计法,TN用KN580全自动凯氏半微量定氮仪法,TP用钼锑抗比色法,AN用碱解扩散法,AP用盐酸-氟化铵浸提法测定。4种林地土壤化学性质如表1所示。
1.4 数据处理
土壤BC、BN、BP分别占土壤SOC、TN、TP含量的百分比例,用(1)式计算:
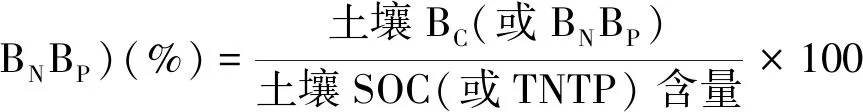
(1)
用Excel 2010统计不同林地各土层各指标的平均值和标准偏差。用SPSS(Statistical Package for Social Science)13.0软件包中的单因素方差分析(one-way ANOVA)的最小显著差数法(LSD)检验4种林地之间、土层之间各项指标的差异显著性(P< 0.05);用双因素方差分析(two-way ANOVA)分析林地与土层之间是否存在交互作用;用Pearson相关系数分析土壤微生物生物量与土壤酶活性之间的相关性。结合DPS7.05进行通径分析[13],计算土壤微生物生物量、酶活性与土壤化学性质之间直接和间接通径系数。用SigmaPlot 12.5绘制图;图、表中数据均为平均值±标准偏差。
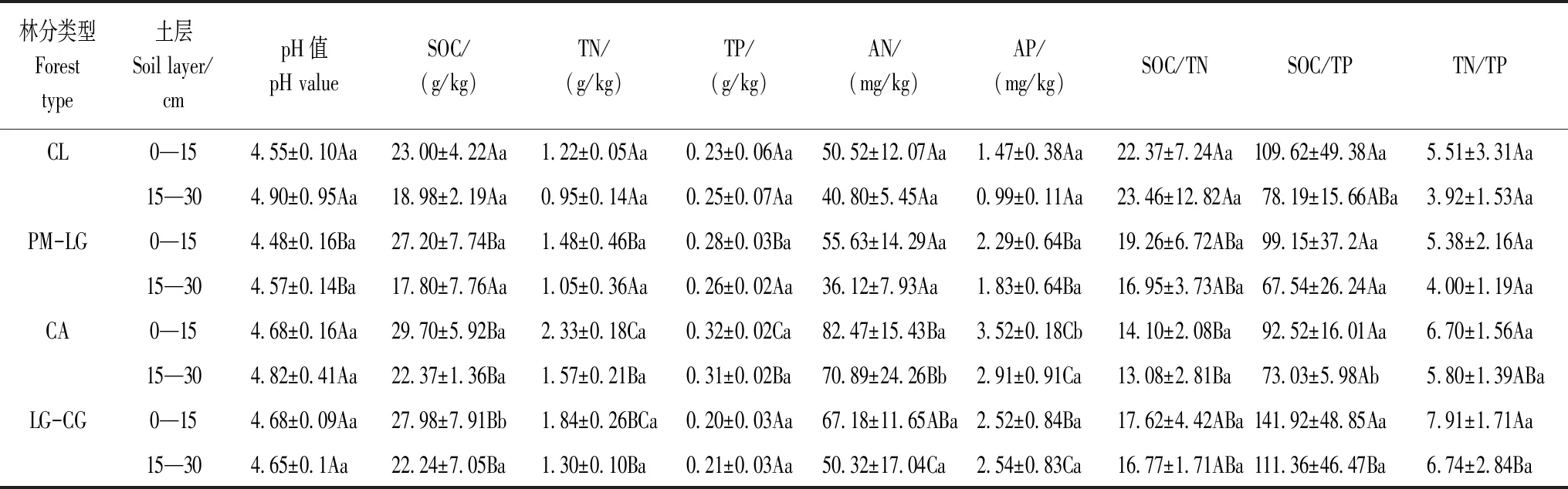
表1 不同林地土壤的化学性质
不同大写字母代表同一土层不同林地之间的差异显著(P< 0.05),不同小写字母代表同一林地不同土层之间的差异显著(P< 0.05);CL:杉木人工林,Cunninghamialanceolataplantation;PM-LG:马尾松-柯针阔混交林,Pinusmassoniana-Lithocarpusglabermixed forest;CA:南酸枣落叶阔叶林,Choerospondiasaxillarisdeciduous broad leaved forest;LG-CG:柯-青冈常绿阔叶林,Lithocarpusglaber-Cyclobalanopsisglaucaevergreen broad-leaved forest;SOC:土壤有机碳,Soil organic carbon;TN:全氮,Total nitrogen;TP:全磷,Total phosphorus;AN:水解性氮,Available nitrogen;AP:有效磷,Available phosphorus
2 结果与分析
2.1 4种林地土壤微生物生物碳氮磷的变化
从图1和表2可以看出,林地、土层均显著影响土壤BC、BN、BP,但林地与土层对土壤BC、BN、BP不存在显著的交互作用(表2)。
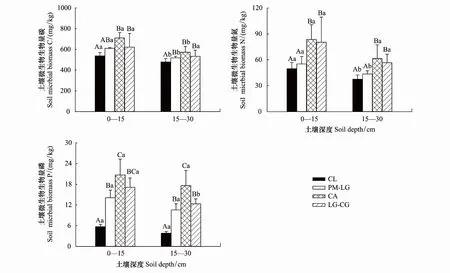
图1 4种林地土壤微生物生物量碳氮磷Fig.1 Soil microbial biomass carbon, nitrogen and phosphorus in different forest lands不同大写字母代表同一土层不同林地之间的差异显著(P < 0.05),不同小写字母代表同一林地不同土层之间的差异显著(P < 0.05);CL:杉木人工林,Cunninghamia lanceolata plantation;PM-LG:马尾松-柯针阔混交林,Pinus massoniana-Lithocarpus glaber mixed forest;CA:南酸枣落叶阔叶林,Choerospondias axillaris deciduous broad leaved forest;LG-CG:柯-青冈常绿阔叶林,Lithocarpus glaber-Cyclobalanopsis glauca evergreen broad-leaved forest
Table 2 Two-way ANOVA table of effect of forestand, soil layer and their interaction on soil microbal biomass carbon, nitrogen and phosphorus
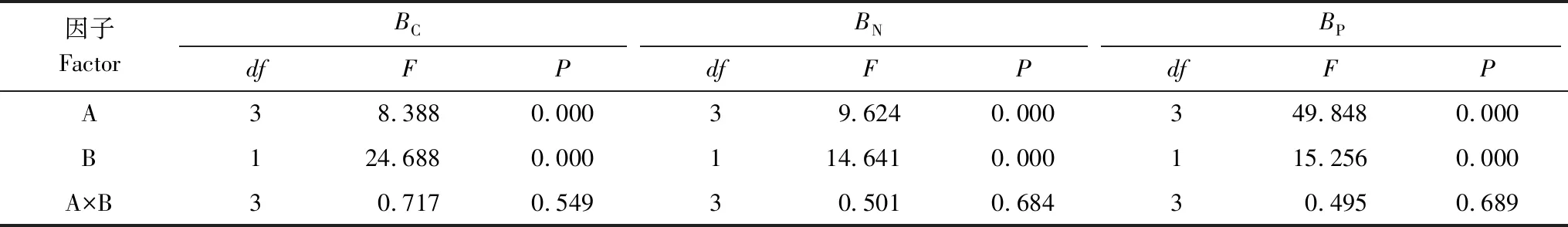
因子FactorBCBNBPdfFPdfFPdfFPA38.3880.00039.6240.000349.8480.000B124.6880.000114.6410.000115.2560.000A×B30.7170.54930.5010.68430.4950.689
A、B分别代表林分类型、土层深度,A×B则表示两者之间的交互作用; The A, B represent forest type and soil depth, the A×B represent interactions of forest type and soil depth;BC:土壤微生物生物量碳,Soil microbial biomass carbon;BN:土壤微生物生物量氮,Soil microbial biomass nitrogen;BP:土壤微生物生物量磷,Soil microbial biomass phosphorus
如图1所示,4种林地0—15 cm土层BC、BN和BP分别为480.50—868.40,43.80—157.50和4.94—24.19 mg/kg,变化趋势基本一致,均表现为:CA > LG-CG > PM-LG > CL,且CA、LG-CG与PM-LG、CL差异显著(P< 0.05),但PM-LG与CL(除BP外)之间,CA与LG-CG之间差异不显著(P> 0.05),PM-LG、CA、LG-CG的BC分别比CL高14.33%、29.52%、24.39%,BN分别高11.52%、60.32%和45.31%,BP分别高152.14%、237.93%和205.30%。15—30 cm土层BC、BN、BP分别在349.70—740.00,30.30—109.80和3.34—22.95 mg/kg之间,变化趋势与0—15 cm土层一致,且CL与PM-LG(除BN外)、CA、LG-CG差异显著(P< 0.05),PM-LG与CA(除BC外)差异显著(P< 0.05),与LG-CG(除BN外)差异不显著(P> 0.05),CA与LG-CG(除BP外)差异不显著(P>0.05),PM-LG、CA、LG-CG的BC分别比CL高17.21%、31.50%、31.79%,BN分别高18.89%、67.34%和49.15%,BP分别高178.08%、372.09%和227.01%。不同林地之间,BC差异最大,其次是BN,BP最小。
从图1可以看出,4种林地0—15 cm土层BC、BN、BP均高于15—30 cm土层,且CL、PM-LG、CA土层间BC差异显著(P< 0.01),CL、PM-LG土层间BN差异显著(P< 0.05),LG-CG土层间BP差异显著(P< 0.05)。
2.2 4种林地土壤BC/BN、BC/SOC、BN/TN、BP/TP比值
从表3可以看出,不同林地同一土层BC/BN不同,0—15、15—30 cm土层CL、PM-LG显著高于CA、LG-CG(P< 0.05),但CL与PM-LG之间,CA与LG-CG差异不显著(P> 0.05)。4种林地0—15 cm土层BC/BN均低于15—30 cm土层,但差异均不显著(P> 0.05)。
4种林地同一土层BC/SOC、BN/TN、BP/TP的变化趋势不同。0—15、15—30 cm土层BC/SOC随着森林植被恢复,先增高再下降,BN/TN随着植被恢复,先下降再增高,而BP/TP随着植被恢复,逐渐增高。4种林地15—30 cm土层的BC/SOC、BN/TN(除CL外)高于0—15 cm土层,而BP/TP恰好相反,但4种林地两个土层间的BC/SOC、BN/TN、BP/TP差异均不显著(P> 0.05)(表3)。
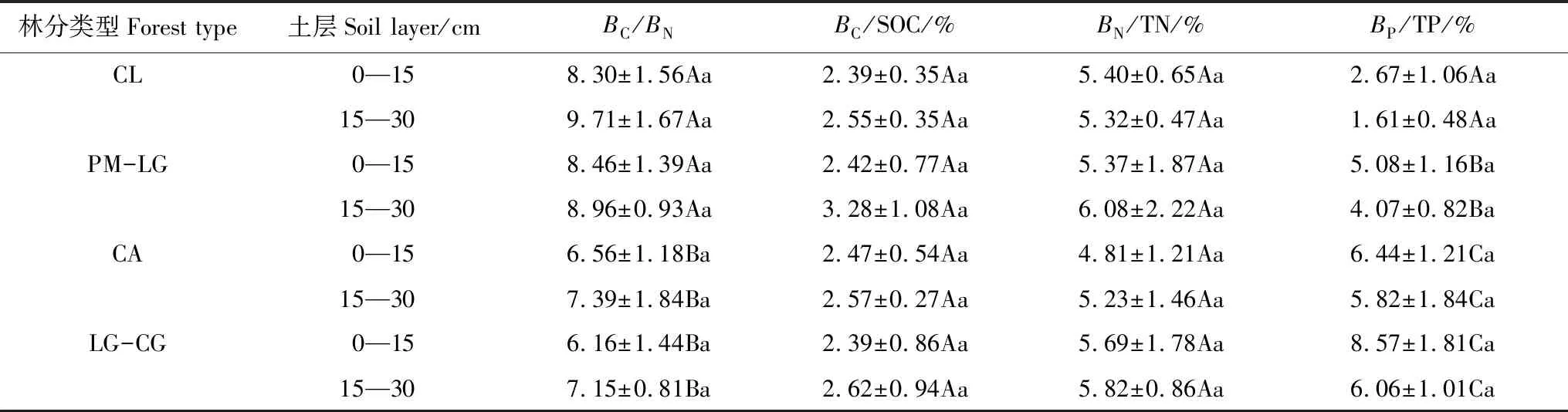
表3 4种林地土壤BC/BN、BC/SOC、BN/TN、BP/TP的比率
2.3 4种林地土壤酶活性的变化
从图2和表4可以看出,林地、土层均显著影响土壤INV、URE、ACP和CAT活性,但林地与土层不存在显著的交互作用(除ACP活性外)。
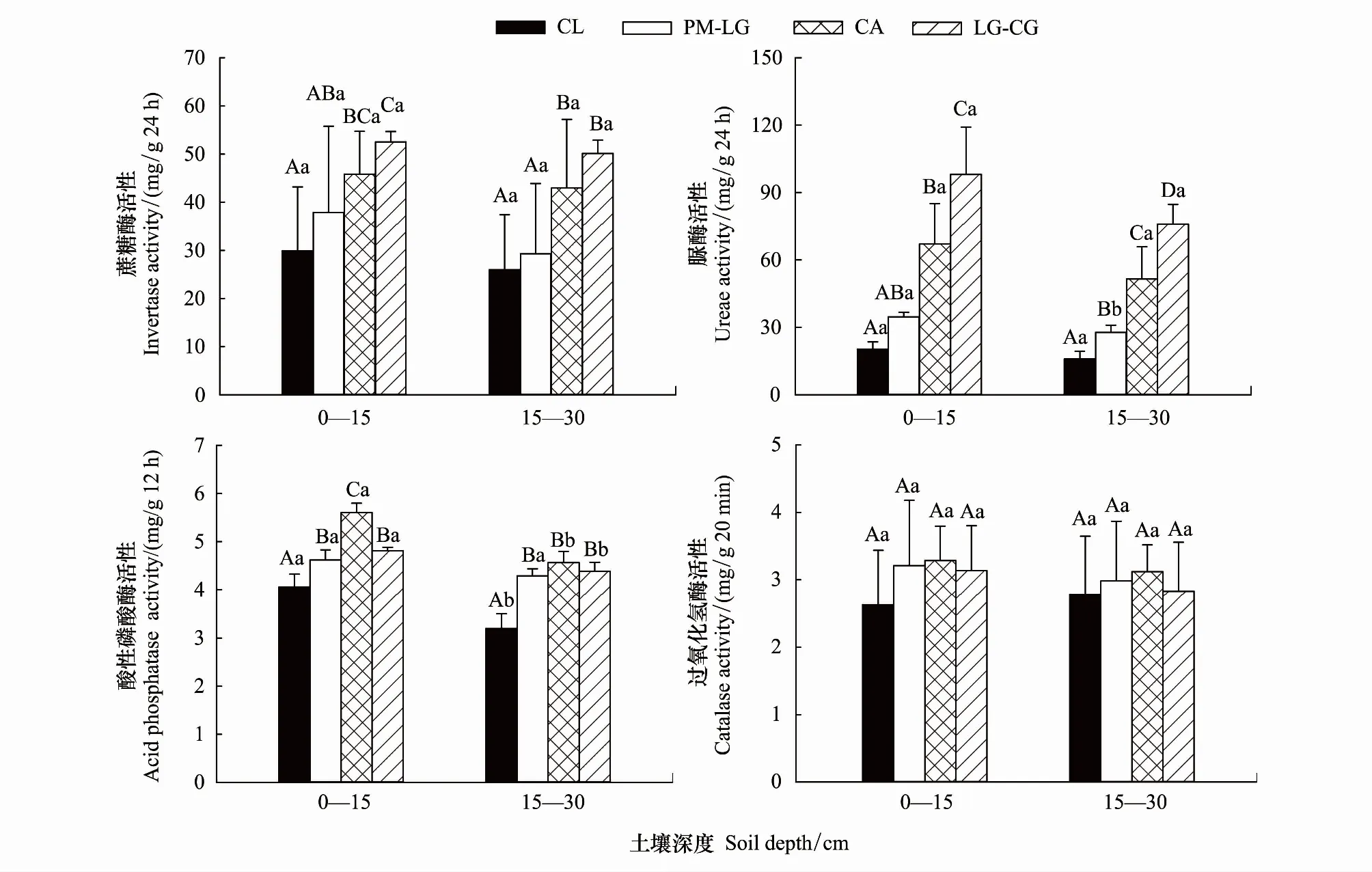
图2 不同林地土壤酶活性Fig.2 Soil enzyme activity in different forest lands
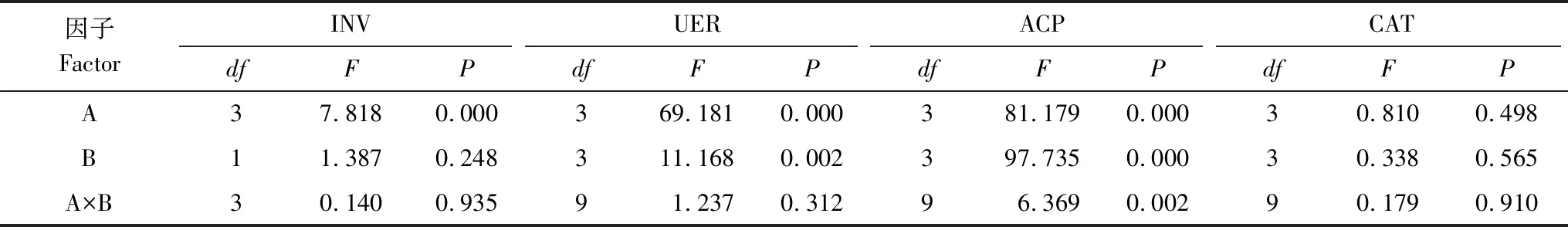
因子FactorINVUERACPCATdfFPdfFPdfFPdfFPA37.8180.000369.1810.000381.1790.00030.8100.498B11.3870.248311.1680.002397.7350.00030.3380.565A×B30.1400.93591.2370.31296.3690.00290.1790.910
INV:蔗糖酶,Invertase;URE:脲酶,Urease;ACP:酸性磷酸酶,Acid phosphatase;CAT:过氧化氢酶,Catalase
如图2所示,4种林地0—15、15—30 cm土层INV活性分别为17.30—67.49、14.90—25.14 mg/g24h,均表现为:LG-CG> CA > PM-LG > CL;0—15 cm土层,LG-CG、CA与CL差异显著(P< 0.05);LG-CG与PM-LG差异显著(P< 0.05),与CA差异不显著(P> 0.05),CA与PM-LG之间,PM-LG与CL之间差异不显著(P> 0.05);15—30 cm土层,LG-CG、CA与PM-LG、CL差异显著(P<0.05),而LG-CG与CA之间,PM-LG与CL之间差异不显著(P> 0.05);LG-CG、CA、PM-LG分别比CL提高了75.8%—93.0%、53.4%—65.4%、12.7%—26.6%。4种林地0—15、15—30 cm土层URE活性分别为0.13—1.22、0.13—0.88 mg/g24h,也表现为:LG-CG > CA > PM-LG > CL;0—15 cm土层,LG-CG、CA与PM-LG、CL之间,LG-CG与CA差异显著(P< 0.05),但PM-LG与CL差异不显著(P> 0.05);15—30 cm土层,CL、PM-LG、CA、LG-CG两两之间差异显著(P< 0.05);LG-CG、CA、PM-LG分别比CL增加了374.4%—381.9%、222.0%—230.0%、70.9%—74.0%。4种林地0—15、15—30 cm土层ACP活性分别为3.59—5.80、2.84—4.98 mg/g12h,均表现为CA > LG-CG > PM-LG >CL;0—15 cm土层,PM-LG、CA、LG-CG与CL之间,CA与PM-LG、LG-CG之间差异显著(P< 0.05),但PM-LG与LG-CG之间差异不显著(P> 0.05);15—30 cm土层,PM-LG、CA、LG-CG与CL之间差异显著(P< 0.05),而PM-LG、CA、LG-CG两两之间差异不显著(P> 0.05),PM-LG、CA、LG-CG分别比LC高14.0%—34.2%、38.2%—42.7%、18.7%—37.1%。4种林地0—15、15—30 cm土层CAT活性分别为1.64—4.51、2.04—4.43 mg/g20min,均表现为CA > PM-LG > LG-CG > CL,同一土层不同林地两两间差异均不显著(P> 0.05)。表明INV、URE活性随着植被恢复演替呈递增趋势,而ACP、CAT活性在恢复演替中期阶段较高,在晚期阶段有所下降。
从图2可以看出,0—15 cm土层INV、URE、ACP、CAT活性(除CL外)均高于15—30 cm土层。但各林地两土层的INV、URE(除PM-LG外)、ACP(除LC、CA、LG-CG外)、CAT活性差异均不显著(P> 0.05)。
2.4 土壤微生物生物量、土壤酶活性以及其之间的关系
如表5所示,土壤BC、BN、BP两两之间呈极显著正相关关系(P< 0.01),分别与土壤INV(除BN外)、URE、ACP、CAT(除BP外)活性之间呈显著(P< 0.05)或极显著(P< 0.01)的正相关。土壤INV、URE、ACP活性两两之间呈极显著正相关关系(P< 0.01),但三者与CAT活性不存在显著的相关关系(P> 0.05)。表明土壤中多糖的转化循环,有机磷有脱磷与转化,不同N素的转化利用之间关系密切并且相互影响,3种水解酶在促进土壤有机质的转化及参与土壤物质转化和能量交换中,不仅显示其专有特性,同时还存在着共性关系,共同影响着土壤肥力的改善。
表5 土壤微生物生物量、土壤酶活性以及其之间的相关系数
Table 5 Correlation coefficients between soil microbial biomass, soil enzyme activity and between soil microbial biomass and soil enzyme activity
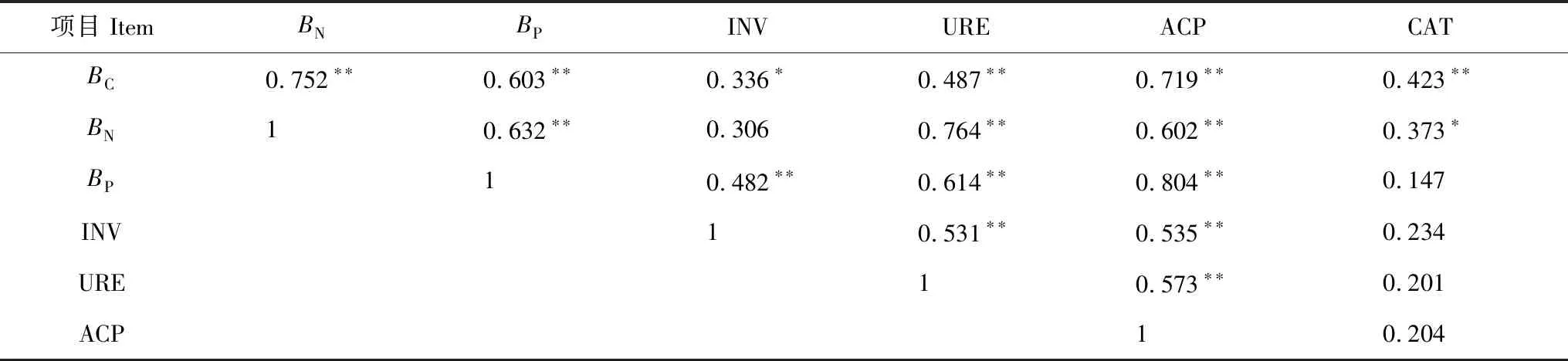
项目 ItemBNBPINVUREACPCATBC0.752∗∗0.603∗∗0.336∗0.487∗∗0.719∗∗0.423∗∗BN10.632∗∗0.3060.764∗∗0.602∗∗0.373∗BP10.482∗∗0.614∗∗0.804∗∗0.147INV10.531∗∗0.535∗∗0.234URE10.573∗∗0.201ACP10.204
** 表示极显著相关(P< 0.01),* 表示显著相关(P< 0.05)
2.5 土壤微生物生物量、土壤酶活性与土壤化学性质的相互关系
利用通径分析探讨了土壤化学性质对微生物生物量,以及土壤化学性质、微生物生物量对酶活性的影响,结果如表6所示。
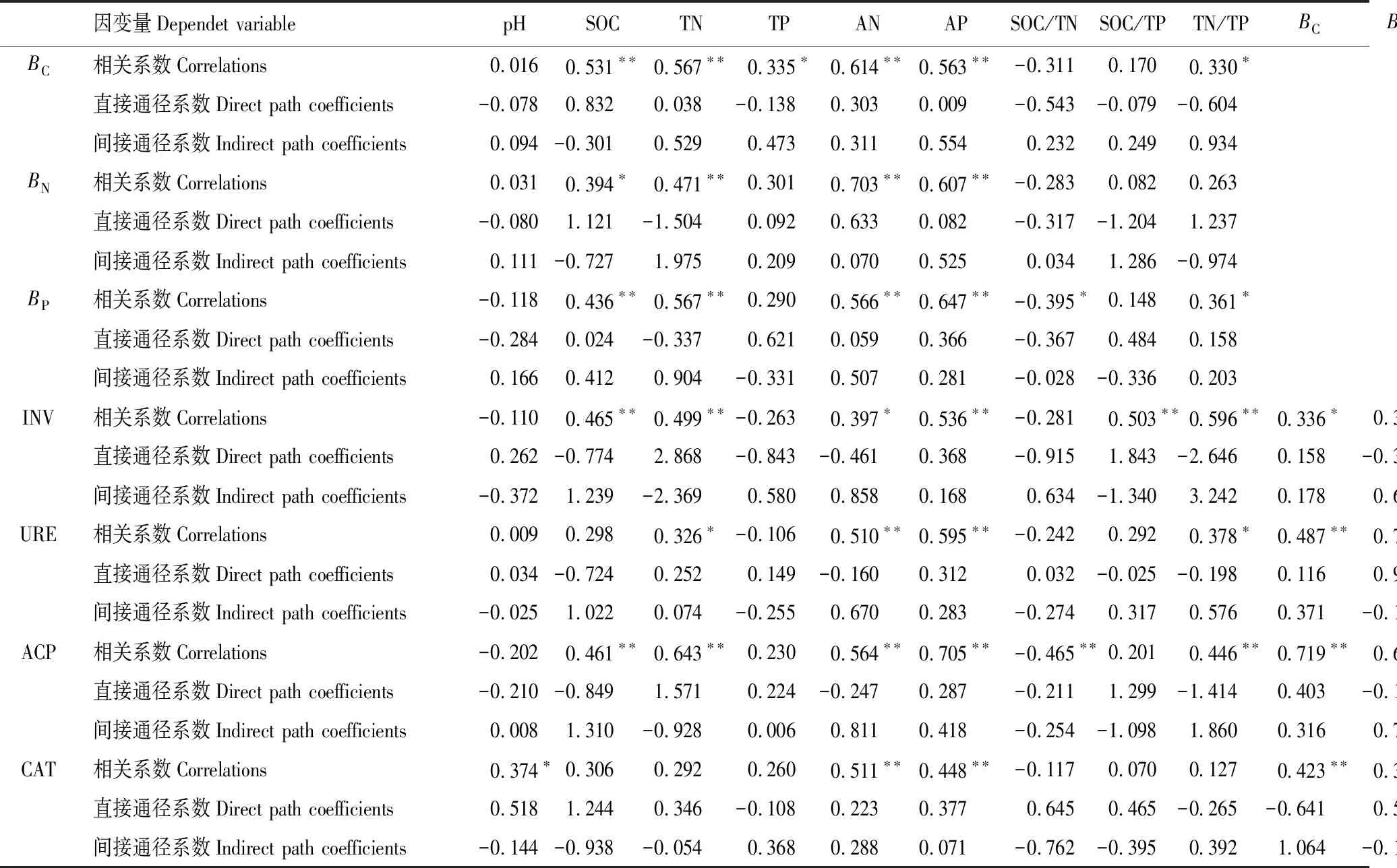
表6 土壤理化性质对土壤微生物生物量、土壤酶活性的相关关系和通径系数
从表6可以看出,土壤化学性质中对BC的直接通径系数较大的前5个因素依次为:SOC(0.832) > TN/TP(-0.604) > SOC/TN(-0.543)> AN(0.303) > TP(-0.138),各因素通过SOC、TN/TP对BC的间接通径系数较大(分别为-0.301和0.934)。SOC对BC的影响为正相关,而TN/TP为负相关,两者的相关性相互抵消,其他因素通过两者对BC的间接影响亦是如此,因而各因素与BC的相关系数均较小。综上所述,BC的直接影响因素是SOC和TN/TP。
对BN的直接通径系数较大的前5个因素依次为:TN(-1.504)> TN/TP(1.237) > SOC/TP(-1.204) >SOC(1.121) > AN(0.633)。各因素通过TN、TN/TP的间接通径系数较大(分别为1.975和-0.974)。表明BN的直接影响因素是TN、TN/TP。
对BP的直接通径系数较系数大的前5个因素依次为:TP(0.621) > SOC/TP(0.484) > SOC/TN(-0.367)> AP(0.366) > TN(-0.337)。各因素通过TP、SOC/TP的间接通径系数较大(分别为0.331和-0.336)。表明BP的直接影响因素是TP和SOC/TP。
对INV活性的直接通径系数较大的因素为:TN(2.868) > TN/TP(-2.646) > SOC/TP(1.843) >BN/TN(1.287) > SOC/TN(-0.915),各因素通过TN、TN/TP的间接通径系数较大(分别为-2.369和3.242),表明影响INV活性的主要因子是TN、TN/TP。
对URE活性的直接通径系数较大的前5个因素依次为:BP/TP(1.504)、BP(-1.179)、BN(0.938)、SOC(-0.774)、BC/SOC(-0.488),各因素通过BP/TP、BP的间接通径系数较大(分别为-0.789和1.793),表明URE活性的直接影响因子是BP/TP、BP。
对ACP活性的直接通径系数较系数大的前5个因素依次为:TN(1.571) > TN/TP(-1.414) > SOC/TP(1.299) > SOC(-0.849) >BP/TP(0.483),各因素通过TN、TN/TP的间接通径系数较大(分别为-0.928和1.860),表明影响ACP活性的主要因子是TN、TN/TP,而一些因子与ACP活性呈现出的极显著相关性主要是其直接效应和间接效应综合作用的结果。
对CAT活性的直接通径系数较大的因素依次为:BC/SOC(1.791) > SOC(1.244) > SOC/TN (0.745) >BC(-0.641)>BN/TN(-0.605),各因素通过BC/SOC、SOC的间接通径系数较大(分别为-1.849和平0.938),表明影响CAT酶活性的直接因子是BC/SOC、SOC。
BC、BN、BP以及INV、URE、ACP、CAT活性的剩余余项通径系数较低,分别为0.219、0.215、0.212、0.117、0.040、0.069和0.174。表明土壤化学性质对微生物生物量,以及土壤化学性质和微生物生物量对酶活性具有较大的影响。
3 讨论
3.1 森林植被恢复对土壤微生物生物量的影响
研究表明,不同生态系统土壤微生物生物量差异较大,是生态系统特性与环境因子综合作用的结果,其中林分类型是重要的影响因子之一[18]。不同林分因组成树种及其数量、生物量、凋落物数量和质量的差异,土壤SOC及养分含量不同[19],进而影响土壤微生物生长与繁殖,导致不同林地土壤微生物生物量也不相同[18- 19]。植被恢复对土壤微生物的积极影响主要来自于生物量(凋落物、根系及其分泌物等)增加导致的能源输入增加[9]。本研究中,随着森林植被恢复,林分组成树种和阔叶树比例增大,细根生物量[15]、年凋落物量[20]以及地表凋落物现存量[21]增加,土壤SOC、TN、TP、AN、AP含量增加(表1),土壤BC、BN、BP整体上呈增加趋势,以CA最高,其次是LG-CG,表明森林植被恢复后,土壤微生物生物量较快提高,土壤养分转化速率较高。此外,由于阔叶林(CA、LG-CG)凋落物养分含量较高,易分解,土壤微生物生物量较高,而针叶林(CL、PM-LG)凋落物养分含量较低,难分解,土壤微生物效应较差,特别是杉木人工林不仅树种单一,且人为的长期经营活动,导致SOC输入量明显减少,因此阔叶林(CA、LG-CG)各土层BC、BN、BP高于针叶林(PM-LG、CL),且3种次生林(PM-LG、CA、LG-CG)各土层BC、BN、BP也高于CL,进一步证实了阔叶树种比例增加会提高土壤养分状况和微生物活性[22]。此外,本研究中,4种林地土壤BP差异最小,表明植被恢复对土壤BP的改善不如BC、BN明显。同时,土壤P含量受成土母质影响较大,有关微生物体P的代谢速率、途径和来源仍有待于进一步研究。通径分析结果(表4)表明,土壤BC、BN、BP与土壤SOC、TN、TP、AN、AP含量呈显著或极显著的相关关系(P< 0.01),但BC、BN、BP的直接影响因素分别为SOC和TN/TP,TN和TN/TP,TP和SOC/TP,而且剩余余项的通径系数较低,表明土壤微生物生物量的主要影响因素是土壤化学性质,特别是SOC、TN、TP含量和TN/TP、SOC/TP比值。
土壤BC/BN比值是衡量土壤微生物群落结构的重要指标[23]。本研究中,4种林分土壤BC/BN比值在6—10之间波动,略高于李香珍等[23]的研究结果(5—9),且同一土层针叶林(CL、PM-LG)高于阔叶林(CA、LG-CG)。可能是由于不同林分组成树种不同,凋落物和根系数量和质量不同及其分解物形成不同的微生物区系所致,这有待于进一步探究。研究表明,土壤BC/BN比值与土壤有机质质量有关,土壤中有效氮越丰富,则土壤BC/BN比值越低[24],与本研究的结果基本一致。
微生物生物量与土壤养分的比值反映了输入土壤有机质向微生物生物量的转化效率、土壤中养分元素的损失和土壤矿物对有机质的固定,更能准确地反映土壤C、N、P的动态特征[25]。该比值越高,土壤C、N、P的积累强度越大[26]。不同林分因组成树种及其数量、生物量以及凋落物数量和质量的差异,土壤微生物营养源不同,导致土壤微生物的种类和组成不同,土壤微生物生物量及其与土壤养分的比值也不同[19]。BC/SOC受土地利用方式改变的影响比BC小,表现更稳定[27]。本研究中,随着森林植被恢复,BC/SOC先增高再下降,在2.39%—3.28%之间,表现相对稳定,与现有的研究结果[12,28- 29]基本一致;BN/TN先下降再增高,在4.81%—6.08%之间,处于2.0%—7.8%之间[29];而BP/TP逐渐增高,且不同林地之间差异显著,在1.61%—8.57%之间,基本处于2.6%—5.9%之间[29]。表明不同林地土壤微生物固C、N、P能力不同。可能与不同林地输入有机物质的数量和质量不同有关,造成微生物种类和数量的差异,导致森林恢复过程中土壤微生物学质量的差异。同时,土壤中氮磷的积累和消耗程度取决于土壤有机质的积累和分解[30]。与CL、PM-LG相比,CA、LG-CG输入土壤有机物质的数量和质量及周转期要优于CL、PM-LG,土壤微生物活性及微生物生物量高,促进土壤有机质的分解和转化[31]。因此BN/TN、BP/TP相对较高。15—30 cm土层BC/SOC、BN/TN高于0—15 cm土层,而BP/TP恰好相反,表明深土层微生物固C、N能力较强,而固P能力较弱。土壤BC、BN、BP两两之间呈极显著正相关关系,与现有的研究结果一致[9],是由于土壤微生物对N、P的固持作用主要取决于土壤微生物本身的生物量大小[29]。
3.2 森林植被恢复对土壤酶活性的影响
与土壤微生物生物量一样,土壤酶活性也是表征土壤质量的重要生物学指标,能快速指示土壤质量的变化趋势[32]。研究表明,土壤酶作为催化土壤众多生化反应的主要承载体,受到诸多因素的影响,如土壤水热条件、微生物种类与数量、养分丰缺、植被组成以及地形地貌等[29,33]。其中植被组成导致凋落物、根系数量与质量的改变,会引起土壤养分的变化,因此林分类型对土壤酶活性有着重要的影响。随着植被恢复,表土层SOC、N和P含量显著增加,土壤生产力在演替开始后逐渐增大,在演替后期则逐渐降低,再加上林分植物多样性的影响,通过影响土壤微生物生物量而间接影响土壤酶活性[33-34]。
土壤INV可以分解蔗糖为植物和微生物提供可以直接吸收和利用的葡萄糖和果糖,为土壤生物体提供能量,其活性反映了SOC积累和分解转化的规律,比其他酶类更能明显地反映土壤肥力水平和微生物活性强度[35]。本研究中,土壤INV活性随着森林植被恢复而递增,TN、TN/TP对INV活性直接通径系数远大于其他因素,且其他因素通过这两个变量的间接通径系数也较大,是INV活性的主要直接影响因素,但由于TN、TN/TP对INV活性的影响效应相反,相互抵消,使得各因子与INV活性的相关系数较小。表明土壤N源丰富,能提高土壤微生物INV的分泌量,促进蔗糖分解,满足微生物同化吸收更多的碳,使微生物C/N保持相对稳定[10],但由于土壤P供应不足,土壤微生物受到P的限制,不利于微生物INV的分泌。
土壤URE主要参与土壤有机质中蛋白质和氨基酸水解,为植物生长提供N,其活性强即土壤N转化特别有效化过程强烈[36]。本研究中,土壤URE活性随着森林植被恢复呈递增趋势,BP/TP、BP对土壤URE活性直接通径系数高于其他因素,且其他因素通过这两个变量的间接通径系数也较大,是URE活性的主要直接影响因子。同时,土壤URE活性与TN、AN等指标呈显著正相关关系,与中国大部分地区土壤URE活性与土壤N素的相关性研究结果[37]基本一致。土壤TN对URE活性的影响存在一个阈值(TN为3.5 g/kg,AN为110 mg/kg),低于此阈值时,URE活性与TN呈正相关,高于此阈值则呈负相关[37]。本研究中,土壤TN、AN含量均低于此阈值,因而TN与URE表现为显著正相关。
ACP能够催化磷酸酯或磷酸酐的水解反应,其活性直接影响土壤养分的供给[17]。本研究中,随着森林植被恢复演替,ACP活性先增加后降低,CA最高,LG-CG有所下降,表明CA土壤养分循环速率较高,对土壤养分供给更快。ACP活性的影响因子主要是TN、TN/TP,但由于TN、TN/TP对ACP活性的作用相反,相互抵消,使得各因子与ACP活性的相关系数较小。表明土壤N源丰富,能提高土壤微生物ACP的分泌量,但由于土壤P供应不足,土壤微生物受到P的限制,不利于微生物ACP的分泌。
CAT不仅能氧化过氧化氢,也能将酚类、胺类等物质氧化为醌,加速土壤有机物的分解和腐殖质的合成[17]。本研究中,随着森林植被恢复演替,土壤CAT活性也先增加后降低,PM-LG、CA较高,LG-CG有所下降,CL最低,表明CL土壤的解毒能力较差,土壤有机物的分解和腐殖质的合成较低。BC/SOC、SOC是CAT活性的主要影响因子,且两者对CAT活性具有较强的正作用,而其他因素则通过BC/SOC、SOC对CAT活性具有较强的负作用,使得BC/SOC、SOC与CAT相关性不显著。
土壤微生物与酶的关系是森林土壤酶研究的重点之一,土壤微生物的种类和数量在一定程度上决定土壤酶的来源及其活性[38]。本研究中,土壤BC、BN、BP与酶活性呈显著或极显著正相关关系,与已有的研究结果基本一致[12,39- 40],表明土壤微生物生物量与酶活性有着紧密的联系,不可分割。一方面,由于表土层水热、通气状况较佳,为土壤微生物呼吸和生长提供了良好的环境;另一方面,土壤酶主要来源于微生物、动植物残体及植物根系,表土层更易接受到凋落物、根系的补给,有机质、全氮、水分含量较高,有利于土壤微生物的生长和繁殖。因而4种林地0—15 cm土层BC、BN、BP,4种酶活性均高于15—30 cm土层,与现有的研究结果一致[41]。
土壤微生物生物量和酶活性受到诸多种因素的影响,尽管本研究土壤BC、BN、BP以及INV、URE、ACP、CAT活性的剩余余项的通径系数较低,但仍存在其他未考虑因素,如与植被群落组成结构有关的凋落物数量和质量、植被根系分泌物等。因此,今后对土壤微生物生物量和酶活性的研究应综合考虑植被因子和土壤因子的共同影响。此外,不同林分树种组成、季节差异和微生物群落变化也会影响土壤化学性质和酶活性,因此,本研究样地的季节动态和微生物群落还需进一步研究,才能更好地探究土壤化学性质、微生物群落和酶活性之间的联系,从而为揭示森林植被恢复演替对土壤养分恢复和维持的影响机制提供科学依据。
本研究中,土壤BC、BN、BP和ACP、CAT活性随着植被恢复先增加后略有所下降,与理论上的一直增加不一致,这可能正是采用空间代替时间方法研究植被演替的局限性。由于植被在空间序列上是非线性演替:环境和种源的差异可使群落多途径多方向发展。而在时间上具有较高的线性演替:群落沿着一个特定的方向发展[42]。森林群落演替研究的最好手段是建立固定样地进行长期动态研究[43],但这样花费时间长,投入经费多,因此从某种意义上,尽管空间代替时间有一定的局限性但也是必需的,现有的森林群落演替研究多采用“空间差异代替时间变化”的方法[44-45],如何消除和缩小演替在空间与时间序列上的差异是今后研究中应综合考虑的问题。
4 结论
土壤微生物生物量、酶活性总体上随着森林植被恢复呈增加趋势,表明森林植被恢复加快土壤C、N、P的周转速率,有利于土壤养分的恢复和维持。
土壤SOC、TN、TP含量和TN/TP、SOC/TP比值是土壤BC、BN、BP的直接影响因素和主要影响因素;土壤INV、URE、ACP、CAT活性的直接影响因素和主要影响因素不同,其中,INV、ACP的直接影响因素和主要影响因素为TN和TN/TP,URE为BP/TP和BP,CAT为BC/SOC和SOC,且土壤BC、BN、BP之间及其与土壤酶活性呈显著或极显著正相关关系,表明土壤养分含量、微生物生物量、酶活性有着紧密的联系,不可分割。因此通过适当的经营管理措施,促进森林植被恢复,改善林分树种组成,特别是增加阔叶树比例,提高土壤微生物学活性,是恢复和维持土壤生产力重要途径。
