GDF-15在预测和监控表柔比星/环磷酰胺-多西他赛-曲妥珠单抗辅助治疗HER-2阳性乳腺癌患者产生心脏毒性中的作用
2019-09-04胡琳沈佳
胡 琳 沈 佳
人表皮生长因子受体2(Human epidermal growth factor receptor 2,HER-2)阳性乳腺癌其癌细胞侵袭性强,如不积极治疗,患者往往预后不良[1-2]。曲妥珠单抗可以有效抑制HER-2阳性乳腺癌的癌细胞增殖并显著改善患者预后[3-4]。然而,治疗可能带来严重的心脏毒性,且心脏毒性的发生风险在曲妥珠单抗和蒽环类化疗药物联合使用的时候明显增加[5-6]。生长分化因子15(Growth differentiation factor 15,GDF-15)被报道可能用来预测曲妥珠单抗联合蒽环类化疗药物治疗带来的潜在心脏毒性[7]。然而此研究基于白色人种,对中国人群参考价值有限,且针对目前临床上HER-2阳性乳腺癌患者最常用的辅助治疗方案之一表柔比星/环磷酰胺-多西他赛-曲妥珠单抗(Epirubicin/cyclophosphamide-docetaxel-trastuzumab,EC-D-T),GDF-15对其可能产生的心脏毒性的预测作用也尚不清楚。因此,本研究旨在评估EC-D-T辅助治疗HER-2阳性乳腺癌患者的心脏毒性以及GDF-15对其心脏毒性发生风险的预测和监控作用。
1 资料和方法
1.1 研究对象
本研究连续纳入于2014年1月—2016年12月在上海交通大学医学院附属瑞金医院接受手术治疗且术后准备接受EC-D-T辅助治疗的HER-2阳性乳腺癌患者73例。入组标准:(1)经临床、影像、病理证实为原发性乳腺癌且经免疫组化或荧光原位杂交技术检测确诊为HER-2阳性乳腺癌;(2)术后准备接受EC-D-T辅助治疗;(3)年龄大于18周岁;(4)左心室射血分数(Left ventricular ejection fraction,LVEF)≥55%;(5)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况评分≤1。排除标准:(1)转移性乳腺癌;(2)既往或同期患有其他恶性肿瘤;(3)严重感染;(4)骨髓、肝脏或肾脏功能严重异常;(5)冠心病、心肌梗死、心衰史;(6)妊娠和哺乳期妇女。入组患者平均年龄为49.7±7.2岁,平均身体质量指数(Body mass index,BMI)为22.7±2.2 kg/m2;ECOG评分0分的患者53例(72.6%)、1分的患者20例(27.4%);吸烟患者15例(20.5%);患有高血压的患者14例(19.2%)、糖尿病的患者4例(5.5%)、高血脂患者19例(26.0%)、高尿酸血症患者12例(16.4%)、慢性肾病患者5例(6.8%);基线期平均LVEF为(66.3±4.8)%、心肌肌钙蛋白I(Cardiac troponin I,cTnI)中位水平为0.04 ng/mL(四分位值:0.01~0.08 ng/mL)、氨基末端脑钠肽前体(N terminal pro B type natriuretic peptide,NT-proBNP)中位水平为0.08 ng/mL(四分位值:0.06~0.10 ng/mL)。本研究获得上海交通大学医学院附属瑞金医院伦理审查委员会批准,入组前所有患者均已签署知情同意书。
1.2 治疗方案
所有患者术后接受EC-D-T辅助治疗,具体方案如下:表柔比星(E)100 mg/m2d1静脉注射(iv),环磷酰胺(C)600 mg/m2d1 iv,21天为1个周期,连续4个周期。然后序贯多西他赛(D)75~100 mg/m2d1 iv,21天为1个周期,连续4个周期;曲妥珠单抗(T)4 mg/kg iv与多西他赛(D)第一次使用时一起联用,随后每周2 mg/kg,连续11周后(即多西他赛4个周期结束后),再以6 mg/kg d1 iv,21天为1个周期,连续12个周期。曲妥珠单抗前后共计使用1年。
1.3 血液样本采集和处理
分别于辅助治疗前(M0)、表柔比星和环磷酰胺化疗第4个周期结束时(M3)、多西他赛化疗第4个周期结束时(M6)以及曲妥珠单抗6 mg/kg d1 iv,21天为1个周期,治疗第4个周期结束时(M9)、第8个周期结束时(M12)和第12个周期结束时(M15)采集所有患者的血液样本。采集的样本室温下放置30 min待其凝固后,在3 000 r/min 4℃条件下离心分离10 min,吸取血清转移至EP管置于-80℃保存,待后续检测。
1.4 GDF-15、cTnI、NT-proBNP水平检测
分别于M0、M3、M6、M9、M12和M15检测患者血清中GDF-15、cTnI和NT-proBNP水平。其中cTnI和NT-proBNP使用ADVIA Centaur XP免疫发光分析仪及配套试剂进行检测;GDF-15使用商业化酶联免疫吸附测定试剂盒进行检测,其检测过程完全依照使用说明书进行。
1.5 心脏毒性评估
患者于M0、M3、M6、M9、M12、M15接受心脏超声检查,并通过超声心动图评估患者LVEF水平,评估标准参考修正的Simpson方法[8]。患者出现以下任意一种情况即定义为发生心脏毒性:(1)LVEF水平相对于治疗前(M0)下降≥10%且LVEF的绝对值低于53%(正常值)[9];(2)心衰、急性冠状动脉综合征或重度威胁生命的心率失常[10]。
1.6 统计方法
采用SPSS 22.0软件进行统计学分析,连续性数据以均值±标准差或中位值(四分位间距)表示,分类数据以频次(百分比)表示。重复测量数据的比较采用重复测量方差分析;不同时间点前后比较采用配对t检验并采用Bonferroni校正;相同时间点组间比较采用独立样本t检验并采用Bonferroni校正。心脏毒性预测因素采用单因素和多因素Logistic回归进行分析,P<0.05为差异具有统计学意义。
2 结果
2.1 患者在不同时间点的LVEF水平
不同时间点LVEF采用重复测量方差分析Greenhouse-Geisser校正(F=127.946,P<0.001),表明不同时间点LVEF差异具有统计学意义。启动EC-D-T辅助治疗后,LVEF水平逐渐降低,直至M9后开始有一定数值上的回升。LVEF水平在M3、M6、M9、M12和M15均显著低于M0(P<0.001)(表1)。
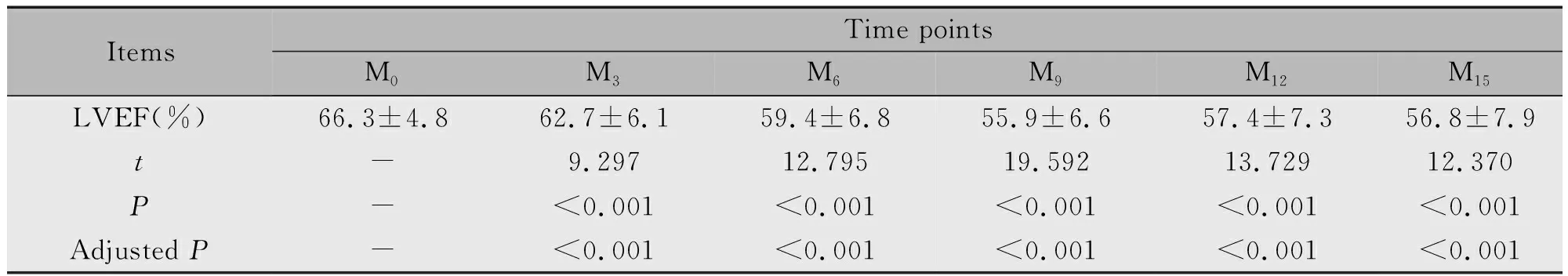
表1 不同时间点的LVEF水平
2.2 不同时间点心脏毒性的发生率
患者在研究期间出现△LVEF≥10%和LVEF<53%的总事件数为58例,而出现心衰、急性冠状动脉综合征和重度威胁生命的心率失常的事件数均为0例,因此合计出现心脏毒性的事件数为58例。同时,在M0,M3,M6,M9,M12和M15,累计发生心脏毒性的患者数分别为0(0.0%),0(0.0%),10(13.7%),16(21.9%),20(27.4%)和21(28.8%)(表2)。
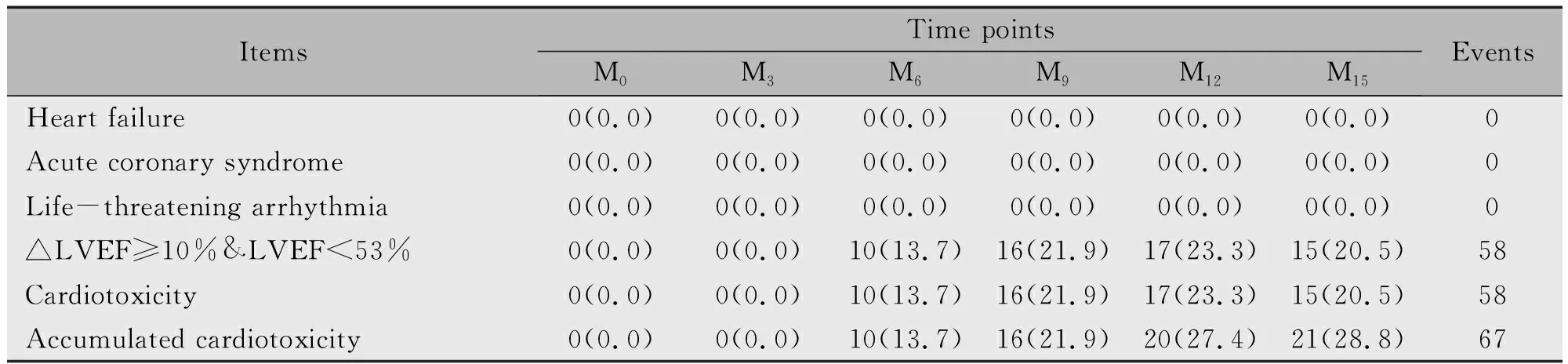
表2 不同时间点心脏毒性发生率[n(%)]
2.3 发生和未发生心脏毒性患者在不同时间点GDF-15、cTnI及NT-proBNP的水平
重复测量方差分析结果表明GDF-15(P<0.001)、cTnI(P<0.001)和NT-proBNP(P<0.001)在不同时间点有统计学差异。根据患者是否在M15内发生心脏毒性,将患者分为发生心脏毒性患者(N=21)和未发生心脏毒性患者(N=52)。在M0(P=0.036),发生心脏毒性患者其GDF-15水平显著高于未发生心脏毒性患者。同时,在M0(P<0.001),M3(P<0.001),M6(P=0.006),M9(P=0.030),M12(P<0.001)和M15(P=0.024),发生心脏毒性患者其cTnl水平也显著高于未发生心脏毒性患者。此外,发生心脏毒性患者其在各个时间点的NT-proBNP水平与未发生心脏毒性患者无统计学差异(P>0.05)(表3)。
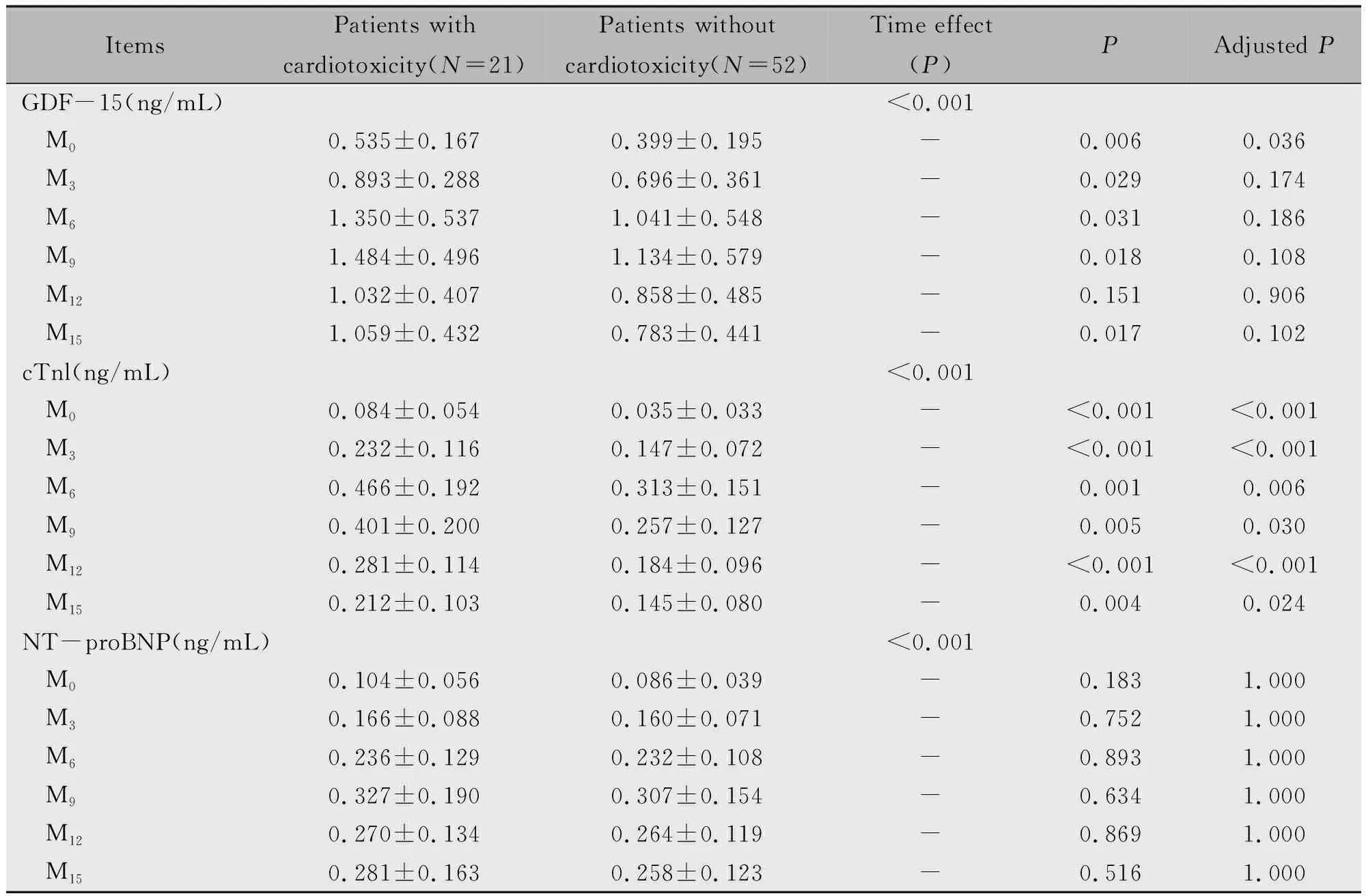
表3 不同时间点GDF-15、cTnI、NT-proBNP在发生和未发生心脏毒性患者中的水平
2.4 心脏毒性预测因素的Logistic回归分析
单因素Logistic回归分析表明GDF-15(P=0.010),BMI(P=0.019),吸烟(有vs. 无)(P=0.023),高血压(有vs. 无)(P=0.013),高血脂(有vs. 无)(P=0.042)及cTnl(P<0.001)可能是接受EC-D-T治疗的HER-2阳性乳腺癌患者心脏毒性的影响因素,多因素Logistic回归分析表明仅有cTnl(P=0.015)水平是接受EC-D-T治疗的HER-2阳性乳腺癌患者出现心脏毒性的独立预测因素(表4)。
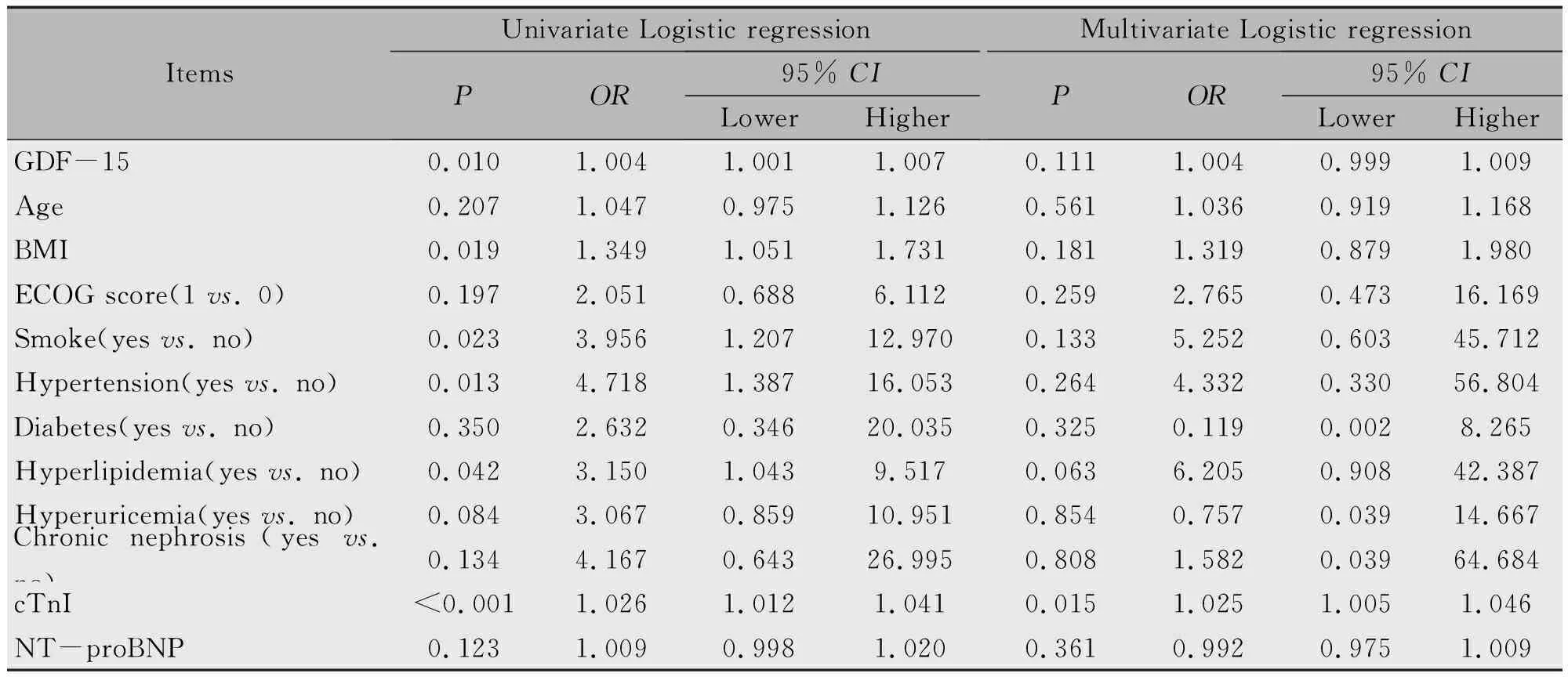
表4 心脏毒性预测因素的Logistic回归分析
3 讨论
曲妥珠单抗联合蒽环类化疗药物治疗是目前临床上治疗HER-2阳性乳腺癌最常用的化疗方案之一[11]。然而,这两个药物都存在潜在的心脏毒性风险,且两者联合用药引发的严重心脏毒性作用也被广泛报道[5,12]。例如,在一个大样本观察性研究中,652(17.5%)例接受曲妥珠单抗或曲妥珠单抗联合蒽环类化疗药物治疗的HER-2阳性乳腺癌患者出现心脏毒性;251(7.6%)例患者出现LVEF明显下降;106(2.8%)患者出现有症状的充血性心力衰竭[12]。在另一个临床研究中,39(27.3%)例接受曲妥珠单抗联合蒽环类化疗药物治疗的HER-2阳性乳腺癌患者出现心脏毒性,而仅有11(8.1%)例接受蒽环类化疗药物联合环磷酰胺治疗的患者出现心脏毒性[6]。在本研究中,HER-2阳性乳腺癌患者接受EC-D-T辅助治疗后LVEF显著降低;同时,患者接受治疗后的累计心脏毒性发生率达到28.8%,数值上略高于以往研究的17.5%和27.3%。可能的原因为:(1)本研究所有患者均接受EC-D-T辅助治疗,与以往研究患者的治疗方式及持续时间不完全相同;(2)心脏毒性的评估时间差异与纳入患者的基线信息差异(如种族,年龄等)也可能导致本研究心脏毒性发生率高于以往研究。
GDF-15被发现与心血管疾病发生发展密切相关[13-15]。有研究发现GDF-15水平与LVEF<30%和高敏肌钙蛋白T显著正相关,且其高表达是心衰患者不良预后的独立预测因素,提示GDF-15对心衰患者疾病严重程度和预后具有预测价值[14]。另一项研究发现GDF-15可以区分先天性心脏病伴肺动脉高压患儿和不伴肺动脉高压患儿,提示GDF-15对先天性心脏病患儿肺动脉高压的患病风险具有预测作用[15]。鉴于GDF-15对多种心血管疾病患病风险和严重程度具有预测作用,我们推测GDF-15也可能对接受曲妥珠单抗联合蒽环类化疗药物治疗的HER-2阳性乳腺癌患者的心脏毒性发生风险具有预测价值。然而,目前仅有两个相关报道,且这两个研究均基于白色人种,对中国人群的参考意义有限[7-8]。在本研究中,我们发现接受EC-D-T治疗后发生心脏毒性的HER-2阳性乳腺癌患者其在基线期的GDF-15水平均显著高于治疗后未发生心脏毒性的患者。我们结果可能的原因为:GDF-15在心肌损伤患者中表达上调,因此治疗前GDF-15表达上调的HER-2阳性乳腺癌患者可能存在潜在的心肌损伤,而这类患者在接受EC-D-T治疗后更容易出现心脏毒性[14-16]。
本研究尚有一些不足。首先本研究样本量较小,可能降低统计学效能。其次,本研究只评估了GDF-15水平与接受EC-D-T治疗后HER-2阳性乳腺癌患者的心脏毒性发生风险的关系,而GDF-15与这些心脏毒性的相关机制需要进一步深入研究。
综上所述,GDF-15可能作为新的预测HER-2阳性乳腺癌患者接受EC-D-T治疗后心脏毒性发生风险的生物标志物。
