南方根结线虫侵染烟草抗感品种前后的代谢组学分析
2019-09-04田培李晓辉贺文俊段杜薇徐世晓杨铁钊
田培,李晓辉,贺文俊,段杜薇,徐世晓,杨铁钊
河南农业大学烟草学院,郑州市文化路95号 450002
烟草根结线虫病是世界各国烟草生产中的主要病害之一,尤其以南方根结线虫危害为重。我国烟区南方根结线虫病发生范围广、危害重、防治难度大[1-3]。受环境和经济水平所限,我国大部分缺水旱作烟区无法开展水旱轮作,多采用化学手段防治,虽取得了一些成效,但也造成了烟叶农药残留增加、烟叶品质下降和环境污染加重等后果[4]。不同烟草品种对南方根结线虫表现明显的抗性差异,种植抗病品种或抗/耐基因的利用是防治根结线虫病最有效、最经济和最环保的方法[5]。在烟草与根结线虫的互作中,烟草细胞识别线虫入侵后,会激活自身免疫反应,包括抗病相关的代谢产物的合成,或者信号分子的产生以调节代谢过程[6]。代谢组学主要是比较两组或多组生物样本之间代谢模式的差异,进一步研究一些关键的不同代谢物的功能和意义[7],在药物作用机理研究、功能基因研究、代谢途径及网络调控机理解析、作物育种等许多领域有广泛应用[8]。根结线虫侵染烟草过程中互作方面的研究多在转录组和蛋白组的水平[9-10],而涉及烟草代谢组学的研究多集中在基因功能解析、不同组织器官代谢差异、烟草香味物质调控等方面[11-12]。利用代谢组学手段研究根结线虫侵染抗感烟草品种代谢途径的差异还未见相关报道。本研究以抗病品种G28与感病品种长脖黄为材料[13-14],采用LC/MS分析技术,探讨其受南方根结线虫侵染后在代谢组水平上发生的变化。通过对差异代谢物和代谢途径的分析,为烟草与南方根结线虫互作机理的深入研究和根结线虫病的防治提供参考。
1 材料与方法
1.1 试验材料
试验于2017年在河南农业大学科教园区进行。供试烟草品种为抗病品种G28与感病品种长脖黄,均由河南农业大学育种实验室提供。南方根结线虫由云南农业大学提供病土培养番茄,按照刘维志[15]的研究方法分离获得。所用试剂包括:甲醇、甲酸、水、乙腈、碳酸氢铵均购自CNW公司,L-2-氯苯丙氨酸购自上海恒创生物科技有限公司。所有化学药品和溶剂均为分析纯或色谱级。
1.2 试验方法
1.2.1 试验设计
G28(G)与长脖黄(C)均播于无菌基质的穴盘中,并进行标准化育苗。成苗后,选取长势均匀的壮苗移入塑料盆(直径10 cm,高8.3 cm)中,每个塑料盆栽一棵,按照随机区组排列。移栽10 d后,每个品种选择长势均匀一致,无病害的壮苗,设置4个处理:1)G28接种J2s悬浮液(G_RKN);2)长脖黄接种J2s悬浮液(C_RKN);3)G28接种清水(G_CK);4)长脖黄接种清水(C_CK)。每个处理(含3株烟苗)重复3次。接种10 d后,将4组处理分别拔出根部,用清水冲洗干净,放入液氮中保存备用。
1.2.2 南方根结线虫的繁育与接种
南方根结线虫在感病番茄品种早丰中扩繁。番茄移栽后3个月,出现明显根结时,选取有南方根结线虫卵块的根结,用1%的NaClO液消毒,再用去离子水冲洗干净,放置于26℃恒温培养箱中孵化。3~4 d后收集孵化出的二龄幼虫(J2s),显微镜下计数,制成300条/mL的J2s悬浮液,在24h内进行接种处理。接种方法为在烟株根部周围(1~2 cm左右)打孔(5孔/盆),在孔内注入5 mL悬浮液/清水,用基质掩埋[16]。
1.2.3 LC/MS样品前处理[17]
烟草根部磨碎后称取80 mg,放入1.5 mL离心管中,加入20 μL内标(L-2-氯苯丙氨酸,0.3 mg/mL,甲醇配置)和1 mL的甲醇与水混合液(体积比为7:3); -20℃放置2 min预冷,加入研磨机研磨2 min(60 Hz,);继而超声提取30 min(4℃); -20℃静置20 min后,离心15 min(13000 rpm,4℃),用注射器吸取200 μL上清液,每个样品重复3次,并将3次上清液合并;使用0.22 μm的有机相针孔过滤器过滤后,转移到LC进样小瓶,-80℃条件下保存,进行LC- MS分析。
1.2.4 LC/MS分析
采用沃特世科技有限公司的UPLC超高效液相色谱与ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)色谱柱,柱温45℃,流动相A为含0.1%甲酸的超纯水,流动相B为含0.1%甲酸的乙腈;流速为0.4 mL/min,进样体积为5 μL。洗脱梯度见表1。
采用美国应用生物系统公司的高分辨质谱仪。质谱条件为电喷雾离子源ESI,样品质谱信号采集分别采用正负离子扫描模式。质谱参数见表2。
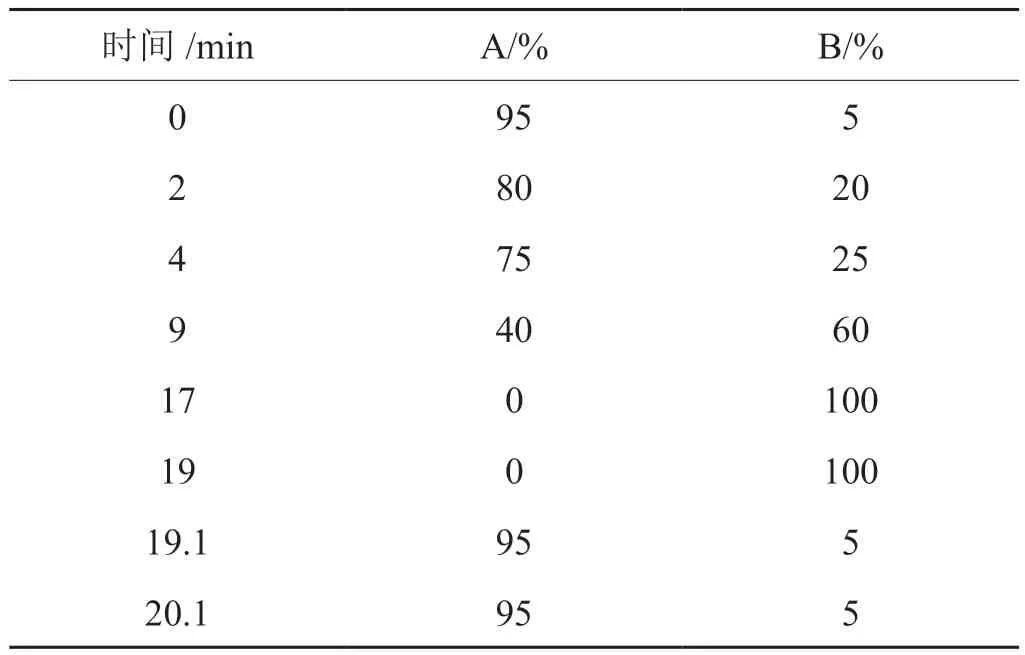
表1 洗脱梯度Tab.1 Elution gradient

表2 质谱参数Tab.2 Mass spectrometry parameter
质控样本(QC)由所有样本的提取液等体积混合制备而成,每个质控样本的体积以及分析方法与样本完全相同,在分析过程中,每10个分析样本中插入一个质控样本。
1.2.5 数据分析流程
首先通过去噪平滑,基线矫正,重叠峰识别等步骤提取LC/MS数据。其次对4组烟草样本(G_RKN、G_CK、C_RKN、C_CK)的代谢组原始数据采用有监督的偏最小二乘法(PLS-DA)与正交偏最小二乘法(OPLS-DA)进行分析。再应用中国科学院大连化学物理研究所与大连达硕信息技术有限公司联合开发的代谢组学小分子化合物快速鉴定分析软件系统(OSI / SMMS) 鉴定差异代谢物。所用数据库为The Human Metabolome Database(HMDB,网址:http://www.hmdb.ca/)和METLIN的一级数据(网址:https://metlin.scripps.edu/),并参考中国科学院大连化学物理研究所与大连达硕信息技术有限公司建立的标准物质数据库(Main Standard Library)。OPLS 建模需要以 PLS 模型通过验证为基础[18]。筛选组间差异代谢物的标准为OPLS-DA模型第一主成分的VIP值 >2,t检验(student’s t test)的P<0.05。最后把差异代谢物映射到KEGG数据库(网址:http://www.genome.jp/KEGG/pathway.html),使用 MBRole(http://csbg.cnb.csic.es/mbrole/)网站的ID转换功能,获取差异代谢物的KEGG的物质 ID号,再通过MBRole通路分析功能,利用差异代谢物的KEGG ID进行通路富集分析,获得代谢通路富集结果。
2 结果与分析
2.1 G28与长脖黄根部样品的LC/MS分析和数据预处理
图1为正离子模式下抗病品种G28根部典型的基峰离子流图,图2为正离子模式下感病品种长脖黄根部典型的基峰离子流图。原始质谱数据经过XCMS软件处理后检测到2978个代谢物(由保留时间和质荷比值组成的数据对表示)。

图1 G28处理组与对照组样品的基峰离子流图Fig.1 Base peak ion current chromatograms of G28 roots of the treatment group and control group

图2 长脖黄处理组与对照组样品的基峰离子流图Fig.2 Base peak ion current chromatograms of Changbohuang roots of the treatment group and control group
2.2 根结线虫诱导差异代谢产物的鉴定
图3是4组烟草样本的PLS-DA分析的得分图,处理组和对照组的分离趋势明显。由模型参数表3得,两个主成分的累计值Q2(cum)分别高达 0.995与0.998,且两个成分对 X 和 Y的累积解释能力R2X(cum)和R2Y(cum)分别为 0.819、1与0.925、1,说明模型的稳定性和可预测能力以及对数据的拟合度较好,满足 OPLS-DA 的建模要求。
为防止模型过拟合,同时获得导致两组样本存在差异的准确代谢物信息,采用七次循环交互验证(7-fold cross validation)和200次响应排序检验(response permutation testing,RPT)的方法来考察模型的质量。图4显示处理组(RKN)与对照组(CK)有明显区分,说明根结线虫侵染对抗、感品种根部代谢有影响,由于感病品种长脖黄分离更加明显,预示感病品种侵染前后代谢差异更大。
表4数据显示,OPLS-DA模型可以清楚地解释两个品种对照组和处理组之间的差异,且两组模型的预测能力较好,模型质量较高。拟合验证结果见图5,所得参数Q2<0,表明得到了正确预测的样本,说明采用OPLS-DA模型能够有效地找出对照组和处理组间的最大差异,适合进行后续分析。

图3 G28、长脖黄处理组与对照组PLS-DA分析的得分图Fig.3 PLS-DA score plot of G28 & changbohuang treatment group and control group

表3 模型累积解释率Tab.3 Cumulative interpretation rate of model

图4 G28、长脖黄处理组与对照组OPLS-DA分析的得分图Fig.4 OPLS-DA score plot of G28 & changbohuang treatment group and control group

图5 G28、长脖黄OCS-PLS模型过拟合验证Fig.5 Over-fitting validation of G28 & changbohuang OCS-PLS model

表4 模型累积解释率Tab.4 Cumulative interpretation rate of model
2.3 差异代谢物的鉴定
接种南方根结线虫后,G28共筛选出77个差异代谢物,其中上调的有45个,下调的有32个;长脖黄共筛选出87个差异代谢物,其中上调的有59个,下调的有28个。OPLS-DA模型中VIP值越大,说明差异越显著。表5、6中列出的均为VIP值大于4的化合物,初步标记为差异明显的化合物。FC为接种后差异物含量的倍数变化。表中的差异代谢物包括生物碱类物质、脂肪酸、类黄酮、萜类和聚酮等化合物,说明这些化合物可能参与烟草对南方根结线虫的抗病反应。此外,比较倍数变化值可看出,两个品种接种后,G28代谢产物含量的提高倍数均高于长脖黄,说明G28的代谢更为活跃。

表5 G28重要差异代谢物鉴定结果Tab.5 Identification of partial important DEMs in G28
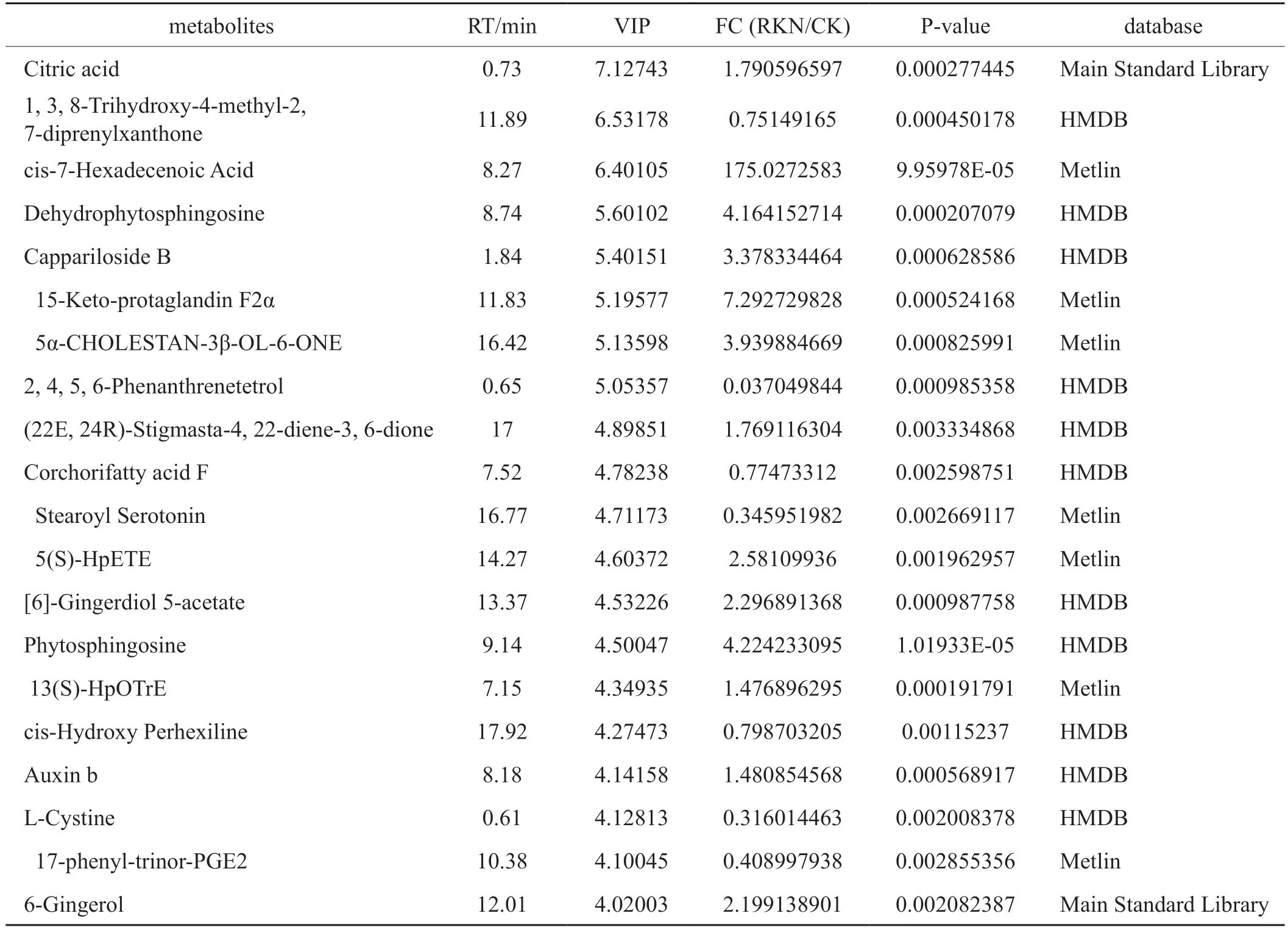
续表5
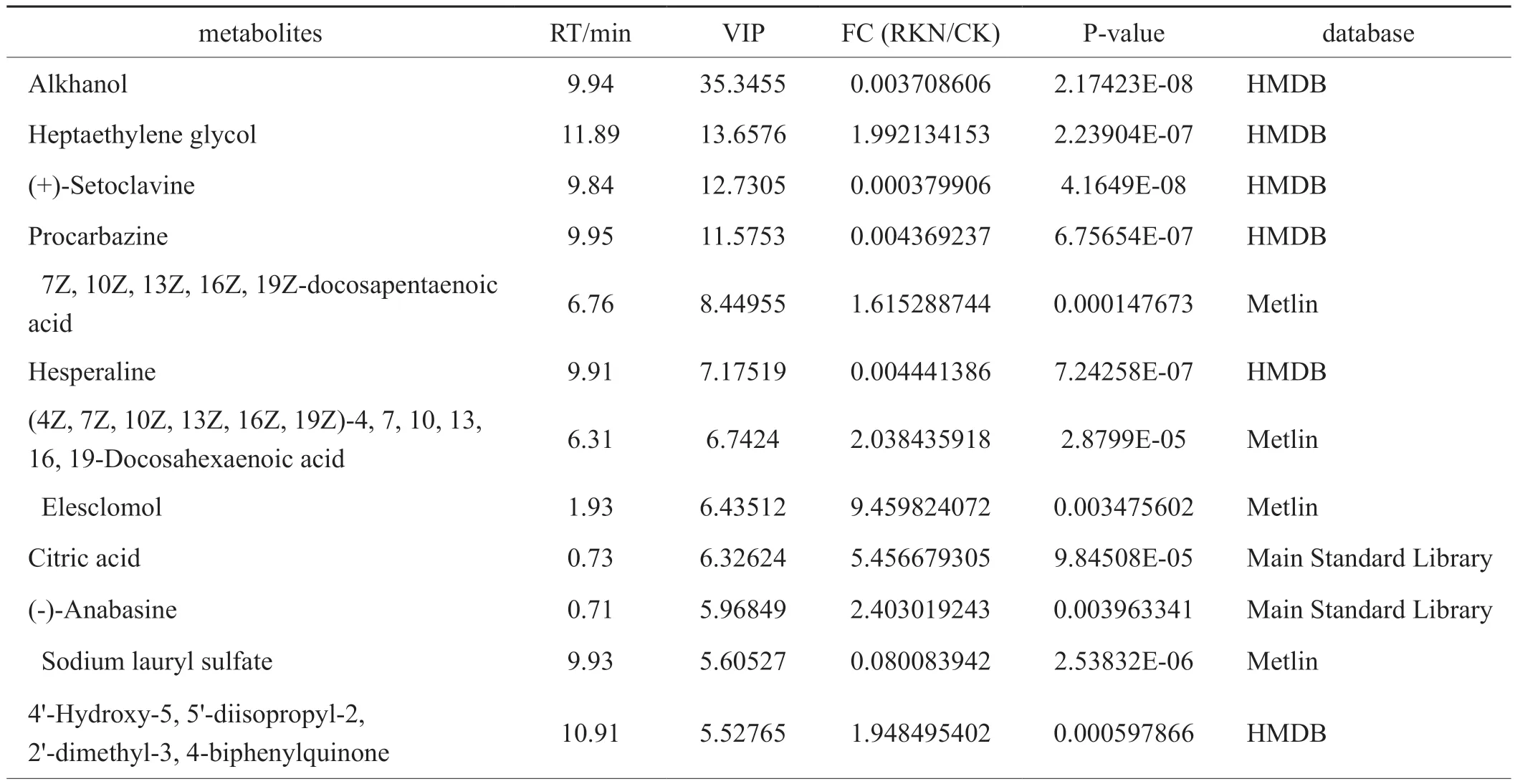
表6 长脖黄重要差异代谢物鉴定结果Tab.6 Identification of partial important DEMs in Changbohuang

续表6
2.4 差异代谢物的代谢通路分析(基于KEGG数据库)
表7列出了G28与长脖黄差异代谢物关于代谢通路分析的摘要信息。再进行通路富集分析 (表8、9)。最后代谢通路中p<0.05的部分,以代谢通路名称为横坐标,以-log(p-value)为纵坐标绘制代谢通路富集图。
根据表7可知,G28与长脖黄共有的差异代谢产物是柠檬酸(Citric acid)与磷酸(Phosphoric acid)。在G28中,柠檬酸参与了8条代谢通路,在长脖黄中,柠檬酸参与了3条代谢通路,两个品种共有的代谢通路有3条;磷酸在G28与长脖黄中均参与了2条代谢通路,共有代谢通路有2条。图6和7所示,G28和长脖黄被南方根结线虫侵染后引起的差异代谢产物分别参与了10种和5种代谢途径。说明两个烟草品种在南方根结线虫侵染后代谢途径存在一定的差异性。综合表7、8及图6,G28特有的代谢途径为:萜类和聚酮类生物碱代谢,鸟氨酸、赖氨酸和烟酸生物碱代谢,萜类和甾体代谢以及莽草酸途径。说明抗性品种G28通过自身特有的差异代谢产物变化,影响了一些代谢途径变化,从而有助于抵抗南方根结线虫的侵染。还可以看出G28发生变化的代谢通路主要与生物碱代谢、植物激素代谢相关。综合表7、9以及图7可看出感病品种长脖黄的主要代谢通路变化是苯丙的生物合成。

表7 G28与长脖黄差异代谢物关于代谢通路分析的摘要信息Tab.7 Summary of G28 & Changbohuang DEMs

表8 G28差异代谢通路富集表Tab.8 Pathway analysis of G28 DEMs

表9 长脖黄差异代谢通路富集表Tab.9 Pathway analysis of Changbohuang DEMs

图6 G28差异代谢物通路富集图Fig.6 Pathway analysis of G28 DEMs

图7 长脖黄差异代谢物通路富集图Fig.7 Pathway analysis of Changbohuang DEMs
3 讨论
本试验以抗病品种G28与感病品种长脖黄作为试验材料,利用LC/MS分析技术探索接种前后烟草根部代谢产物的变化。OPLS-DA分析发现,不同品种与处理间有明显的分离趋势。通过对差异代谢物进行通路富集分析,可以帮助理解在抗、感品种中代谢途径变化机制。鉴定G28与长脖黄差异代谢产物都发现了抗病相关的物质,如生物碱类物质、脂肪酸、类黄酮、聚酮等,其中G28中还鉴定出了很多萜类物质。生物碱可增加寄主植物抗螺旋线虫(helicotylenchus dihystera)、根结线虫(root knot nematode)、跟斑线虫(paratylenchus scribneri)的能力,还可以增加寄主的抗病性,抑制病原菌的生长繁殖[19]。脂肪酸不仅是所有生物中重要的营养物质和能量,还是脂类物质的重要组成部分[20]。早期研究发现,脂肪酸在植物防御中的作用是被动进行的,扮演的角色为表皮组分或者植物激素(茉莉酸)的生物合成前体[21]。随着研究的深入,证实越来越多的脂肪酸或者其降解产物直接诱导了各种植物防御反应,并且发现脂肪酸及其衍生物对植物免疫有重要作用[22]。类黄酮、萜类、聚酮类物质都与抗病性有关[23]。本研究结果还发现无论抗感品种筛选出的差异代谢物中烷醇类物质都具有显著性差异,这可能与烷醇类物质影响植物的抗(耐)性有关,Seo 等发现拟南芥的抗旱能力与角质层蜡质中烷类和醛类物质呈正相关[24],还有研究表明三十烷醇在提高植物的光合作用、促进根和茎的生长、缓解各种胁迫(如盐、镉胁迫)等有重要的作用[25-26]。由此推测烷醇类物质的显著性变化可能与根结线虫侵染引发植物的防卫反应有关。
代谢组分析结果表明南方根结线虫侵染在抗病和感病烟草植株中均引起了复杂的应答反应。差异代谢物的代谢通路分析结果显示,抗性品种的生物碱代谢与植物激素代谢途径均达到极显著水平,其中鸟氨酸、赖氨酸、组氨酸、 色氨酸等不仅是生物碱合成途径的起始物质,也与体内相应蛋白质的合成密切相关[27-28]。已有研究表明,这几种氨基酸及其代谢产物,参与木质素、苯丙素、生物碱等抗病相关次级代谢产物的合成途径[18][29]。本研究发现在G28中,柠檬酸(Citric acid)与D型3-磷酸甘油醛(D-Glyceraldehyde 3-phosphate)参与了植物激素的合成途径。在逆境条件下,植物内源激素不仅可以调节生长发育过程,也作为一种微量信号物质调控抗病反应[30],并且多种植物激素相互协同或拮抗作用使植物对病原物的防御能力有所提升[31]。所以线虫侵染造成根系损伤也必然会影响体内原有的激素平衡状态[32-34],而本研究也从代谢角度证明了植物激素对抗病反应的调控作用。柠檬酸、磷酸均为抗病途径的重要中间产物,其次,莨菪亭属于多酚类物质,也是植物抗逆反应的重要参与者[35]。另外,苯丙的生物合成,萜类和甾体代谢,莽草酸途径,氧化磷酸化作用,TCA循环等代谢通路也都发生了明显变化,在前人研究中,这些途径都与植物抵抗逆境相关,所以推测这些代谢通路与南方根结线虫入侵体内产生防御机制有一定联系[36-39]。
4 结论
由分析结果看出,抗病品种G28有10条抗病相关的代谢通路发生了明显变化,其中有4条通路变化有极显著性;而感病品种长脖黄仅仅只有5条抗病相关的代谢通路,其中只有1条有极显著性。这也说明了南方根结线虫入侵时,抗病品种中的抗病相关代谢通路被激活的更多,这也为选育高抗品种提供了理论价值和应用参考。
综上所述,南方根结线虫侵染抗、感品种前后代谢方面的响应有很大差异,这对于防控病虫害,开展高抗新品种选育以及烟草抗根结线虫病机理的深入研究有重要意义。
