邵武烟田土壤微生物群落结构变化与烟草青枯病发生关系初报
2019-09-04陈乾锦林书震李红丽李小龙芦阿虔沈建平郭夏丽王岩
陈乾锦,林书震,李红丽,李小龙,芦阿虔,沈建平,郭夏丽,王岩*
1 南平市烟草公司光泽分公司,福建杭川光明大道中路64号 354100;
2 郑州大学化工与能源学院,河南郑州科学大道100号 450000;
3 南平市烟草公司邵武分公司,福建邵武闽星花园烟草办公大楼 354000
青枯病是由青枯雷尔氏菌(Ralstonia solanacearum)引起的细菌性枯萎病,是多种农作物产量损失的重要原因[1]。烟草青枯病在我国东部和南部烟区发生严重,每年有大面积烟田遭到青枯病感染[2]。以往的研究着重于土壤理化性质、微生物数量的变化以及各种防治措施对烟草青枯病的影响,较少关注烟田土壤中微生物群落的变化[3-4]。了解土壤微生物与作物种植之间的相互作用有助于农业生产。一方面,土壤中的病原菌突破植物防御机制并引起疾病;另一方面,土壤微生 物在促进植物生长健康和保护植物免受疾病侵害方面发挥着关键作用[5-6]。研究发现,健康土壤中微生物的种类和多样性不同于感染过细菌枯萎病的土壤[7],这是因为植物缺乏对大多数病原体的遗传抗性,植物通过根部分泌物吸引土壤微生物的拮抗成员,以抵御土壤中病原体和其他害虫的侵害[8]。
邵武是福建省重要的植烟区,该地区受烟草青枯病危害严重。本试验利用土壤微生物基因测序技术,比较健康烟田(未发病或者零星发病)和发病烟田(发病率高于20%)之间土壤微生物的群落结构变化,分析微生物与烟草青枯病之间的关系,对于提高烟田土壤健康和防治烟草青枯病提供理论依据。
1 材料与方法
1.1 试验地点
试验地点位于福建省邵武市。该地区气候温暖湿润,光照充足,常年平均降雨量1800mm左右,年平均气温18℃。试验地点海拔200m~250 m。试验烟田土壤类型为砂质壤土,均为酸性土壤。供试烤烟品种为K326,试验地前茬作物均为水稻。
1.2 试验设计
试验于2017年2~7月在以下4个试验区同时进行,分别为三都(N27°23′ E117°34′,250 m)、芹田(N27°18′E117°27′,198 m)、沿山(N27°29′ E117°36′,232 m)和洋坑(N27°10′ E117°32′,213 m)。根据邵武市烟草公司提供的历年青枯病发生数据,每个试验区选取一块往年发病率均超过20%的烟田作为发病试验田,并在发病试验田就近选择一块往年未发病或者零星发病烟田作为健康试验田。4个试验区地势、土壤质地和农业管理措施均相同。分别在烟株移栽前、旺长期(移栽后50 d)和发病期(移栽后90 d)采集根部土壤,进行16S rRNA和18S rRNA基因测序。
1.3 测定内容及方法
1.3.1 土样采集
采用S型五点取样法采取烟株根部土壤。健康烟田均采取健康烟株根部土壤,4个健康试验田在2017年发病率分别为1.99%、4.72%、4.39%、7.47%(发病期取样时调查所得,下同)。发病烟田在烟株发病前取普通烟株根部土壤,6月2日采集发病烟田土壤时,正值烟株生长进入成熟初期并有大量烟株出现青枯病症状(此时病株茎基部黑色条斑平均约10~20 cm),4个发病试验田在2017年发病率分别为84.78%、78.90%、66.84%、67.16%。采集土样时尽量选取发病程度相似的5株以上病株取其根部土壤。首先去除烟株根部表层土壤,以烟株茎部为中心直径10 cm左右、深10 cm左右处的土壤进行取样。取样后用密封袋低温封存,部分送往实验室在4℃下冷藏以待微生物数量测定,部分用15 ml离心管装满立即送往上海美吉生物医药科技有限公司对微生物进行基因测序。
1.3.2 土壤微生物定量测定
采用稀释平板法[9]测土壤微生物数量。细菌采用牛肉膏蛋白胨培养基、放线菌采用高氏一号培养基、真菌采用孟加拉红培养基。
1.3.3 土壤微生物基因测序
DNA抽提和PCR扩增:根据E.Z.N.A.® soil试剂盒(Omega Bio-tek,Norcross,GA,U.S.)说明书进行总DNA抽提,DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶泳检测DNA提取质量;细菌16S用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物对V3-V4可变区进行PCR扩增;真菌18S用SSU081F(5’-TTAGCATGGAATAATRRAATAGGA-3’)和1196R(5’-TCTGGACCTGGTGAGTTTCC-3’)引物对V5-V7可变区进行PCR扩增。
Illumina Miseq 测序:使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用 QuantiFluor™-ST(Promega,USA)进行检测定 量。根 据 Illumina MiSeq 平 台(Illumina,San Diego,USA)标准操作规程将纯化后的扩增片段构建文库,16S为PE 2*300文库,18S为PE2*250文库。用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。原始数据上传至NCBI数据库。
数据处理:原始测序序列使用Trimmomatic 软件质控,使用FLASH软件进行拼接,采用的UPARSE软件(version 7.1 http://drive5.com/uparse/),根据97%的相似度对序列进行OTU(operational taxonomicunit)聚类;应用UCHIME软件剔除嵌合体。利用RDP classifier (http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为70%。
1.4 数据计算与统计分析
采用Excel 2010对微生物数量进行计算分析和统计,测序数据在上海美吉生物医药科技有限公司提供的I-Sanger生物信息分析云平台进行处理分析。
2 结果与分析
2.1 土壤微生物数量分析
不同时期烟田土壤微生物的数量如表1所示。健康和发病烟田土壤中细菌、放线菌的数量均随烟株生长呈现出先增多后减少的趋势,真菌则是先减少后增多。各生长期发病烟田土壤的细菌、放线菌和真菌数量均高于健康烟田。细菌数量在烟株生长过程中变化明显,旺长期数量是移栽前的4.49倍,而在健康与发病烟田之间未出现显著差异。放线菌数量的变化较小,在各生长期、健康与发病烟田之间均无显著差异。真菌数量变化在烟株生长过程中存在显著差异,旺长期其数量比移栽前减少了57%左右,在发病期数量又有所增长。移栽前真菌数量在健康和发病烟田土壤之间存在显著差异,在发病烟田中数量较多,随后在旺长期和发病期数量差异减小。
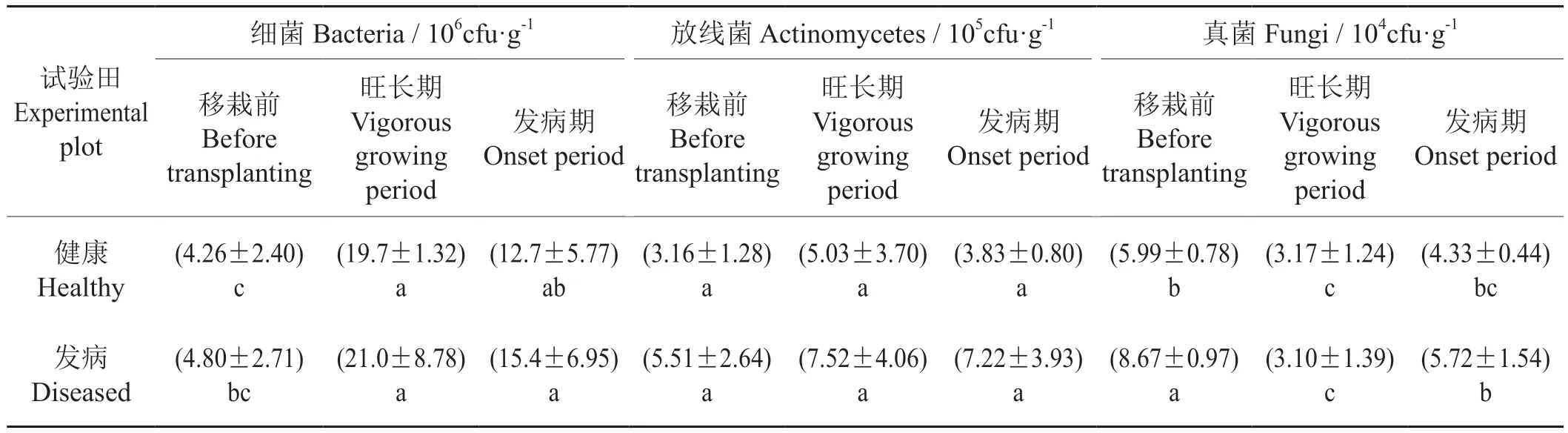
表1 不同时期烟田土壤微生物数量Tab.1 Number of microorganisms in tobacco soil in different periods
2.2 土壤细菌群落结构变化
2.2.1 门水平细菌
分析各时期烟田土壤中门水平细菌群落结构发现(图1),相对丰度最高的均是变形菌门(Proteobacteria,29.19%~34.30%),其次是绿弯菌门(Chloroflexi,14.27%~18.50%)、放线菌门(Actinobacteria,9.12%~18.68%)和酸杆菌门(Acidobacteria,12.02%~20.37%)。门水平细菌在健康与发病土壤中种类相似,但不同烟株生长时期丰度发生了改变,变化最明显的是放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)。旺长期放线菌门(Actinobacteria)相对丰度在健康和发病土壤中较移栽前分别增多了8.86%和7.14%,酸杆菌门(Acidobacteria)分别减少了7.86%和2.99%。发病土壤中放线菌门(Actinobacteria)丰度高于健康土壤;健康土壤中酸杆菌门(Acidobacteria)丰度在旺长期减少。除此之外,丰度较少的厚壁菌门(Firmicutes)、浮霉菌门(Planctomycetes)在旺长期增多,拟杆菌门(Bacteroidetes)和硝化螺旋菌门(Nitrospirae)减少。其中健康土壤中厚壁菌门(Firmicutes)的相对丰度较发病土壤高0.97%,发病土壤中浮霉菌门(Planctomycetes)、拟杆菌门(Bacteroidetes)和硝化螺旋菌门(Nitrospirae)较健康土壤分别高出0.32%、0.48%和0.62%。相对丰度小于1%的细菌同样在旺长期发生了变化,如旺长期装甲菌门(Armatimonadetes)、绿菌门(Chlorobi)相对丰度均降为移栽前的一半。

图1 土壤细菌在门水平上的群落结构Fig.1 Community structure of soil bacteria on the phylum level
2.2.2 属水平细菌
土壤中属水平细菌与门水平细菌群落结构变化一致,旺长期和发病期的细菌群落结构更为相似(图2)。丰度最高的是norank_c__Acidobacteria,平均相对丰度为3.68%,在移栽前的健康土壤中相对丰度最高(5.90%)。平均相对丰度大于2%的还有norank_f__Acidobacteriaceae__Subgroup_1_(3.04%~4.12%)、norank_f__Anaerolineaceae(1.94%~3.38%)、norank_c__SBR2076(2.07%~2.91%)、硝化螺旋菌属(Nitrospira,1.50%~3.29%)、unclassified_f__Micrococcaceae(1.22%~4.02%)。其中变化最明显的unclassified_f__Micrococcaceae在健康土壤中丰度均高于发病土壤,旺长期健康土壤中该菌相对丰度是发病土壤的1.93倍,是移栽前健康土壤的2.46倍。相对丰度小于1%的属水平细菌数量庞大,比例之和接近45%。这些细菌在健康和发病土壤之间同样存在差异,如Pseudolabrys、Burkholderia-Paraburkholderia在健康土壤中丰度均比发病土壤高,而地杆菌属(Terrabacter)、Gaiella、玫瑰弯菌属(Roseiflexus)在发病土壤中丰度较高。
2.2.3 细菌物种差异分析
为找出细菌在健康与发病土壤之间的差异性物种,将细菌相对丰度数据运用Wilcox秩和检验进行假设检验,评估物种丰度差异的显著性水平,从而获得显著性差异物种。按物种丰度降序,列出了旺长期、发病期在健康与发病土壤之间存在显著差异的前五种细菌(图3),分别是unclassified_f__Micrococcaceae、norank_o__JG30-KF-AS9、norank_f__Xanthobacteraceae、norank_f__YNPFFP1和norank_c__TK10。其中前三种细菌在健康土壤中丰度较高,后两种菌在发病土壤中丰度较高,这些存在显著差异的物种可能与土壤健康水平有关。
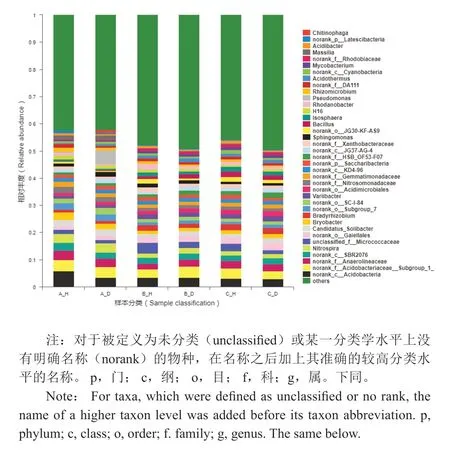
图2 土壤细菌在属水平上的群落结构Fig.2 Community structure of soil bacteria on the genus level
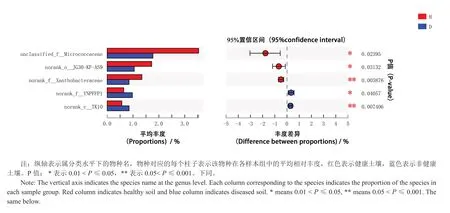
图3 细菌在属水平上的物种差异分析Fig.3 Species difference analysis of soil bacteria on the genus level
2.3 土壤真菌群落结构变化
2.3.1 门水平真菌
门水平上真菌种类较少,但在不同烟株生长时期丰度变化较大(图4)。相对丰度最高的是子囊菌门(Ascomycota,57.27%~91.10%),其次是担子菌门(Basidiomycota,2.72%~14.72%)和norank_k__Fungi(2.33%~18.45%),这三种真菌在土壤中相对丰度之和高达93%左右。发病土壤中子囊菌门(Ascomycota)丰度高于健康土壤,而担子菌门(Basidiomycota)和norank_k__Fungi与之相反。烟株移栽前发病土壤中子囊菌门(Ascomycota)相对丰度比健康土壤高出16.81%,而健康土壤中担子菌门(Basidiomycota)和norank_k__Fungi相对丰度分别比发病土壤多7.58%和9.80%;旺长期子囊菌门(Ascomycota)丰度在三个时期中最高,发病土壤中的相对丰度比健康土壤高3.55%;发病期子囊菌门(Ascomycota)丰度降低,但在发病土壤中仍然高于健康土壤,而健康土壤中norank_k__Fungi相对丰度是发病土壤的2.87倍。

图4 土壤真菌在门水平上的群落结构Fig.4 Community structure of soil fungi on the phylum level

图5 土壤真菌在属水平上的群落结构Fig.5 Community structure of soil fungi on the genus level
2.3.2 属水平真菌
如图5所示,属水平真菌相对丰度最高的是norank_o__Sordariales(17.12%~33.66%),其次为假霉样真菌属(Pseudallescheria,2.27%~27.57%)、unclassified_o__Pleosporales(7.53%~11.40%)、unclassified_o__Sordariales(5.59%~10.62%)和norank_k__Fungi(2.33%~18.45%)。其中假霉样真菌属(Pseudallescheria)、unclassified_c__Dothideomycetes、unclassified_o__Hypocreales、unclassified_f__Trichocomaceae、unclassified_o__Pezizales均属于子囊菌门,这些菌在旺长期丰度增多,且均在发病土壤中较高。
2.3.3 真菌物种差异分析
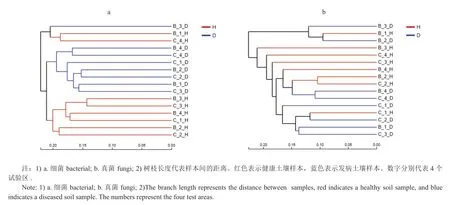
对旺长期、发病期土壤样本进行属水平上组间物种差异分析(图6),前五种具有显著差异的真菌分别是假霉样真菌属(Pseudallescheria)、镰刀菌属(Fusarium)、norank_o__Tremellales、norank_c__Sordariomycetes和norank_p__Basidiomycota。其中假霉样真菌属(Pseudallescheria)在健康与发病土壤之间的差异最明显,该菌在发病土壤中平均相对丰度是健康土壤的2倍,可能是影响烟草青枯病发病的重要物种。norank_c__Sordariomycetes的丰度虽然不高,但其显著性差异最大(0.001 图6 真菌在属水平上的物种差异分析Fig.6 Species difference analysis of soil fungi on the genus level 2.4.1 Alpha多样性分析 分析土壤微生物Alpha多样性可知(表2),本试验微生物样本覆盖度指数(Coverage)均在0.96以上,表明本次测序可以较好反映样本中微生物的真实情况。Sobs(the observed richness)值表示物种丰富度实际观测值,烟株旺长期时细菌Sobs值最高,真菌最低,与前述的微生物数量分析一致。对各个样品中微生物丰富度(Sobs、Chao1 )和多样性(Shannon)指数进行比较发现,健康土壤中细菌和真菌的丰富度指数和多样性指数均大于发病土壤,但并未达到显著性差异。 表2 土壤微生物的多样性指数Tab.2 Diversity index of soil microorganism 2.4.2 Beta多样性分析 图7 土壤微生物的层级聚类分析Fig.7 Hierarchical clustering analysis of soil microbial samples Beta多样性分析是研究不同样本之间微生物群落结构的相似性和差异关系,可对样本距离矩阵进行聚类分析,构建样本层级聚类树。通过对旺长期和发病期土壤样本进行聚类发现(图7),样本没有依照烟株生长期聚类,而是以土壤的健康水平进行聚类。细菌在健康和发病土壤样本之间的聚类更为明显,这说明健康和发病土壤之间因细菌群落结构不同而出现差异。从图7a中还可以发现,如B_4_D、C_4_D样本分别代表旺长期和发病期洋坑试验区的发病土壤,在树状图中距离最近,这说明地域对细菌的群落结构改变也存在影响。对真菌的层级聚类分析发现样本也存在一定的聚类,健康土壤样本集中在树状图中部,发病土壤样本集中在下部,但聚类效果并无明显规律。这说明烟田土壤的健康情况与真菌群落结构存在联系,但不如细菌紧密。 青枯病是福建烟草的主要病害,一般在每年4月下旬或5月上旬由南向北发生,5月中、下旬遇上适宜的气候(高温多雨)开始大规模爆发[10],此时烟株正处于旺长期中后期。根据微生物数量和物种组成分析可知,土壤微生物群落结构在旺长期时已经发生了改变,与青枯病出现的时间吻合,这主要由于烟株在旺长期后期根系活力逐渐转弱,根系分泌物减少,因而导致土壤微生物种类和数量等发生了变化。旺长期土壤微生物的群落结构改变可能正是导致烟草青枯病发病的重要原因。 层级聚类分析显示出健康与发病土壤样本之间存在差异(特别是细菌),这些差异可能由组间差异分析筛选出的物种导致。如细菌中unclassified_f__Micrococcaceae属于放线菌门(Actinobacteria)中的微球菌科,放线菌以其拮抗特性广为人知,可产生抗真菌化合物[11]。研究发现感染青枯病的土壤中微球菌丰度明显少于健康土壤[12]。Berendsen RL等认为土壤抑病能力不能归因于一种单独的微生物或类群,而是受到多种微生物所组成的整体影响[6]。微生物彼此之间通过相互作用,共同承担起抑制病害的作用。物种差异分析筛选出的细菌在土壤中的含量虽然较低,但它们在健康与发病土壤之间存在显著差异,可以推测健康烟田土壤在受到青枯菌侵染时,受到了以微球菌为主的多种细菌群体的抑制,从而降低了青枯病发病率。真菌中子囊菌(Ascomycota)丰度在发病土壤中普遍较多,子囊菌门(Ascomycota)含有数量庞大的植物病原菌,能够对植物的根部造成损伤侵害[13]。假霉样真菌属(Pseudallescheria)是健康与发病土壤之间存在显著差异且丰度最高的物种,属于子囊菌门(Ascomycota)中的小囊菌目(Microascales)。小囊菌目(Microascales)中的真菌不仅能引起多种植物病害,而且能引起包括人体在内的多种动物病害[14]。镰刀菌(Fusarium)是含量上仅次于假霉样真菌属(Pseudallescheria)的差异性物种,是一种著名的植物病原菌,可造成多种植物萎焉、根腐[15]。这些真菌虽然不是烟草青枯病的病原菌,但是它们寄生、腐生的营养方式可能会对烟株的根部进行破坏,为青枯病病原菌侵染烟株制造天然的入口[16]。 细菌和真菌的Alpha多样性分析表明健康土壤中微生物多样性高于发病土壤。以往的研究表明,土壤健康水平与微生物多样性呈正比,高水平的微生物多样性能够抑制土传病害的发生[17-19]。Beta多样性分析佐证了微生物群落结构在健康和发病土壤之间确实存在差异,且细菌比真菌更为明显。同时Beta多样性分析也证明了微生物群落结构与地理位置相关,因而研究土壤微生物与烟草青枯病的关系时还需要考虑其他生态因素。 值得注意的是,由于土壤取样过程中尤其是移栽前和旺长期取样时烟株尚未发病,因此很难做到100%的发病取样点落在病株10cm范围内,即取样点可能落到了健康烟株附近,这样就带来了取样土壤的误差,进而影响土壤微生物菌落结构和多样性随时间变化的误差。由于烟草青枯病常连片发生并且每年都在大致相同的区域内发生,所以本文研究中每次采集土壤时应尽量选择在相同的区域内,并且取样烟株不少于5株,取土后将5点土壤充分混合均匀后供测试所用,从而尽可能降低因取样给土壤微生物菌落结构和群体多样性随时间变化带来的误差。 烟田土壤微生物群落结构在烟株旺长期时已经发生了较大变化,发病期与旺长期微生物群落结构不同于移栽前。健康烟田土壤中微生物多样性较高,unclassified_f__Micrococcaceae、norank_o__JG30-KFAS9、假霉样真菌属(Pseudallescheria)、镰刀菌属(Fusarium)在健康与发病土壤之间存在显著差异。微生物群落结构在健康与发病土壤之间的差异可能是影响烟草青枯病发生的关键因子之一。因而采取措施提高土壤微生物多样性和物种丰富度对烟草青枯病的防控、提高土壤健康质量会有很大帮助。
2.4 微生物群落结构多样性分析

3 讨论
4 结论
