PM2.5通过自噬活化NLRP3炎症小体诱导16HBE细胞炎症反应①
2019-09-03王玉琳霍婷婷冯晨旭董发勤邓建军
王玉琳 霍婷婷 冯晨旭 张 旭 杨 洁 董发勤 邓建军
(西南医科大学临床医学院,泸州 646000)
PM2.5是雾霾的主要成分之一,因其粒径小,随呼吸进入体内后部分可沉积于肺泡,还可透过肺血液屏障随血液循环到达全身,对多个组织器官造成损伤[1,2]。呼吸系统流行病学调查表明,PM2.5可刺激巨噬细胞、支气管上皮细胞及肺泡上皮细胞释放大量的炎症因子,诱发或加重哮喘、支气管炎和肺纤维化等肺部疾病,甚至和肺部肿瘤的发生、发展关系密切[3,4]。NLRP3炎症小体是机体固有免疫的重要组成部分,病毒、寄生虫和细菌等病原体以及内质网应激、氧化应激等均可活化NLRP3炎症小体[5]。NLRP3炎症小体过度激活可通过依赖caspase-1的分子途径使IL-1β和IL-18大量释放,并激活复杂的下游信号通路,引发一连串炎症放大反应,在多种炎症相关性疾病中发挥极其重要的作用[6,7]。除了常见的病原体外,温石棉、二氧化硅等矿物粉尘也可活化NLRP3炎症小体,与肺纤维化的发生发展密切相关[8]。PM2.5是以矿物颗粒为主要成分的复杂大气污染物,是否可活化NLRP3炎症小体引起并促进机体炎症反应尚不明确。最新研究表明,细胞自噬对NLRP3炎症小体活化有一定的调控作用。自噬是机体重要的代谢过程,主要依靠清除老化的蛋白质和受损的细胞器等维持细胞自稳,参与细胞的多种应激反应如炎症反应,但自噬参与调控炎症反应的分子机制尚未阐明[9,10]。NLRP3炎症小体作为系列炎症反应的主要部分,自噬对NLRP3炎症小体活化机制的研究可能成为PM2.5导致的炎症性疾病防治的新靶点。因此,本研究以人支气管上皮细胞为研究对象,在体外探讨细胞自噬对PM2.5诱导的支气管炎症反应的潜在影响机制,对PM2.5相关性炎症疾病的预防和治疗提供一定的理论指导。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器 DMEM高糖培养基、胎牛血清(美国Hyclone公司);磷酸缓冲盐溶液(Phosphate buffer saline,PBS)、胰蛋白酶消化液、100 U/ml青霉素和100 μg/ml链霉素、噻唑蓝(Methylthiazolyldi-phenyl-tetrazolium bromide,MTT)、二甲基亚砜(碧云天生物技术有限公司);IL-1β、IL-18炎症因子检测试剂盒(武汉博士德生物科技有限公司);兔抗LC3、Beclin1、NLRP3、caspase-1和GAPDH抗体(美国Abcam公司);全蛋白抽提试剂盒、SDS-PAGE凝胶配制试剂盒、羊抗兔IgG-HRP(江苏凯基生物技术股份有限公司);Lipofectamine 2000 (美国Thermo Fisher Scientific );引物合成(上海杰李生物技术有限公司);Real time PCR Master Mix(SYBR Green)(日本 ToYoBo QPR-201)。倒置相差荧光显微镜(Axio Observer A1,德国Zeiss公司),紫外分光光度计(BioTek PowerWave XS2,美国BioTek公司),荧光定量PCR仪器(7500 Fast,ABI),Western 电泳仪(美国Bio-Rad,164-5051),Trans-Blot Turbo全能型蛋白转印系统(美国 Bio-Rad 170-4150)。
1.1.2 细胞培养及PM2.5粉尘染毒母液配置 人支气管上皮细胞(16HBE)购自上海子实生物科技有限公司,采用含10%胎牛血清、青霉素(100 U/ml)和链霉素(100 μg/ml)的DMEM高糖培养基,在恒定温度(37℃)和合适湿度的5%CO2孵箱中培养。0.25%胰酶消化细胞常规传代培养,选取对数生长期且状态良好的细胞用于后续实验。
PM2.5组分因地域的不同而差异巨大,本实验选取河北石家庄某地区PM2.5为研究对象。PM2.5样本由西南科技大学研究人员采集、洗脱后使用卧式行星球磨机(转速400 r/min)于乙醇中研磨8 h,再经烘干后所得。因此,本实验中所使用的PM2.5是自然环境中PM2.5的主要有形矿物成分,不包含少量负载的细菌、病毒和有机成分等。采用X射线衍射仪对样本的主要物相分析结果为:PM2.5样本中主要成分为石英,另含少量方解石和钠长石。利用高温高压蒸汽灭菌法制得无菌粉尘,使用无血清培养基配制成 1 000 μg/ml 的母液于-20℃保存备用,使用前经超声振荡30 min。
1.2 方法
1.2.1 MTT实验测定细胞存活率 将处于对数稳定增长期的16HBE细胞以每孔200 μl接种于96孔板中。待细胞密度约为80%时,把配制好的一系列浓度的PM2.5粉尘悬液(12.5、25、50、100、200、400 μg/ml)加入96孔板中,每孔200 μl。在共同孵育到特定时间点(12、24和48 h)时分别向各孔中加入MTT(5 mg/ml)试剂10 μl,继续避光孵育4 h。轻轻弃掉上清液,向孔板中加入二甲基亚砜200 μl/孔,避光、室温振荡待结晶全部溶解后用分光光度计(490 nm)测定吸光度值(A)。每个实验浓度设置6个平行孔。对照组:细胞无任何处理;PM2.5对照组:不接种细胞,只加入PM2.5粉尘悬液。根据吸光度值采用以下计算方式得出细胞相对存活率。细胞相对存活率(%)=[(A实验组-A PM2.5对照组)/A对照组]×100%。
1.2.2 ELISA法检测细胞炎症因子的表达 将浓度为1×105个/ml的细胞悬液以每孔2 ml接种于6孔板中,置于37℃,5%CO2培养箱中培养。实验分为阴性对照组(不加任何刺激物,conrtol组),PM2.5对照组(加目的浓度PM2.5粉尘悬液,PM2.5组),空白质粒对照组(只转染空白质粒而不加任何刺激物,NC组),ATG7干扰表达对照组(siATG7组)和实验组(目的浓度PM2.5粉尘悬液染毒siATG7细胞,PM2.5+siATG7)。待细胞密度为80%左右时弃上清,向PM2.5对照组和实验组孔板中加入100 μg/ml的PM2.5悬液2 ml培养24 h。染毒结束后收集细胞上清液,用ELISA法按照相应试剂盒操作说明书通过酶标仪测定各孔的吸光度值,参照标准曲线计算出上清液中IL-1β、IL-18的浓度。每个实验组设3个平行孔。
1.2.3 RT-PCR检测siRNA转染后ATG7表达 接种16HBE细胞于6孔板中,在恒温、饱和湿度培养箱内培养到细胞融合度为30%~60%。实验分组如下:阴性对照组,NC组和siATG7组。稀释ATG7 siRNA和Lipo2000:将250 μl不含血清的DMEM培养基分别加入到5 μl浓度为20 μmol/L siRNA贮存液和5 μl lipo2000中,分别混匀后室温放置5 min;将稀释的ATG7 siRNA和Lipo2000混匀后室温孵育20 min;把ATG7 siRNA-lipo2000 混合液加入到细胞密度约为30%~60%培养孔中,培养4~6 h后更换新鲜培养基继续培养72 h。弃上清,PBS漂洗3次后分别向每孔中加入100 μg/ml的PM2.5悬液2 ml,共同孵育24 h后收集细胞。按照试剂盒使用说明书,收集提取细胞总RNA,用ABI 7500 Fast荧光定量PCR仪检测ATG7的mRNA的表达。ATG7引物序列为:(上游引物5′-AGCGGCGGCAAGAA-ATAATG-3′;下游引物5′-AACCCAACATCCAAGG-CACT-3′)。PCR扩增结果用Ct值来表示,目的基因的相对表达率采用2-ΔΔCt方法计算。
1.2.4 Western blot检测蛋白水平 16HBE细胞于6孔板中贴壁长至70%时,向各个实验组加入2 ml浓度为50、100、200 μg/ml的PM2.5悬液,用于检测Beclin1、LC3-Ⅰ和LC3-Ⅱ的蛋白表达水平;向siATG7组和PM2.5+siATG7组加入2 ml浓度100 μg/ml 的PM2.5悬液,共同孵育24 h。消化、收集细胞,提取各实验组总蛋白,根据BCA法测定各组蛋白浓度。采用SDS-PAGE电泳分离蛋白,转膜后用脱脂奶粉封闭1.5 h,再分别在4℃的环境中孵育兔抗Beclin-1抗体(1∶500)、兔抗LC3抗体(1∶1 000)、兔抗NLRP3抗体(1∶500)、兔抗caspase-1(1∶1 000)抗体和兔抗GAPDH抗体(1∶1 000),孵育12 h,洗膜后和由辣根过氧化物酶标记的山羊抗兔IgG(1∶1 000)共同孵育2 h。采用化学发光法显色,并进行图像分析。
1.3 统计学处理 实验数据经EXCEL整理后使用SPSS27.0进行数据处理和分析。根据数据分布特点采用t检验、单因素方差分析或LSD检验进行组间、组内比较。P<0.05为差异有统计学意义。
2 结果
2.1 PM2.5对16HBE细胞存活率的影响 不同浓度PM2.5染毒16HBE细胞12、24和48 h后,实验结果如图1所示。与对照组(0 μg/ml)相比,细胞存活率随着PM2.5染毒浓度的增高和染毒时间的延长而降低;除12.5 μg/ml染毒16HBE细胞12 h时细胞存活率与对照组相比差异无统计学意义外(P> 0.05),其他浓度组细胞存活率差异均有统计学意义(P<0.05或P<0.01)。当PM2.5浓度为 400 μg/ml时,染毒12、24、48 h后存活率分别为(63.14±3.8)%,(52.83±2.1)%,(40.92±5.5)%。染毒24 h 时,PM2.5粉尘对16HBE细胞的半数抑制浓度为227.3 μg/ml。
2.2 PM2.5诱导16HBE细胞自噬相关蛋白的表达 PM2.5分别以50、100和200 μg/ml的浓度染毒16HBE细胞24 h后,自噬相关蛋白Beclin1、LC3-Ⅰ和LC3-Ⅱ的表达水平如图2所示。与对照组(0 μg/ml)相比,随着PM2.5染毒浓度的增加,Beclin1和LC3-Ⅱ蛋白表达水平逐渐升高,LC3-Ⅰ蛋白表达水平逐渐降低,差异有统计学意义(P<0.01)。当PM2.5浓度为200 μg/ml时, 三种蛋白表达水平与对照组相比差异最大,Beclin1和LC3-Ⅱ 蛋白表达水平分别增高3.4倍和5.375倍,LC3-Ⅰ 蛋白表达水平降低52.83%;当PM2.5浓度为50 μg/ml、100 μg/ml的实验组相比较,Beclin1、LC3-Ⅰ 和LC3-Ⅱ 的蛋白表达水平无显著变化,差异无统计学意义。

图1 不同浓度PM2.5染毒16HBE细胞不同时间后的细胞存活率Fig.1 Cell viability of 16HBE cells exposed to different concentrations of PM2.5 for different timesNote: *.P<0.05,**.P<0.01,compared with control group (0 μg/ml).
2.3 转染ATG7 siRNA后对染毒组16HBE细胞自噬水平的影响 ATG7 siRNA转染16HBE细胞24 h后,采用RT-PCR检测ATG mRNA的表达。结果显示,siATG7组ATG7的 mRNA相对表达水平显著低于NC组和阴性对照组(P<0.01),而NC组和阴性对照组相比无明显变化,表明siATG7能有效降低细胞ATG7的表达水平。siATG7细胞和正常无处理细胞分别与100 μg/ml PM2.5粉尘悬液共同孵育24 h后,PM2.5+siATG7实验组自噬相关蛋白Beclin1表达水平与PM2.5组相比降低44.64%,差异具有统计学意义(P<0.01),见图3。以上结果说明siATG7能够明显降低PM2.5诱导的细胞自噬水平。

图2 不同浓度PM2.5染毒16HBE细胞24 h后自噬相关蛋白的表达Fig.2 Expression of autophagy-related proteins after exposure to different concentrations of PM2.5 for 24 h in 16HBE cellsNote: *.P<0.05,**.P<0.01,compared with control group (0 μg/ml).
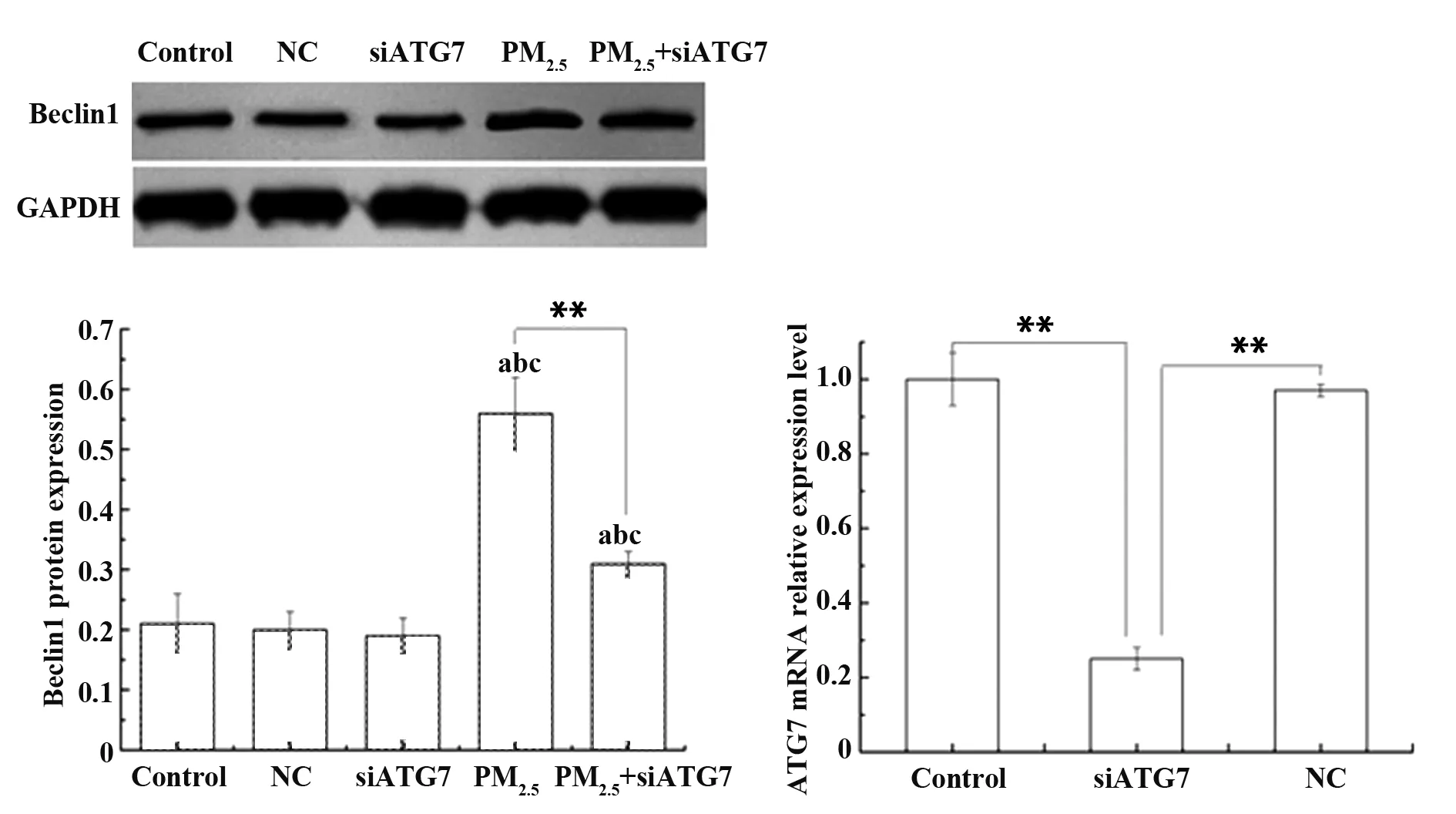
图3 siATG7降低PM2.5诱导16HBE细胞的自噬水平Fig.3 siATG7 reduced PM2.5-induced autophagy levels in 16HBE cellsNote: a.P<0.01,compared with control group;b.P<0.01,compared with NC group;c.P<0.01,compared with siATG7 group;**.P<0.01,PM2.5 group compared with PM2.5+siATG7 group.
2.4 抑制细胞自噬对PM2.5诱导16HBE细胞NLRP3和caspase-1蛋白表达的影响 100 μg/ml PM2.5粉尘悬液染毒16HBE细胞24 h后,NLRP3和caspase-1蛋白表达如图4所示。PM2.5组中NLRP3和caspase-1蛋白表达水平分别为0.27±0.01和0.39±0.05,与阴性对照组相比显著升高(P<0.01);而NC组和siATG7组的蛋白表达水平较阴性对照组无显著差异。表明PM2.5可活化NLRP3炎症小体,并激活了下游caspase-1蛋白。与PM2.5实验组相比,PM2.5+siATG7组NLRP3和caspase-1蛋白表达水平分别降低44.44%和51.28%,差异具有统计学意义(P<0.01)。以上实验显示,抑制PM2.5诱导的细胞自噬可降低NLRP3炎症小体活化的水平。

图4 抑制细胞自噬后对PM2.5诱导NLRP3和caspase-1蛋白表达的影响Fig.4 Effect of inhibition of autophagy on expression of NLRP3 and caspase-1 induced by PM2.5Note: a.P<0.01,compared with control group;b.P<0.01,compared with NC group;c.P<0.01,compared with siATG7 group;**.P<0.01,PM2.5 group compared with PM2.5+siATG7 group.

图5 抑制细胞自噬后对炎症因子IL-1β和IL-18表达的影响Fig.5 Effects of inhibition of autophagy on expression of inflammatory factors IL-1β and IL-18Note: a.P<0.01,compared with control group;b.P<0.01,compared with NC group;c.P<0.01,compared with siATG7 group;**.P<0.01,PM2.5 group compared with PM2.5+siATG7 group.
2.5 抑制细胞自噬对PM2.5诱导16HBE细胞炎症因子表达的影响 100 μg/ml PM2.5染毒16HBE细胞24 h后细胞上清液中炎症因子IL-1β和IL-18的含量如图5所示。与阴性对照组相比,PM2.5实验组中IL-1β和IL-18的含量分别增高166 pg/ml和453 pg/ml,siATG7组和NC组中的含量无明显变化。与PM2.5实验组相比,PM2.5+siATG7组的IL-1β和IL-18的分泌分别降低70 pg/ml和242 pg/ml,差异具有统计学意义(P<0.01)。因此降低PM2.5诱导的自噬可显著减少细胞上清液中IL-1β和IL-18的含量。
3 讨论
NLRP3炎症复合体是NLRP炎症小体家族的核心,不仅可识别病毒、寄生虫和细菌等外源性病原体,还可被内源性刺激物(如脂多糖、胆固醇结晶、尿酸结晶、 β-淀粉样蛋白和氧化低密度脂蛋白等)激活,招募并激活下游蛋白caspase-1,促进IL-1β和IL-18的成熟和释放[11-13]。研究报道,PM2.5暴露导致机体的炎症反应和免疫毒性是PM2.5重要的致病机制之一,炎症反应在疾病的进展中有着重要影响[8,14]。自噬对炎症具有调控功能,PM2.5诱导的细胞自噬对炎症反应的调控机制还有待进一步探索。
细胞自噬是一种依赖溶酶体的选择性降解方式,在真核细胞中普遍存在,可选择性降解受损的细胞器、蛋白质以及外来入侵物来维持细胞稳态。Beclin1和LC3等自噬相关蛋白在自噬发生的不同阶段扮演着重要角色。LC3是存在于自噬体膜上的特征性蛋白,具有LC3-Ⅰ和LC3-Ⅱ两种存在状态。当自噬体形成后,均匀分布在胞质中的LC3-Ⅰ经过一系列复杂过程转化成 LC3-Ⅱ;LC3-Ⅱ蛋白性质稳定并和自噬体膜结合紧密,因此LC3-Ⅱ蛋白表达水平的高低可用来反映自噬体的数量和自噬程度[15]。本实验中,不同浓度PM2.5染毒16HBE细胞后,随着PM2.5染毒浓度的增加,自噬相关蛋白Beclin1和LC3-Ⅱ蛋白表达水平逐渐升高,LC3-Ⅰ蛋白表达水平逐渐降低;Deng等研究发现,PM2.5暴露可导致LC3-Ⅱ、Atg5和Beclin1表达增加,且LC3-Ⅱ的表达量存在时间和浓度依赖性效应,从而诱导自噬发生[16]。此外,纳米石英粉尘、温石棉及大气颗粒物被证明均能诱导自噬的发生,这些研究结果与本实验的结果相一致。另有实验表明,PM2.5暴露可引起并加重气道炎症,并伴随细胞自噬水平的升高和中性粒细胞百分比的增加,而自噬水平与气道炎症严重程度密切相关,提示细胞自噬也可能参与调控PM2.5引起的炎症反应[17]。
支气管上皮细胞是覆盖于气管表面的主要细胞,不仅可作为生理屏障保护支气管,还可参与气道高反应性、气道炎症反应和气道重塑。本实验采用16HBE体外建立PM2.5暴露细胞模型,与对照组相比,细胞培养液中的IL-1β和IL-18的含量明显升高,且NLRP3和caspase-1蛋白表达水平增加。表明PM2.5激活了支气管上皮细胞中的NLRP3炎症小体,通过caspase-1途径促进了炎症因子IL-1β和IL-18的释放。仝国辉等[18]通过体内PM2.5单次染毒和3次染毒小鼠后发现,小鼠肺组织IL-1β的含量和NLRP3 mRNA的表达量明显升高。还有研究表明,PM2.5暴露的小鼠鼻灌洗液中Eotaxin、IL-5和嗜酸性粒细胞都升高,导致气道炎症反应[19]。
自噬是把双刃剑,在不同的感染及免疫性疾病中自噬所起的作用有所不同。研究证实,适度自噬可减轻炎症反应来促进细胞稳态恢复;过度自噬就会激活如丝裂原活化蛋白激酶(MAPK)、NLRP3炎症小体和核转录因子-κB(NF-κB)的等信号通路引发炎症损伤[20,21]。Nakahira等[22]研究表明,自噬缺陷小鼠血清IL-1β和IL-18水平显著增高,同时活性氧的水平和NLRP3蛋白表达水平增高。本实验中,通过siATG7降低自噬相关蛋白ATG7的表达,使自噬囊泡形成障碍,抑制PM2.5诱导的细胞自噬。降低细胞自噬水平能够显著抑制PM2.5诱导的16HBE细胞中NLRP3和caspase-1蛋白的表达,显著减少细胞上清液中IL-1β和IL-18的分泌量。提示细胞自噬可参与PM2.5介导的NLRP3炎症小体的活化而加重机体炎症反应。这可能是因为PM2.5使细胞发生过度的自噬反应,消耗过多的线粒体自噬转换蛋白P62。P62是细胞内维持线粒体自噬的必要蛋白,不足的P62会导致功能受损的线粒体无法通过自噬而及时清除,使活性氧过度积累诱导NLRP3炎症小体的活化,促进炎症因子的成熟和释放[23,24]。但具体活化机制还有待进一步研究。
综上所述,本实验研究结果表明,抑制细胞自噬可明显减轻PM2.5诱导的支气管上皮细胞的炎症反应。其机制可能是PM2.5使细胞发生自噬紊乱,过度的细胞自噬可参与活化NLRP3炎症小体,促进IL-1β和IL-18的分泌,导致机体炎症反应。
