Erbin在食管鳞状细胞癌中的表达及其与患者预后的关系*
2019-09-02王璐瑶于佳乐刘帅莹董彩凤白春英张俊毅
王璐瑶 于佳乐 刘帅莹 董彩凤 白春英 张俊毅
食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)在中国是一种常见的上消化道恶性肿瘤。根据GLOBOCAN 2018 估计[1],食管癌的发病率在全球癌症排名中位居第七位,而中国的食管癌发病和死亡人数约占全球的一半。在中国[2],男性中癌症发病率第三位的是食管癌。因此,中国食管癌的防控形势非常严重。
支架蛋白(scaffolding protein)Erbin 定位在细胞连接半桥粒处,属于LAP(the leucine-rich repeat and PDZ domain protein)家族成员之一。Erbin 最初被认为对神经轴突髓鞘的形成至关重要[3]。后来发现Erbin通过与δ-catenin[4]等多个黏附连接蛋白结合而对上皮细胞极性的维持[5]、信号转导和细胞黏附发挥重要作用[6]。然而,Erbin 在恶性肿瘤中扮演何种角色尚有争论。有研究报道,Erbin 蛋白在肝细胞肝癌[7]、乳腺癌[8]中表达增加,并且与肿瘤的组织学分化程度呈正相关。相反地,Erbin 也具有抑癌作用。Erbin通过抑制细胞周期进程而显著降低宫颈癌细胞的增殖[9]。
本研究利用组织芯片检测299例ESCC蜡块标本中Erbin 的表达情况,结果显示Erbin 的表达在ESCC组织中显著增高,并且与ESCC患者的不良预后密切相关,报道如下。
1 材料与方法
1.1 组织标本与患者资料
299例食管癌患者的标本、40例非典型增生的食管上皮组织(18例低级别和22例高级别)、47例癌旁正常食管上皮组织(距原发肿瘤边界5 cm以上)标本均收集自赤峰学院附属医院病理科和汕头市中心医院病理科2007年~2011年存档蜡块。所有病例术前均未接受放疗和化疗。男性233例,女性66例,中位年龄58 岁。按照美国癌症联合会(AJCC)于2017年修订的肿瘤TNM 分期标准[10]:Ⅰ期28 例,Ⅱ期137例,Ⅲ期134 例,Ⅳ期0 例;高分化45 例,中分化229例,低分化25例。另外,位于食管上段的肿瘤19例,中段134 例,下段146 例;有淋巴结转移的病例148例,没有转移的151例。所有病例均有详实的术后随访资料,其生存时间的计算是从手术日期到由于复发、转移而死亡的日期或到末次随访日期为止,且所有死亡患者的死因均与食管癌有关。患者最长随访时间为60 个月,平均随访时间为26.74 个月。此外,为了验证免疫组织化学的检测结果,本研究另收集了25例冷冻的食管癌及配对的癌旁正常食管组织用于提取RNA和蛋白。所有标本的使用均征得了伦理委员会同意且患者本人或家属知情。
1.2 方法
1.2.1 组织芯片的制备 组织芯片的制作参考本课题组已发表的文献[11]。
1.2.2 免疫组织化学染色 组织芯片被制成4μm连续切片;二甲苯脱蜡和梯度酒精水化后,切片再经柠檬酸盐缓冲液(pH 6.0)微波抗原修复;3%H2O2和非免疫血清分别灭活内源性过氧化物酶活性与非特异性结合位点,之后切片再与一抗Erbin或δ-catenin在4℃条件下孵育过夜。Erbin抗体(英国Abcam公司,山羊抗人多抗,且针对人源性Erbin的C端氨基酸设计该抗体的免疫原性)的使用滴度为1:100。δ-catenin抗体(英国Abcam公司,兔抗人多抗,且针对人源性δ-catenin的第1 150位氨基酸残基到C端设计该抗体的免疫原性)的使用滴度为1:100。第二天,切片经PBS冲洗后,滴加生物素标记的二抗(UltraSensitiveTMSP免疫组织化学试剂盒,福州迈新生物公司),DAB显色,苏木素复染。PBS代替一抗做阴性对照,以排除二抗的非特异性结合。
1.2.3 免疫组织化学结果的判读 细胞胞浆中出现棕色颗粒被认为是阳性信号。染色强度分为4级:0:阴性;1:弱染色;2:中度染色;3:强染色。阳性细胞百分数分为5级:0:absent;1:1%~25%;2:26%~50%;3:51%~75%;4:≥76%。对于阳性染色区域一致的标本,每个标本的总分数是由肿瘤细胞染色强度和肿瘤细胞阳性百分数两部分的乘积得出,范围是0~12。当切片上的阳性染色区域不一致时,每一区域单独评分并最后相加得出该标本的最终分数。例如,标本中75%的肿瘤细胞为中度染色(3×2=6),其余25%的肿瘤细胞为弱染色(1×1=1),那么该标本的最终分数为6+1=7。为了方便统计,本研究把所有病例分为2组:Erbin:0~1分为阴性表达组,2~12分为阳性表达组。δ-catenin的评分标准参照文献[11]。
1.2.4 PCR 检测 利用TRIzol 试剂(美国Invitrogen公司)提取食管癌组织中的总RNA,然后借助逆转录聚合酶链反应试剂盒(大连TaKaRa生物公司)得到互补DNA。Erbin 引物的设定来自参考文献[12]:5′-C ATCTCACCAAACGACCGAC-3′,5′-GAGCCCGCCTT GTAGAGCC-3′。β-actin 引物序列:5′-AGAGCTAC GAGCTGCCTGAC-3′和5′-AGTACTTGCGCTCAGG AGGA-3′。Erbin/β-actin的灰度比值作为Erbin基因的相对表达量。实验重复3次。
1.2.5 蛋白印迹检测 组织裂解物用来提取总蛋白。取等量总蛋白经10%SDS-PAGE 分离后转印至PVDF膜(美国Millipore公司)。随后PVDF膜与Erbin抗体(1:200;Abcam)在4℃条件下孵育过夜,再与HRP 标记的二抗(1:5 000;Santa Cruz)在室温下孵育2个小时,利用ECL化学发光并观察蛋白条带。利用FluorChem 8900图像分析系统(美国Alpha公司)进行图像采集和定量分析。目的蛋白与相应β-actin蛋白(1:1 000,美国Sigma公司)的比值作为该目的蛋白的相对表达水平。
1.3 统计学分析
应用SPSS 17.0 软件进行数据分析。Erbin 表达与患者临床病理因素的关系采用Pearson′s Chi-Square 检验。患者生存分析采用Kaplan-Meier 法,Log-Rank 检验患者生存率的差别。2 个蛋白表达的相关性采用Pearson 相关检验。Cox 多因素风险比例模型用作评估影响患者预后的独立危险因子。P<0.05为差异具有统计学意义。
2 结果
2.1 Erbin蛋白和mRNA在ESCC组织中的表达
47例癌旁正常食管上皮的免疫组织化学染色显示(图1),Erbin的阳性信号主要位于鳞状上皮的基底细胞,且定位在基底细胞的胞浆。在299 例ESCC 组织中(图1),Erbin 的表达也定位在肿瘤细胞的胞浆,但阳性细胞数和染色强度显著增加,其阳性表达率为55.2%(165/299),明显高于癌旁正常食管上皮的表达(0/47,P<0.001)。此外,也检测了40例非典型增生的食管上皮中Erbin的表达情况。低级别非典型增生病例的Erbin阳性表达率是0(0/18),而高级别非典型增生病例的Erbin 阳性表达率是31.8%(7/22)。高级别非典型增生病例的Erbin阳性表达率高于低级别增生(P<0.001),但低于ESCC组织的表达率(P<0.001)。
借助蛋白印迹和PCR 方法,在25 例配对的食管癌和癌旁正常食管组织中检测了Erbin蛋白和基因的表达情况(图1~3)。与正常食道上皮组织相比,ESCC 组织中Erbin 的蛋白和基因表达明显增高(P<0.05,图4)。
选取60例ESCC组织并借助免疫组织化学方法检测δ-catenin蛋白的表达情况(图5)。δ-catenin在ESCC组织中的阳性表达率为61.67%(37/60),且阳性信号位于肿瘤细胞的胞浆,显著高于正常食管上皮的表达(0/47,P<0.001)。Pearson相关分析显示δ-catenin和Erbin的表达具有显著正相关(r=0.626,P<0.001,表1)。

图1 Erbin在正常食管上皮和食管癌组织中的表达

▶图2 Erbin在正常食管上皮(N)和食管癌组织(T)中的基因(A)和蛋白(B)表达

▶图3 Erbin 在25 对正常食管上皮(N)和食管癌组织(T)中的蛋白表达

▶图4 Erbin 在25 对正常食管上皮(N)和食管癌组织(T)中的基因表达

图5 δ-catenin在正常食管上皮和食管癌组织中的表达
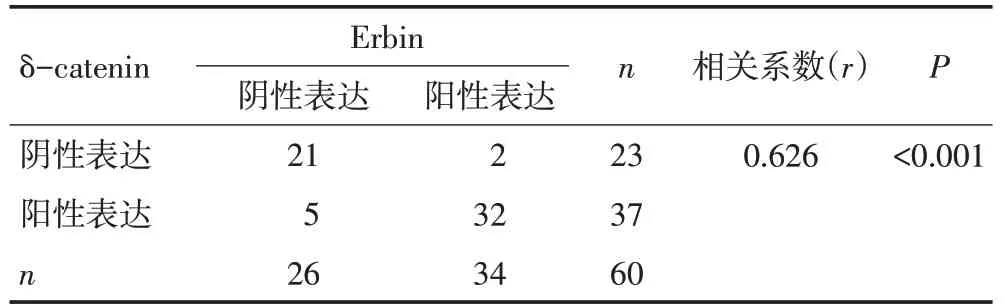
表1 Erbin与δ-catenin在ESCC中表达的相关性
2.2 Erbin在ESCC组织中的高表达与患者的TNM分期和淋巴结转移状态的关系
免疫组织化学结果显示Erbin 在ESCC 组织中的表达显著增高,其表达与患者临床病理因素的关系见表2。Erbin 在Ⅲ~Ⅳ期中的阳性表达率为64.9%(87/134),高 于Ⅰ~Ⅱ期 的47.3%(78/165,P=0.002)。淋巴结转移的病例中Erbin的阳性表达率为65.5%(97/148),高于无淋巴结转移病例的45.0%(68/151,P<0.001)。然而,Erbin的表达与患者的年龄、性别、肿瘤大小、肿瘤位置、肿瘤分化程度或肿瘤浸润深度均无显著差异(P>0.05)。
2.3 Erbin在ESCC组织中的阳性表达与患者的不良预后的关系
Kaplan-Meier 生存分析表明(图4),134 例Erbin阴性表达患者的平均生存时间为(39.486±1.960)个月(95%CI=35.644~43.328),而165 例Erbin 阳性表达患者的平均生存时间为(33.544±1.793)个月(95%CI=30.030~37.058),Erbin阳性表达患者的生存时间显著短于阴性表达的患者(Log-Rank 检验χ2=4.633,P=0.031)。
Cox多因素风险模型显示(表3),Erbin的阳性表达不是ESCC患者预后的独立危险因素(Risk=1.215,95%CI=0.867~1.705,P=0.258)。然而,淋巴结转移状态(Risk=2.032,95%CI=1.461~2.826,P<0.001)、TNM 分 期(Risk=2.050,95% CI=1.481~2.836,P<0.001)和肿瘤组织的分化程度(Risk=0.532,95%CI=0.322~0.878,P=0.014)均是判断ESCC 患者预后的独立危险因素,而肿瘤大小、肿瘤位置、肿瘤浸润深度和性别均不是独立的危险因素(P=0.530,0.446,0.605,0.236)。值得注意的是,年龄也具有独立的预测ESCC 患者预后的能力(Risk=1.422,95%CI=1.030~1.962,P=0.032)。
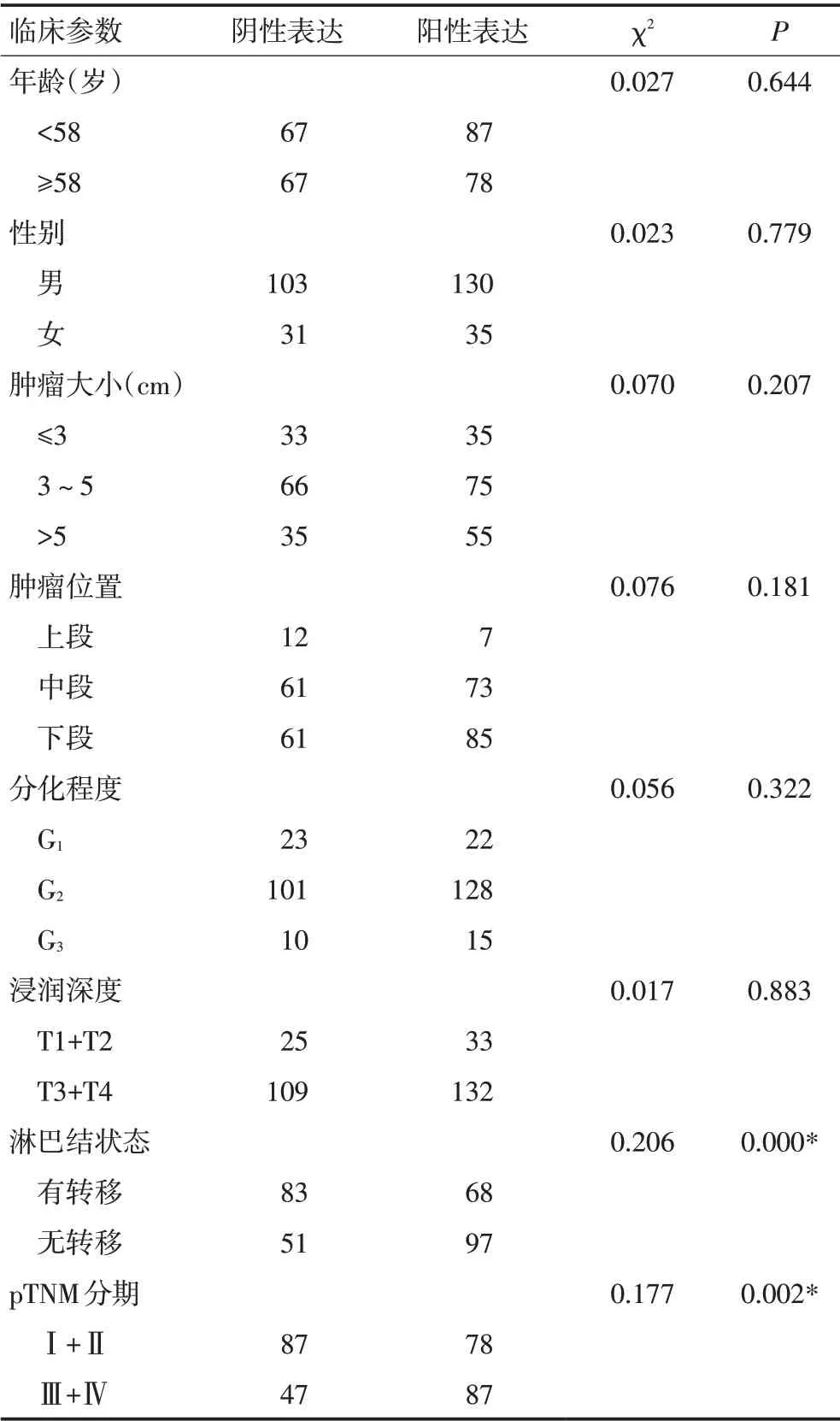
表2 ESCC中Erbin的表达与各临床病理参数之间的关系
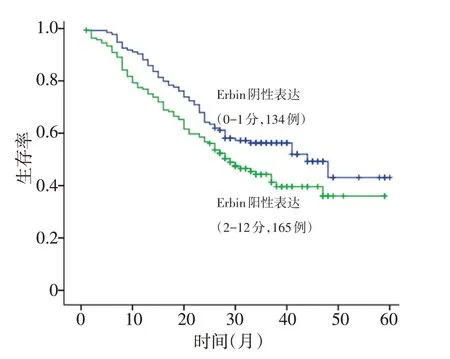
图4 299例ESCC患者根据Erbin表达状态分类的Kaplan-Meier生存分析
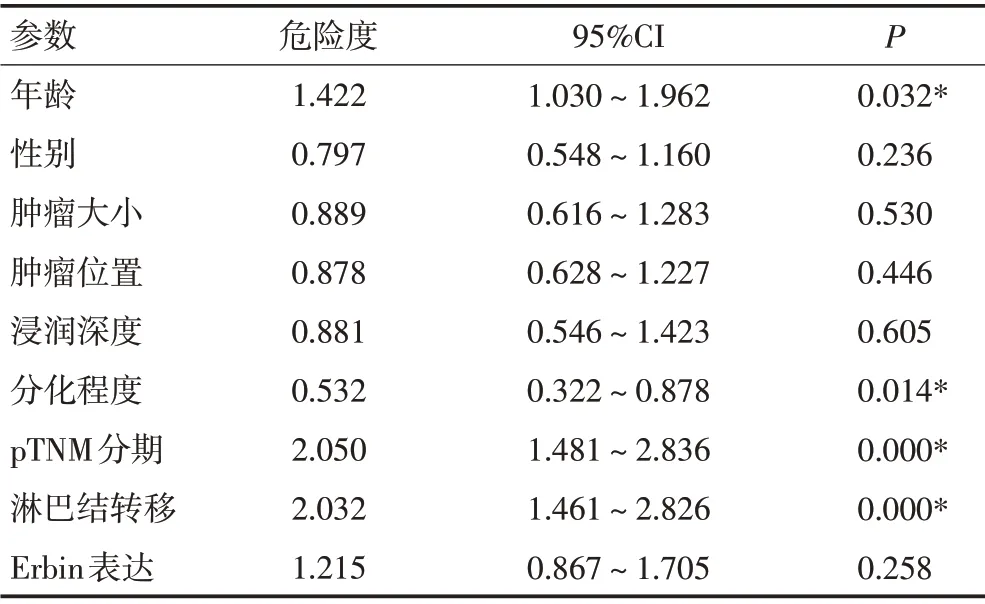
表3 多变量Cox 回归对299 例ESCC 患者的临床病理参数的危险度预测分析
3 讨论
有文献报道Erbin在皮肤表皮的基底细胞层为胞浆弥漫染色,在表皮上部的细胞为胞膜染色,而在皮肤鳞癌组织中Erbin 的表达显著增加,且既有胞浆表达,也有胞膜表达[13]。与皮肤中的表达模式不同,本研究显示Erbin蛋白在正常食管鳞状上皮细胞中呈微弱的胞浆表达,且阳性表达率为0(0/47),而在ESCC组织中表达显著增加,其阳性表达率为55.2%(165/299)。本研究也发现食管鳞状上皮高级别异型增生病例的Erbin阳性表达率高于低级别异型增生和正常鳞状上皮的表达(P<0.001),但低于鳞状细胞癌的表达(P<0.001),说明Erbin的表达促进了肿瘤的侵袭进展。此外,Erbin 的表达与食管癌pTNM 分期(P=0.002)和淋巴结转移状态(P<0.001)呈正相关,说明Erbin 不但促进食管癌患者的临床进展,而且也参与了肿瘤的淋巴结转移。另外,与癌旁正常食管组织相比,本研究显示Erbin蛋白和基因表达水平在ESCC组织中均明显增高,这与免疫组织化学中的结果相一致,证明Erbin 蛋白表达增多主要是由于其基因转录增加所导致的,与在肝细胞肝癌[7]、乳腺癌[8]、结直肠癌组织[14]中的研究结果一致,而且其表达与肿瘤TNM 分期呈正相关,这与本研究在食管癌中得到的结果是一致的。上述研究结果均说明Erbin在恶性肿瘤的演进中可能扮演重要的促癌角色。然而,是在结直肠癌组织中进行研究,另一篇报道显示Erbin 的mRNA 和蛋白表达均明显减少[15],并且Erbin 通过抑制ERK 和Akt 信号通路的活性而发挥抑癌作用。在同样的肿瘤中Erbin的表达模式完全相反的情况需要进一步验证。此外,本研究显示Erbin 阳性表达的ESCC患者的生存时间明显短于阴性表达的患者(P=0.031),提示Erbin 在食管癌的进展中扮演了促癌角色。然而,多因素风险模型显示Erbin 的表达并不是判断食管癌患者预后的一个独立危险因素(P=0.258),而肿瘤的分化程度、pTNM 分期、淋巴结转移均是ESCC患者独立的预后因素。值得注意的是,年龄也是食管癌患者预后的一个独立因素(P=0.032),推测可能随着年龄的增加食管鳞状上皮发生非典型增生的几率增高,进而发展到鳞状细胞癌的发生概率也明显高于年龄较低的人群。
同样是在乳腺癌组织中进行的研究,有报道称Erbin的mRNA和蛋白表达均显著减少[12],并且Erbin通过抑制Akt信号通路的活性而抑制肿瘤的转移,该结果显示Erbin 具有抑癌蛋白的作用,这与上文在乳腺癌中的研究结果正好相反[8]。推测Erbin在相同的肿瘤中出现相反的表达可能与实验标本数量有关。前者用做免疫组织化学实验的乳腺癌组织标本仅为20 例,而后者用作免疫组织化学实验的乳腺癌标本多达171 例,因此需要进一步扩大样本量去验证Erbin在乳腺癌组织中的确切表达情况。本研究选取了较大样本的ESCC 组织进行检测,得出Erbin 在肿瘤组织中表达增加的结论进一步明确了其作为促癌蛋白在参与食管癌侵袭进展过程中扮演的重要角色。当然,Erbin 可能在不同的肿瘤甚至相同的肿瘤中扮演截然相反的角色,但这不排除可能与肿瘤细胞的类型以及Erbin 在肿瘤细胞中的定位有关,特别是Erbin在细胞膜或细胞质的定位与其在肿瘤演进中扮演的“双重身份”可能密切相关,需要深入研究。
Erbin 与δ-catenin 同属黏附连接蛋白,且两者可以直接结合而参与上皮细胞的连接和上皮极性的维持。既往研究已经阐释了δ-catenin的mRNA和蛋白表达水平在食管癌[11]、肺癌[16]组织中显著增加,而且δ-catenin 的阳性表达与患者的不良预后密切相关。因此在本研究中,Erbin 与δ-catenin 在肿瘤演进过程中所扮演的促癌角色是一致的,且两者在ESCC组织中的表达显著正相关(r=0.626,P<0.001),说明两个蛋白具备功能上的结合效应。众所周知,基质金属蛋白酶(MMPs)可以通过降解细胞外基质而在肿瘤细胞的侵袭转移中发挥重要作用,在食管癌中Erbin是否通过增强MMPs的活性而促进肿瘤细胞的侵袭,需要借助食管癌细胞系开展深入研究。
综上所述,本研究揭示了Erbin的表达在ESCC组织中明显增加,且Erbin的阳性表达与食管癌患者的不良预后密切相关,这对将来开发针对Erbin的肿瘤靶向药物奠定了实验基础,而明确Erbin促进食管癌细胞侵袭转移的机制是本课题组下一步的研究方向。
