神经介素U对新生大鼠坏死性小肠结肠炎的影响
2019-09-02
(浙江大学动物科学学院,浙江 杭州 310058)
坏死性小肠结肠炎(NEC)是早产儿最常见的一种疾病,常在没有任何预兆的情况下出现,并且迅速演变为肠道坏死,严重者直接导致死亡。自60多年前,现代新生儿重症监护开始以来,NEC已被广泛认可[1]。但至今NEC的发病机制还没完全明了,这严重限制了NEC的预防和治疗。
神经介素 U 是从猪脊髓分离的一种神经肽,由于它在体外可使大鼠的子宫肌收缩,因此加后缀 U(英语子宫 uterus 的首字母) 命名为 NMU。随着深入研究,NMU 主要分布于胃肠道、泌尿生殖系统和中枢神经系统。在胃肠道中,黏膜和肠肌层的神经细胞体和纤维中存在NMU-LIR[2]。但神经介素U的其他功能,是否抑制细胞凋亡、能否通过抑制细胞凋亡和促进细胞分裂来治疗或缓解NEC至今尚未见报道。本研究将从NMU促进肠粘膜细胞分裂增殖和抑制细胞凋亡等方面进行探索。
1 材料与方法
1.1材料 新生SD大鼠由上海斯莱克有限公司提供[SCXK(沪)2017-0005]。NMU、TUNEL试剂盒、PCNA、免疫组化试剂和配方奶分别由Peprotech、碧云天公司、PCNA、中杉金桥和Petag公司提供。
1.2方法
1.2.1动物实验 30只新生大鼠,性别不限,平均体重6 g,随机分为3组,每组10只,分别为正常对照组(A)、NEC模型组(B)和NMU治疗组(C)。A组小鼠采用母鼠正常喂养,B组和C组小鼠采用人工配方奶粉喂养、低高氧暴露和冷刺激方法,即新生大鼠在100% CO2高氧舱环境中保持10 min,4 ℃环境中5 min,然后保持97% O2环境中5 min,每天早晚两次,连续3 d。第4 d开始,B组注射等量的生理盐水,C组腹腔注射NMU(1 mg/kg·d),每天一次,连续3 d。第 7 d对所有大鼠实施安乐死后,取胃肠道组织行组织病理学检测。
1.2.2肠道组织病理学检查 将肠道组织样品用 4%多聚甲醛固定24 h,再进行常规石蜡包埋切片和HE染色。肠道组织病理结果采用新标准双盲法计分[3]:无组织学损害为0分;轻度粘膜下层和固有层分离为1分;粘膜下层和固有层中度分离,粘膜下层及肌层水肿为2分;粘膜下层和固有层严重分离,严重水肿,局部绒毛脱落为3分;绒毛全部丢失或坏死为4分。分数≥2被定义为NEC。
1.2.3免疫组织化学法 免疫组织化学法检测大鼠肠道上皮组织中增殖细胞核抗原(Proliferating Cell Nuclear Antigen, PCNA)的表达变化,具体而言,先进行常规石蜡包埋切片并脱蜡至水,用3%双氧水灭活内源性酶10 min,用pH 9.0的EDTA微波炉中高火20 min修复抗原,经5% BSA室温封闭20 min后,一抗4℃孵育过夜,PBS洗涤后加二抗于37℃孵育20 min,再经DAB显色及苏木素复染,酒精脱水,用中性树脂胶封片并镜检。
1.2.4细胞凋亡检测 按常规方法进行石蜡的包埋切片并脱蜡至水,利用原位末端标记(TUNEL)法检测肠道上皮细胞的凋亡情况,具体按照试剂盒说明书上步骤进行操作,最后用抗荧光淬灭剂封片液封片并镜检。
1.2.5图像分析 随机抽取 5 张免疫组化结果图,并用IPP 6.0进行半定量分析,统计PCNA阳性率;细胞凋亡统计方法为每个切片随机选取5个视野计数每200个细胞中凋亡细胞数,计算细胞凋亡率。

2 结果
2.1生长发育情况 A组大鼠无异常,生长发育良好。B组大鼠在NEC造模3 d后精神萎靡,并出现明显的腹泻症状,体重显著下降。C组大鼠活动量减少,体重略有下降,腹泻症状比B组轻。
2.2肠道组织病理学比较 三组大鼠肠道组织HE染色结果,如图1所示。A组:组织结构清晰正常,上皮完整连续,绒毛无水肿,黏膜层、黏膜下层及固有层无充血水肿及断裂分离;B组:肠组织坏死严重,绒毛变性水肿,排列不规则,肌层变薄甚至断裂,固有层与黏膜下层重度水肿。C组肠组织出现部分坏死,部分绒毛变性水肿,黏膜下和固有层水肿也较轻。三组大鼠双盲法病理评分及组间比较结果显示(表1): NEC模型组较正常对照组肠道损伤显著加重 (P<0.01),治疗组肠道损伤较模型组显著减轻 (P<0.01)。

图1 大鼠肠道组织HE染色光镜观察(HE,×200)
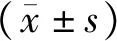
表1 大鼠病理学比较
注:B和C与A比较,aP<0.01,C与B比较,bP<0.01
2.3PCNA 在肠上皮细胞的表达变化 如图2所示,PCNA蛋白主要在细胞核内表达,A组肠上皮和肠绒毛细胞核中表达强阳性,B组肠上皮有表达,肠绒毛中表达较低,呈弱阳性,C组较B组明显肠上皮和肠绒毛表达增强,呈阳性,表达强度较对照组略低。半定量分析结果差异有统计学意义(表2)。
2.4肠黏膜上皮细胞凋亡 原位末端标记的检测结果,如图3所示,TUNEL阳性的细胞核呈红色, 主要分布在肠绒毛的顶部和肠黏膜上皮。计数结果显示,B组小肠黏膜上皮细胞TUNEL阳性的细胞数明显多于A组(P<0.01);C组小肠黏膜上皮细胞TUNEL阳性的细胞数少于B组(P<0.01)(表2)。
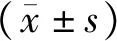
表2 肠黏膜 PCNA表达和肠黏膜凋亡
注:B和C与A比较,aP<0.01,C与B比较,bP<0.01

图2 PCNA 在肠上皮细胞的表达变化(SP,×200)
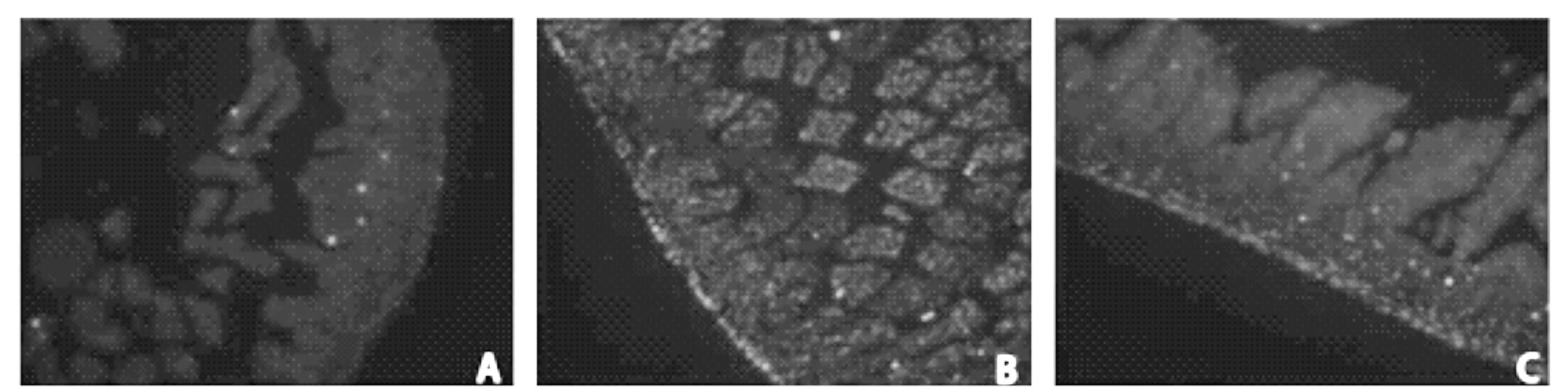
图3 新生大鼠肠道上皮细胞凋亡变化(TUNEL,×200)
3 讨论
NEC是一种十分严重的新生儿肠道炎性疾病,发病儿童中估计有20%~40%需要手术治疗,其中死亡率高达45%[4]。目前NEC的预防和治疗都没有明确的方法。然而肠道功能的维护主要是通过肠黏膜的快速更新来完成的,而细胞增殖是维护肠黏膜的结构与功能的重要机制之一[5]。 PCNA 在细胞DNA复制、细胞增殖及细胞调控中发挥着重要作用[6]。在小肠缺血再灌注损伤时,PCNA 的表达变化与肠道上皮细胞增殖分化相一致,肠道上皮PCNA的表达先降后升,可能与损伤后的肠粘模自身修复相关[7]。NMU的功能主要是刺激平滑肌收缩,影响胃肠功能,调节摄食和能量平衡,然而,NMU是否能通过促进细胞增殖和抑制细胞凋亡来缓解或治疗NEC尚未见报道。
本研究发现:与正常新生大鼠肠上皮中PCNA表达强阳性相比,NEC模型组PCNA阳性细胞率大幅降低,说明上皮组织的细胞增殖受到显著抑制,而NMU治疗后细胞增殖功能得到明显增强,表明NMU对肠粘膜发挥较好的保护作用。
同时,正常新生大鼠肠道上皮细胞凋亡率极低,NEC模型组凋亡率显著升高,而NMU治疗后上皮细胞凋亡率得到了降低,表明NMU能很好的抑制肠道上皮细胞的凋亡。总之,NEC时肠道细胞凋亡增加,应用NMU治疗后能减轻肠道凋亡,促进肠道增殖。
