白酒酿造酒醅与周边土壤中酵母菌多样性及东方伊萨酵母发酵特性比较
2019-08-30杨团元刘蒲临赵永威缪礼鸿廖卫芳
彭 俊,杨团元,刘蒲临,赵永威,缪礼鸿*,廖卫芳
(1.武汉轻工大学 生物与制药工程学院,湖北 武汉 430023;2.湖北白云边酒业股份有限公司,湖北 松滋 434200)
传统白酒及葡萄酒发酵与自然环境中微生物息息相关,特别是传统白酒在开放式环境中制曲、下曲堆积、发酵,环境中微生物很容易落入其中并参与白酒的发酵。有研究表明,传统大曲酒发酵微生物中酵母菌主要来源于大曲,环境对白酒酿造真菌来源的贡献达20%~39%[1-3]。而在开放式的制曲环境下,包括酵母菌在内的大曲中的微生物最终也有相当一部分来源于其周围环境。白酒厂长期开放式或半开放式的自然发酵(包括制曲、高温堆积及入池发酵)过程也必然受当地土著微生物的影响。土壤是各种微生物的天然栖息地,其中蕴藏着丰富的微生物资源,一般土壤中真菌数量约3×104~17×104CFU/g,其中包含霉菌、酿酒酵母(Saccharomyces cerevisiae)和大量的非酿酒酵母:孢汉逊酵母属(Hanseniaspora)、毕赤酵母属(Pichia)、假丝酵母属(Candida)、德巴利酵母属(Debaryomyces)和伊萨酵母属(Issatchenkia)等,并且酵母的类群和产区地理特征有很大的关系[4-6]。东方伊萨酵母(I.orientalis)是一种在酒醅和酒曲[7]、土壤[8]、葡萄表皮[9]、传统奶酪[10]、发酵乳制品[11]、传统面食发酵剂[12]等环境中广泛存在的非酿酒酵母,其不仅具有较好的耐热能力和耐酒精能力,而且高产乙醇和酯类物质[13-15],并对白酒的香气形成具有重要作用[16-17]。有研究表明[18-19],I.orientalis与柠檬形克勒克酵母(Klockeraapiculata)混合发酵柿子酒效果均优于纯种发酵,且也在降解柠檬酸上很有潜力。不同酵母菌株之间的发酵特性往往具有一定的差异,考察是否适合于酿酒的酵母菌的发酵特性一般包括菌株的耐温能力、耐酸能力、耐乙醇能力、产乙醇能力及不同条件下生长速率等[20-22]。
本研究采用传统平板分离法分析白酒厂酒醅及其周边土壤中酵母菌的多样性差异,并对分离自土壤和酒醅的I.orientalis的耐受性及主要发酵产物(乙醇、乙酸乙酯)含量进行比较分析。旨在揭示白酒酿造过程中参入的微生物与其周边土壤环境中土著微生物之间的关联性,并为白酒酿造中酵母菌的来源及I.orientalis优良菌株的选育提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品及菌株
土壤样品:采自湖北白云边酒厂方圆约10 km的农作物旱地、维护较好的生态林以及果蔬园,刨开表层的腐质层,按照对角线法取5个土样,每个土样取表层土壤100 g(0~10 cm),5个土样等量混合,混合后采用四分法获得一份土壤[23],放入无菌袋于4℃冰箱保存备用,土壤采集地点和土壤份数详见表1,土壤pH值在5.5~6.7。

表1 土壤采样信息Table 1 Information of soilsamples
酒醅样品:采自白云边酒厂传统大曲酿酒车间的出入池酒醅,入池酒醅取表层和深20 cm之间酒醅的3个点各100 g,无菌袋混匀4℃冰箱保存备用;出池酒醅分上、中、下层取样,每层选取同一水平位置5个点各100 g,酒醅pH值为3.2~4.5。
编号为SN1-1、SN1-3、SN4-3、SN2-3、SN3-1、SN3-2、TC2-2、SN8-1、SN6-1、SN2-1、SN6-2、SN1-4、SN7-2、SN2-2、SN5-1、SN7-1的I.orientalis为本实验室从来自湖北、云南及广东的土壤中筛选并保藏的菌株[24]。
1.1.2 化学试剂
Taq脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)、DL2000Marker:宝生物工程(大连)有限公司;聚合酶链式反应(polymerase chain reaction,PCR)引物和基因组DNA抽提试剂盒:生工生物工程(上海)股份有限公司;酵母膏、蛋白胨(均为生化试剂):安琪酵母有限公司;葡萄糖、无水乙醇、醋酸(均为分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose medium,YPD)培养基:葡萄糖20 g/L,酵母膏10g/L,蛋白胨20 g/L,蒸馏水1 000m L;YPD固体培养基添加2%琼脂粉;4%乙醇YPD培养基添加体积分数4%的乙醇。上述培养基115℃灭菌25min。
豆芽汁蔗糖培养基[25]:黄豆芽200 g/L、蔗糖30 g/L、水1 000m L,115℃灭菌25min。
马丁孟加拉红-链霉素培养基[25]:葡萄糖10 g/L、蛋白胨5g/L、KH2PO41g/L、MgSO4·7H2O 0.5g/L、孟加拉红33.4mg/L、链霉素30μg/m L,121℃灭菌20m in。
高粱糖化液发酵培养基:高粱经粉碎,糊化,液化,糖化,离心收集上清液,121℃灭菌20min。
1.2 仪器与设备
ZXDP-A2160恒温培养箱:上海智诚科技有限公司;ECLIPSE 80i显微镜:日本Nikon公司;TGradient聚合酶链式反应仪:德国Biometra公司;ZHWY-2102摇床:上海智城分析仪器制造有限公司;SYDR/1305凝胶成像仪:美国Syngene公司;7890A气相色谱仪:美国安捷伦公司;UV-5900PC紫外可见分光光度计:上海元析仪器有限公司。
1.3 方法
1.3.1 酵母菌株的分离
酵母菌株分离方法:称取样品(土壤或酒醅)10 g,分别加入到90m LYPD培养基、4%乙醇YPD培养基和豆芽汁蔗糖培养基中,30℃、170 r/min摇床富集培养28 h。样品梯度稀释(10-1、10-2、10-3),涂布孟加拉红培养基上,30 ℃静置培养1~2 d后挑取形态不同的单菌落,多次在YPD平板上划线纯化,获得纯培养的菌株。
1.3.2 酵母菌的分子生物学鉴定
(1)DNA的提取
取纯化后的菌株,挑取单菌落接种于YPD培养基中,30℃、170 r/m in培养24 h,用Ezup柱式酵母基因组DNA抽提试剂盒提取DNA,完成后置于-20℃冰箱中保存备用。
(2)26S rDNA PCR扩增及测序
PCR扩增26S rDNA,酵母26S rDNA正向引物N L 1:5'-GCATATCAATAAGCGGAGGAAAAG-3';反向引物N L 4:5'-GGTCCGTGTTTCAAGACGG-3'。
PCR扩增体系:25μL Taq DNA聚合酶、22μL三蒸水、1μL正向引物、1μL反向引物、1μL酵母DNA模板。
PCR扩增程序:94℃预变性5min;94℃变性30 s,54℃退火30 s,72℃延伸60 s,循环33次;72℃再延伸10min。PCR产物经检测后,送至武汉天一辉远生物科技有限公司测序。
(3)测序结果分析及菌种鉴定
测序结果采DNAStar软件人工校对,校正序列在美国国家生物技术信息中心(national center for biotechnology information,NCBI)核酸序列数据库中进行同源序列搜索,比较测试菌株和已知酵母菌株之间的亲缘关系及其系统地位。根据同源序列搜索结果,取与实验菌株亲缘关系最近的模式菌株的26S rDNA D1/D2区序列,用ClustalX校准排齐序列,采用MEGA 5.2软件中的邻接(neighbor-joining,NJ)法,1 000次Bootstrap检验构建系统发育树[26-27]。
1.3.3 两种来源优势酵母菌耐酸、耐乙醇能力测定方法
种子液的制备:挑取单菌菌落接种于装液量为40m L/100m L的YPD培养基(培养基pH自然),30℃、170 r/min摇床培养24 h,得一级种子液。按1%(V/V)接种于装液量为40m L/100m L YPD液体培养基中,30℃、170 r/min摇床培养12 h,得到二级种子液。
耐酸、耐乙醇能力测定:按1%(V/V)接种到不同pH值(采用醋酸和乳酸1∶1(V/V)混合,调pH值分别至3.0、3.5、4.0、4.5、5.0、5.5)和不同乙醇体积分数(0、3%、6%、9%、12%)装液量为40m L/100m LYPD液体培养基,30℃、170 r/m in摇床培养24 h,采用紫外分光光度计测定菌液OD600nm值。对照组(CK)为接种后混匀,测定菌液的OD600nm值,下同。
1.3.4 东方伊萨酵母发酵特性
(1)耐酸能力
按1%(V/V)接种到不同pH值(采用醋酸和乳酸1∶1(V/V)混合,调pH值分别至3.0、3.5、4.0、4.5、5.0、6.5)装液量为40m L/100m LYPD液体培养基,30℃、170 r/min条件下摇床培养24 h,采用紫外分光光度计测菌液OD600nm值。
(2)耐高温能力
按1%(V/V)接种到装液量为40m L/100m LYPD液体培养基(培养基pH自然),在30℃、37℃、42℃、47℃、50℃条件下,170 r/m in摇床培养24 h,采用紫外分光光度计测菌液OD600nm值。
(3)高温下耐乙醇能力
按1%(V/V)分别接种到体积分数分别为0、2%、4%、6%、8%乙醇YPD液体培养基(培养基pH自然),在42℃、170 r/min摇床培养24 h,采用紫外分光光度计测菌液OD600nm值。
(4)发酵产物的测定
种子液按2%(V/V)接种到200mL高粱糖化液发酵培养基,接种后30℃、170 r/min培养6 h,密封,28℃静置发酵7 d。发酵结束后,蒸馏,气相色谱检测发酵产物(乙醇、乙酸乙酯和正丙醇含量),其检测条件为:分流比为20∶1,H2流速为30m L/min,空气流速为400m L/min,N2流速为25m L/min,柱温60℃,维持5min,再以10℃/min升温至160℃,维持5min。检测器温度200℃,进样口温度220℃,总运行时间20m in。每株酵母菌做3个重复。
1.3.5 数据处理
采用SPSS 22.0软件分析两来源的I.orientails发酵产物乙醇和乙酸乙酯含量数据进行统计学显著性差异分析。P值<0.05则认为两组数据有显著性差异,反之没有显著性差异。
2 结果与分析
2.1 酵母菌筛选及鉴定
基于酵母26S rDNA D1/D2区序列,分别构建土壤来源与酒醅来源的酵母菌株系统进化树,结果分别见图1和图2。

图1 土壤来源酵母菌26S rDNA D1/D2区域序列的系统发育树Fig.1 Phylogenetic tree of yeasts isolated from soilbased on 26S rDNA D1/D2 region sequences
由图1可知,来源土壤的酵母23个种分为2个主分支,第一个分支含15个种,主要有热带假丝酵母(C.tropicalis)、麦芽糖假丝酵母(C.maltosa)、季也蒙毕赤酵母(M.caribbica)、P.kudriavzevii、S.podzolica、毕赤克鲁维酵母(P.kluyveri)等。其中C.tropicalis和C.maltosa的亲缘关系比较接近,P.kudriavzevii和P.kluyveri亲缘关系比较接近,C.intermedia和C.pseudointemedia亲缘关系比较接近;第二个分支含8个种,主要有T.scarabaeorum、P.membranifaciens、V.pseudolonga等。
由图2可知,来源酒醅的酵母7个种分为2个主分支,第一个分支含2个种,盔形毕赤酵母(P.manshurica)和P.kudri-avzevii;第二个分支含5个种,分别是Z.bailii、S.cerevisiae、K.hum ilis、Z.bisporus、S.etchellsii,其中S.cerevisiae和K.humilis亲缘关系比较接近,Z.bisporus和Z.bailii亲缘关系比较接近。

图2 酒醅来源酵母菌26S rDNA D1/D2区域序列的系统发育树Fig.2 Phylogenetic tree of yeasts isolated from fermented grains based on 26S rDNA D1/D2 region sequences
由图1和图2可知,土壤中菌株进化关系较酒醅中菌株复杂,也表明土壤中酵母种群较酒醅更丰富。其原因可能与这2种环境的选择压差异有关,酒醅中含一定浓度的乙醇和有机酸等物质且还会经过高温堆积,所以酒醅具有一定的选择性压力,这种选择压形成一种过滤筛,筛除掉对高温、富含酸和乙醇环境敏感的菌株,而供试的土壤则不具备。
2.2 白酒厂酒醅及其周边土壤中酵母菌的地理分布
从土壤中共分离获得60株酵母菌,9个属23个种,结果见表2。由表2可知,从土壤中共分离获得60株酵母菌,分别是假丝酵母属(Candida)、毕赤酵母属(Pichia)、隐球酵母属(Cryptococcus)、酿酒酵母属(Saccharomyces)、圆孢酵母属(Torulaspora)、丝孢酵母属(Trichosporon)、掷孢酵母属(Sporobolomyces)、汉逊酵母属(Hanseniaspora)和Tetrapisispora。其中,占比较高的有热带假丝酵母(C.tropicalis)共23株(占38.3%),I.orientalis共6株(10%),占比较低的包含酿酒酵母(Saccharomycescerevisiae)共2株(3.3%),麦芽糖假丝酵母(Candidamaltosa)共2株(3.3%)等。由表2可知,C.tropicalis的分布最广,6份不同土样中均可以筛选到C.tropicalis,而且数量占据绝对优势,这与王辰等[28]对海南热带雨林腐木上酵母菌物种多样性研究结果相一致。从望月村葡萄园和白云边生态园生态林分别筛选到9个和7个不同酵母种,比其他土壤要丰富,这可能因为葡萄种植丰富了土壤的种群结构,而且葡萄含糖高表皮的酵母菌本就丰富[29-30]。所获得6株I.orientalis菌株分别编号为SWYPT-P-68、BYB-10、SWYPT-P-65、BYB-24、SWYPT-P-64、BLCL-P-100。

表2 酒厂周边土壤中酵母菌地理分布Table 2 Geographicaldistribution of yeasts in soilaround distillery
从酒醅中分离获得60株酵母菌,分属5个属7个种,结果见表3。由表3可知,从酒醅中分离获得60株酵母菌分别是毕赤酵母属(Pichia)、酿酒酵母属(Saccharomyces)、假丝酵母属(Kazachstania)、结合酵母属(Zygosaccharomyces)、伊萨酵母属(Pichia/Issatchenkia)和Schwanniomyces。其中,盔型毕赤酵母(P.manshurica)26株(43.3%),I.orientalis11株(18.3%),拜耳结合酵母12株(20.0%),S.cerevisiae 7株(11.7%),矮小假丝酵母2株(3.3%),二孢结合酵母1株(1.7%),Schwanniomycesetchellsii酵母1株(1.7%)。白云边酒醅酵母菌总数中P.manshurica占有很高的比例,这与LIU PL等[31]对白云边酒醅高通量测序分析的结果一致。

表3 白酒酒醅中分离的酵母菌Table 3 Yeasts isolation from fermented grains of Baijiu
2类环境中共有的酵母菌仅为S.cerevisiae和I.orientalis,可能是因为所采用筛选的培养基能分离酵母种属有限,或有些酵母菌丰度太低而未被筛选到[28]。土壤中热带假丝酵母(Candida tropicalis)占优势,而酒醅中盔形毕赤酵母(Pichiamanshurica)占优势,这可能与酵母菌的耐酸性及耐乙醇能力有关,于是对两来源的优势菌株进行耐酸和耐乙醇能力比较。所获得11株I.orientalis菌株编号为Z1、RC6L-P-43、GC-P-15、GC-P-17、RC6L-P-42、RC6L-P-44、CC6RP-49、3LCC-P-126、3LCC-P-127、4LCC-P-133、4LCC-P-143。
2.3 两种来源酵母优势菌耐酸耐乙醇能力测定结果
2株C.tropicalis(SWYPT-P-69,SWYPT-P-70)和2株P.manshurica(SYS-P-12,SYS-P-13)的耐酸、耐乙醇能力结果见图3。
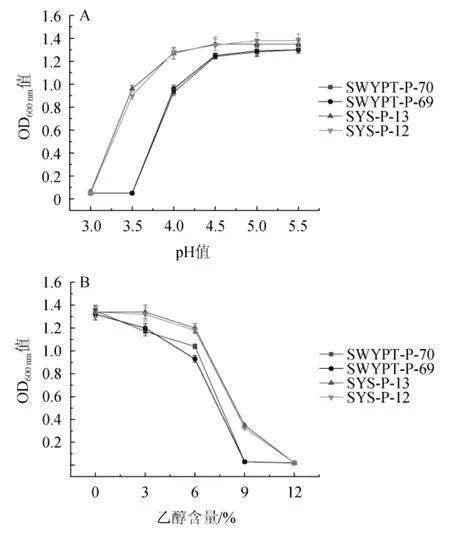
图3 热带假丝酵母和盔型毕赤酵母的耐酸(A)、耐乙醇(B)能力Fig.3 Acid(A)and ethanol(B)tolerance of Candida tropicalis and Pichia manshurica
由图3A可知,相同菌种菌株间耐乙醇能力无明显差异。在pH<5.5之前,4株菌生长均受不同程度的抑制。在培养基pH低至4.0时,24h培养C.tropicalis的生长量(OD600nm值=1.27)会明显较P.manshurica(OD600nm值=0.94)要低;在培养基pH进一步降低至3.5时,C.tropicalis不能生长,而P.manshurica还有较高的生长量(OD600nm值=0.9);在培养基pH低至3.0时,这2类酵母菌均不能生长。结果说明P.manshurica的耐酸能力明显较C.tropicalis强。
由图3B可知,相同菌种菌株间耐乙醇能力差别不大,且其都在无乙醇培养基中培养24 h达到相同菌体密度(OD600nm值=1.27)。培养基添加乙醇后,C.tropicalis和P.manshurica生长均受到抑制,且C.tropicalis的生长受到的抑制程度明显较P.manshurica的要高;当培养基乙醇含量进一步增加至9%时,C.tropicalis不能生长,而P.manshurica还有一定程度的生长量(OD600nm值=0.38);在培养基含体积分数12%的乙醇时,2类酵母均不能生长。结果说明P.manshurica的耐乙醇能力明显较C.tropicalis强。
P.manshurica的耐酸和耐乙醇能力均较C.tropicalis要好,可能P.manshurica在白酒酿造中被长期驯化而导致其耐酸耐乙醇能力较好,也有研究表明P.manshurica具有利用多种有机酸的能力[32],而一般大曲酒醅在酿造的后续阶段酸度较大,该酵母菌在白酒酿造中的功能有待进一步的研究。
2.4 东方伊萨酵母发酵特性
2.4.1 耐酸能力
I.orientalis在两环境中均占一定比重,且该菌株是白酒酿造中的功能菌,在不同香型的白酒大曲及酒醅中均有报道[3,33-34],分析其种间和不同来源菌株的发酵特性差异对探索白酒中优势功能菌株资源开发有重大意义。
33株I.orientalis的耐酸能力测定结果见图4。由图4A可知,在培养基pH值为6.5时,I.orientalis生长基本不受到抑制;当培养基pH值降低至5.0时,I.orientalis的菌液浓度略有提高;当培养基pH值降低至4.5时,I.orientalis生长受到一定抑制;当培养基pH值进一步降低至4.0后,所有菌株生长会受到明显的抑制;培养基pH值<3.5后,全部I.orientalis不能生长。由此可知,I.orientalis的最适生长pH值为5.0。由图4A可知,来源土壤的I.orientalis菌株SN4-3、SN6-1、SN7-1在pH 4.0时OD600nm值只有0.4左右,而其他菌株OD600nm值在0.64~0.90,说明来源土壤的I.orientalis耐酸能力存有较大差异,耐受性较好的I.orientalis菌株有SN1-1、SN2-3、SN8-1、SN2-1、SN6-2、SN7-2、BYB-24。由图4B可知,来源酒醅的I.orientalis种内的耐酸能力也存有差异,耐受性较好菌株有Z1、RC6L-P-42、RC6L-P-44、3LCC-P-127。耐受性较好菌株共有11株,其中来源土壤7株菌占土壤菌株的31.8%,来源酒醅4株菌占酒醅菌株的36.3%,即来源酒醅菌株在耐酸能力上有一定优势,这也是长期在酒醅酸性环境中培养驯化的结果。I.orientalis有一定利用有机酸的能力,应用在传统白酒生产酸度较大的几个轮次中也有较强的竞争力。

图4 土壤(A)及酒醅(B)来源东方伊萨酵母菌株耐酸能力Fig.4 Acid tolerance of Issatchenkia orientails from soil(A)and fermented grains(B)
2.4.2 耐高温能力
I.orientalis生长随温度变化测定结果见图5。
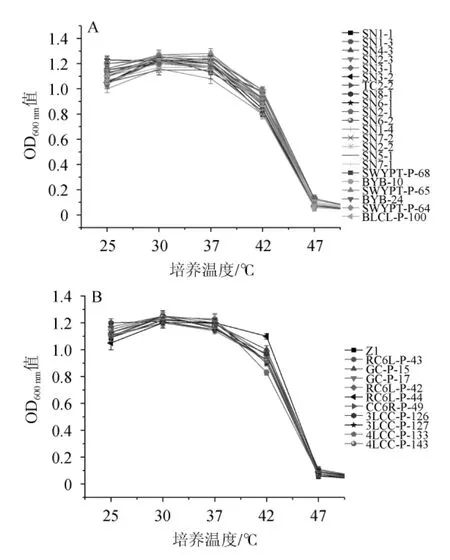
图5 土壤(A)及酒醅(B)来源东方伊萨酵母菌株耐高温能力Fig.5 High temperature tolerance of Issatchenkia orientails from soil(A)and fermented grains(B)
由图5可知,I.orientalis的最适生长温度为30℃,不同I.orientalis的耐温能力差异不大。在30℃和37℃培养,I.orientalis菌液OD600nm值均在1.0~1.3,生长旺盛;当温度提高至42℃时,菌液OD600nm值在0.8~1.0,生长受到一定的抑制,但生长仍较旺盛;当温度进一步升高至47℃培养,菌液OD600nm值<0.05,几乎不生长。耐温性较好的菌株共有11株分 别 是 SN4-3、SN1-3、TC2-2、SWYPT-P-65、SWYPT-P-64、RC6L-P-43、GC-P-15、GC-P-17、RC6L-P-42、RC6L-P-44、3LCCP-126,其中来源土壤有5株占土壤的22.7%,来源酒醅6株占酒醅的54.5%,一定程度上反映来源酒醅菌株在耐温能力较来源土壤菌株略有优势。此外,大多数酿酒酵母和非酿酒酵母在42℃条件下液体培养几乎不生长,而实验33株I.orientalis在42℃条件下液体培养菌液还有较高浓度,说明I.orientalis自身均有较好的耐温性能,在传统白酒高温堆积中会占有很强优势。
2.4.3 高温下耐乙醇能力测定结果
I.orientalis在添加体积分数为0、2%、4%、6%和8%乙醇的培养基中,42℃条件下培养24 h生长量结果见图6。

图6 土壤(A)及酒醅(B)来源东方伊萨酵母菌株在42℃的耐乙醇能力Fig.6 Ethanol tolerance of Issatchenkia orientails from soil(A)and ferm ented grains(B)at 42℃
由图6可知,在高温条件下与培养基不添加乙醇组比较,2%乙醇明显抑制了I.orientalis的生长;当培养基中乙醇含量增加至4%时,I.orientalis的生长受到严重抑制,只有较少的生长量,所测试菌株抑制效果强弱存在差异;当培养基中乙醇含量进一步增加至6%时,有少数I.orientalis有微弱的生长,其他菌株不能生长。当培养基中乙醇含量增加至8%时,所有菌株均不能生长。经过对比,有8株菌高温下耐乙醇能力较好,分别是SN7-2、SWYPT-P-68、BYB-10、SWYPT-P-65、BYB-24、GC-P-15、RC6L-P-42、CC6R-P-49,来源土壤有5株占土壤的22.7%,来源酒醅3株占酒醅的27.2%,即来源酒醅菌株在高温下耐乙醇能力上有一定优势,若将耐乙醇能力好I.orientalis的应用到白酒生产中,将有利于出酒率的提升。
2.4.4 发酵产物测定结果
分析来源土壤和来源酒醅的I.orientalis乙醇等发酵产物含量的差异,结果见表4。
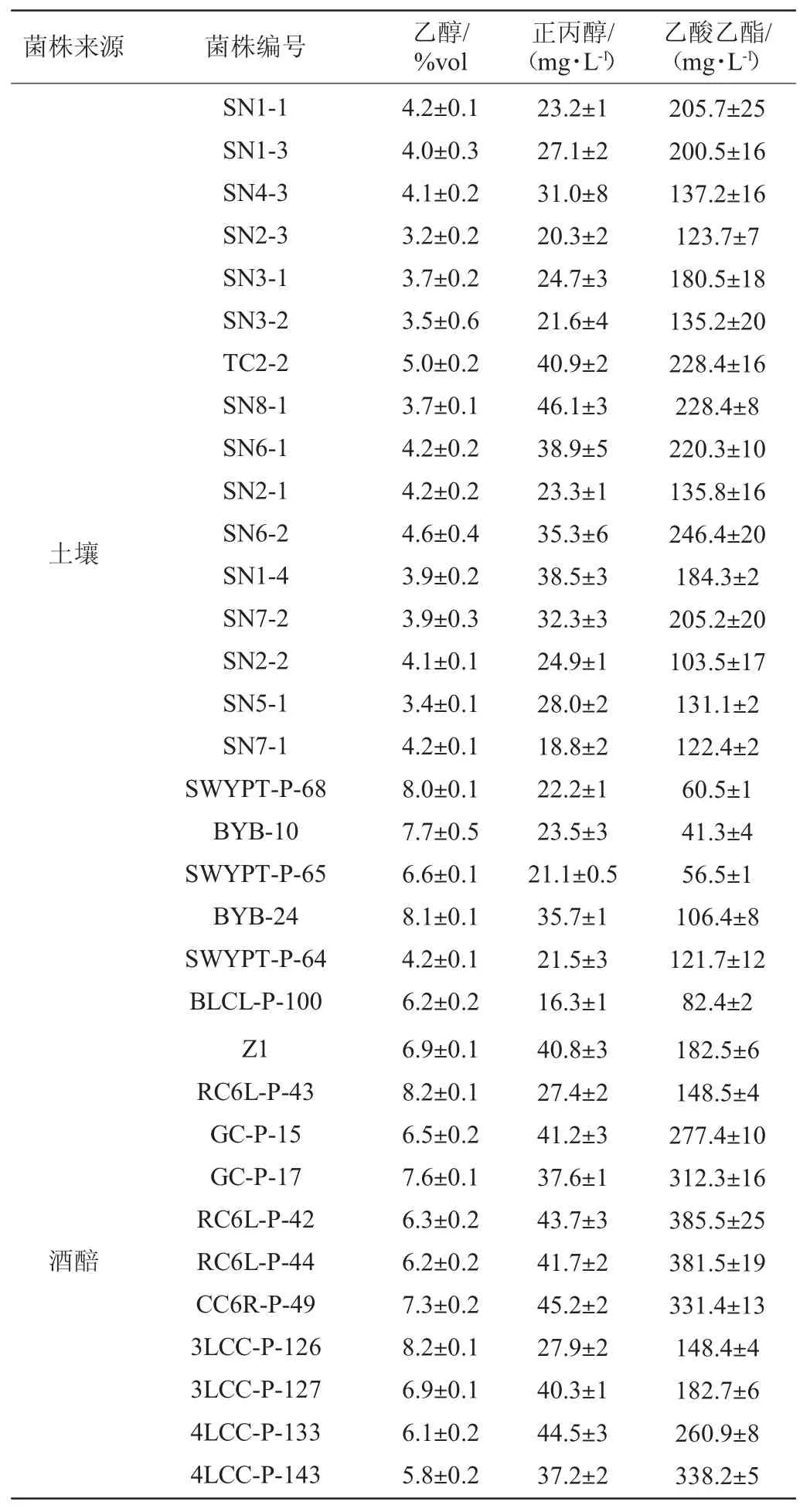
表4 东方伊萨酵母菌株液态发酵产物含量测定结果Table 4 Determ ination results of liquid fermentation product content of Issatchenkia orientails

续表
对2个来源菌株发酵产物乙醇数据进行独立样本T检验,分析得P<0.001,即来源酒醅的I.orientalis乙醇产量显著高于来源土壤菌株。同样方法分析两来源I.orientalis乙酸乙酯产量差异,分析得P<0.001,即来源酒醅的I.orientalis乙酸乙酯产量显著高于来源土壤菌株。
由表4可知,乙醇产量高于5%的I.orientails共有15株,来源于土壤的有4株分别是TC2-2(5.0%vol)、SWYPT-P-68(8.0%vol)、BYB-24(8.1%vol)、BLCL-P-100(6.2%vol),来源酒醅的有11株分别是Z1(6.9%vol)、RC6L-P-43(8.2%vol)、GC-P-15(6.5%vol)、GC-P-17(7.6%vol)、RC6L-P-42(6.3%vol)、RC6L-P-44(6.2%vol)、CC6R-P-49(7.3%vol)、3LCC-P-126(8.2%vol)、3LCC-P-127(6.9%vol)、4LCC-P-133(6.1%vol)、4LCC-P-143(5.8%vol);来源酒醅的I.orientails菌株产乙醇水平比土壤来源菌株高(SWYPT-P-68、BYB-10、SWYPT-P-65、BYB-24、BLCL-P-100除外);乙酸乙酯产量高于250mg/L的菌株有7株,均来自酒醅,分别是GC-P-15(277mg/L)、GC-P-17(312mg/L)、RC6L-P-42(385mg/L)、RC6L-P-44(381mg/L)、CC6R-P-49(331mg/L)、4LCC-P-133(260mg/L)、4LCC-P-143(338mg/L)。来源酒醅4株菌GC-P-15、GC-P-17、RC6L-P-42、RC6L-P-44、CC6R-P-49产乙醇和乙酸乙酯能力明显优于其他I.orientails。结合前面I.orientails的结果显示,来源酒醅的I.orientails在耐酸、耐温和高温下耐乙醇能力以及发酵产乙醇和乙酸乙酯较来自土壤菌株有优势,这一结果也为白酒优势优质菌株的分离筛选提供一定的理论参考,将来源酒醅的优质菌株应用到白酒生产上可提高白酒的出酒率和白酒的品质。
3 结论
本研究对白云边酒厂酒醅及其周边土壤中的酵母菌进行分离鉴定,并对这2种环境中分离的多株I.orientalis的耐受性和发酵产物进行比较分析。结果表明,酒醅与其周边土壤中的酵母菌多样性差异较大,且土壤中酵母菌种类的多样性要比酒醅中更加丰富。2种环境中共有的酵母菌重复度不高,仅有S.cerevisiae和I.orientalis在2种环境中均出现。土壤中优势酵母是C.tropicalis,而酒醅中则是P.manshurica,对这2种环境中优势酵母菌的耐受性测试结果表明,C.tropicalis的耐酸和耐乙醇能力均不如P.manshurica,这一结果与其存在的环境相一致。对来源于土壤和酒醅的33株I.orientalis耐受性测定结果表明,各菌株之间耐酸、耐高温和高温下耐乙醇能力有差异,且来源酒醅的菌株在耐受性方面较来源土壤菌株有一定优势。I.orientalis发酵结果显示,来源酒醅菌株发酵产乙醇和乙酸乙酯含量显著高于来源土壤菌株。比较白酒厂酒醅中微生物与周边环境中土著微生物的多样性及I.orientalis发酵性能的差异,将有助于揭示参入白酒发酵的菌种来源和I.orientalis优良菌株的选育。
