百香果果浆内生细菌的分离鉴定及生长条件的研究
2019-08-30陈正培吴婉莹余启明蔡锦源熊建文
陈正培,吴婉莹,张 银,向 煜,余启明,蔡锦源,熊建文*
(广西科技大学 鹿山学院 食品与化学工程系,广西 柳州 545616)
百香果(Passionfora edulis)属于西番莲科,又称鸡蛋果、巴西果,其主产于热带和亚热带地区,于1913年引入我国。目前在台湾、福建、广西、云南等地均有种植,且得到了大力发展[1-2]。百香果主要分为紫色百香果和黄色百香果,其中紫色百香果在市面上更为常见[3]。百香果果汁丰富,香味浓郁,含有丰富的挥发性香味成分,PERESTRELOR等[4]研究表明,百香果香味成分达到103种,其中包含了苹果、香蕉等水果中的主要香味成分,百香果也是因此而得名,并享有“果汁之王”的美誉[5-6]。百香果营养成分丰富,不仅含有7种人体必需氨基酸、多种对人体有益的矿物质元素(Na、K、Ca 、Mg、Zn、Fe、Ge),还含有丰富的蛋白质、膳食纤维、维生素C、维生素E和糖类等营养物质[7-8]。
百香果果汁偏酸,不宜直接食用,因此其果浆常被加工成果汁饮品。为了丰富百香果果汁饮品的种类,满足人们对生活质量日益提高的要求,对百香果果汁研究从单一的果汁饮料逐渐向复合的果汁饮料转变。如将百香果分别与芒果、菠萝、雪梨、黄瓜、火龙果、沙田柚等水果研制成复合果汁饮品[9-17]。此外,石小琼等[18]研发了糯米百香果果酒;杨玉霞等[19-21]对百香果果酒的发酵进行了探索,均得到了较好的发酵工艺;潘嫣丽等[22]对百香果果醋进行了研发。目前,对百香果果浆的研究主要集中在成分分析、果汁加工工艺、果汁的保藏等方面,然而对百香果果浆中的内生菌研究鲜见报道。陆小平等[23]分别从香蕉、柑橘中分离到的内生细菌对常见的植物病原菌具有一定的拮抗作用,而百香果果汁存在的内生细菌是否有类似的作用,百香果内生细菌对深加工有何影响等问题尚不清楚。因此,对百香果果汁内生菌的分离和鉴定具有一定的研究价值。
本研究以柳州地区紫色百香果鲜果为原料,采用平板计数琼脂(plate countagar,PCA)培养基从百香果中分离纯化得到内生细菌,通过分子生物学技术对其进行菌种鉴定,并对其生长条件进行研究。通过对百香果果浆内生菌的研究,可以为后续解决百香果果浆加工过程中发生的内源性微生物污染提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
新鲜百香果:种植于柳州地区的紫色百香果。
1.1.2 试剂
蛋白胨、酵母提取物(均为生化试剂):广东环凯微生物有限公司;琼脂粉(生化试剂):北京索来宝生物有限公司;琼脂糖(分析纯):法国BIOWEST公司;2×MasterM ix:美国Thermo公司;Ⅱ型核酸染料:北京派拓科技有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化试剂(北京)有限公司。
1.1.3 培养基
平板计数琼脂(液)培养基:胰蛋白胨5 g,酵母浸粉2.5 g,葡萄糖1.0 g,蒸馏水1 L。
LB固体培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,琼脂20 g,蒸馏水1 L。LB液体培养基中不加入琼脂。
牛肉膏蛋白胨液体培养基:胰蛋白胨10 g,牛肉膏3 g,NaCl5 g,蒸馏水1 L。
以上培养基均在121℃条件下灭菌20min。
1.2 仪器与设备
UV-1800型紫外可见分光光度计:上海美谱达仪器有限公司;L9800聚合酶链式反应仪(polymerase chain reaction,PCR仪):莱普特科学仪器(北京)有限公司;Nikon Eclipse E200光学显微镜:上海衡浩仪器有限公司。
1.3 方法
1.3.1 样品处理
选取成熟度一致、表面无任何机械损伤、大小均匀的新鲜的百香果作为实验材料,在超净工作台中,先用无菌水冲洗百香果表面,再将百香果放置在装有体积分数75%乙醇的烧杯中,浸泡5~10min,取出,无菌水果刀切掉端部,用无菌枪头轻戳百香果果肉,使之溢出果浆,再吸取鲜浓果浆至无菌离心管中。
1.3.2 内生细菌的分离与纯化
在无菌条件下,取2m L新鲜百香果果浆涂布于PCA培养基上,于28℃恒温培养箱中培养16~24 h,挑选单菌落,采用平板划线法将其纯化两次,获得目的菌株。
1.3.3 目标菌株的分子生物学鉴定
将目标菌株接种于LB液体培养基中,于28℃、200 r/min条件下振荡培养过夜,菌液室温条件下8000 r/min离心1min,去掉上清液,取沉淀,采用DNA提取试剂盒提取菌株的DNA。以其为模板,采用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-TCCTCCGCTTATTGATATGC-3')对其16SrDNA序列进行PCR扩增。PCR扩增体系:2×PCRM ix 10.0μL,27F 0.5μL,1492R 0.5μL,模板DNA 1.0μL,双蒸水(ddH2O)8.0μL。PCR扩增程序:94℃预变性5min;98℃变性30s,50℃退火30s,72℃延伸1min,共循环30次;72℃再延伸5min。PCR扩增产物送至华大基因生物公司进行测序。
测序结果在美国国立生物技术信息中心(national center forbiotechnology information,NCBI)的GenBank数据库中进行BLAST同源性搜索,选取同源性较高的模式菌株的16S rDNA序列,采用软件MEGA6.0中的邻接(neighborjoining,NJ)法构建系统发育树。
1.3.4 目标菌株生长条件的研究
培养基的选择:从平板上挑选目标菌株分别接种到pH值为7.0的9.9m LLB液体培养基、不添加琼脂的PCA培养基、牛肉膏蛋白胨液体培养基中,28℃、200 r/min恒温振荡培养10 h。然后按1%(V/V)的接种量接种至对应培养基中,28℃、200 r/min恒温振荡培养12 h,用紫外分光光度计在波长600 nm处测定吸光度值(OD600nm值)。
最适生长pH的测定:用无菌接种环取试管中保存的目标菌株1环,接种到LB培养基中,于37℃培养10 h,测定菌液在波长600nm处的吸光度值,调整菌液的OD600nm值为0.6,将其作为种子液。然后将目标菌株按1%的接种量接种于不同pH值(1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0)的LB液体培养基中,在28 ℃、200 r/min恒温振荡培养12 h,测定OD600nm值。
最适生长温度的测定:将目标菌株按1%的接种量接种于pH值为5.5的LB液体培养基中,然后分别置于15℃、20℃、25℃、30℃、35℃、40℃、45℃,200 r/min恒温振荡培养12h,测定OD600nm值。
生长曲线的测定:将目标菌株按照1%的接种量接种于pH 5.5的LB液体培养基中,在35℃、200 r/min的条件下恒温振荡培养,每隔2 h测定OD600nm值。
1.3.5 数据处理
采用SPPSS 22.0进行数据处理;采用Origin 9.1进行图形的绘制。
2 结果与分析
2.1 内生细菌的分离及鉴定
2.1.1 形态观察
利用PCA培养基对百香果果浆中的内生细菌进行分离、纯化,得到形态均一的浅黄色菌落。选取3株特征菌株(编号为GJ2-5、GJ2-13、GJ2-19)进行菌种鉴定。其在LB培养基上的菌落形态及细胞形态见图1。由图1A可知,3株细菌在LB培养基上的单菌落均为圆形,表面润滑,菌落隆起,菌落呈浅黄色不透明状。由图1B可知,3株菌均为短杆型革兰氏阳性细菌,菌体长1.5~2.0μm、宽0.5~0.8μm,两端钝圆。绝大多数单个存在,也有成串排列。
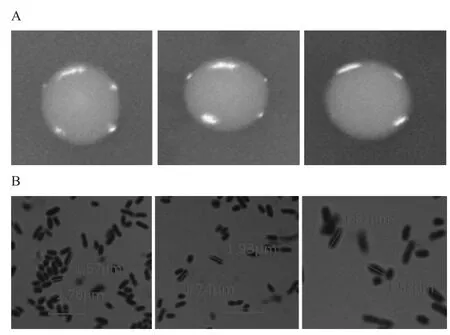
图1 菌株GJ2-5、GJ2-13、GJ2-19的菌落形态(A)及细胞形态(B)Fig.1 Colonialmorphology(A)and cellm orphology(B)of strain GJ2-5,GJ2-13 and GJ2-19
2.1.2 分子生物学鉴定
分别以菌株GJ2-5、GJ2-13、GJ2-19的基因组DNA为模板,以细菌鉴定通用引物27F及1492R进行PCR扩增,采用1.2%琼脂糖凝胶电泳检测PCR扩增产物,结果见图2。由图2可知,PCR扩增产物均在1 500 bp左右,与预期结果相符,送去测序。
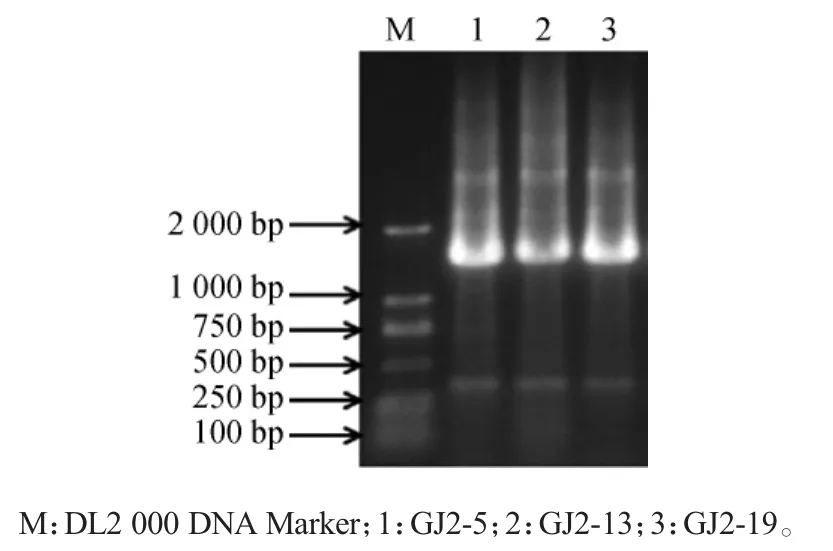
图2 16S rDNA PCR扩增产物琼脂糖凝胶电泳图Fig.2 Agarose gelelectrophoresis of 16S rDNA PCR products

图3 基于16S rDNA序列3株菌株的系统发育树Fig.3 Phylogenetic tree of 3 strains based on 16S rDNA sequences
百香果果浆内生细菌GJ2-5、GJ2-13、GJ2-19的16SrDNA序列经同源性比对,选取同源性较高的模式菌株的16SrDNA基因序列,构建系统发育树,结果见图3。由图3可知,3株菌均属于泛菌属(Pantoea),其中,菌株GJ2-5和GJ2-13均与分散泛菌(Pantoea dispersa)聚于一支,亲缘关系最近,因此,鉴定菌株GJ2-5、GJ2-13为分散泛菌(Pantoeadispersa)。菌株GJ2-19与Pantoea eucrina聚于一支,亲缘关系最近,因此鉴定菌株GJ2-19为Pantoeaeucrina。
2.2 百香果果浆内生细菌培养条件的研究
2.2.1 培养基的选择
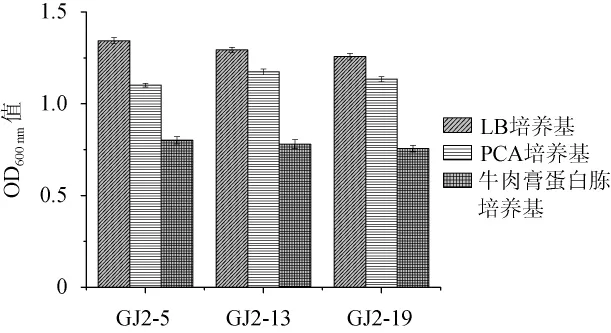
图4 百香果果浆内生细菌生长培养基的选择Fig.4 Selection of grow th medium of endophytic bacteria from passion fruit pulp
由图4可知,3株内生细菌在3种培养基上的生长情况均呈现LB培养基>PCA培养基>牛肉膏蛋白胨培养基的趋势,且在LB培养基与PCA培养基上的生长情况差异极显著(P<0.01)。因此,LB培养基更适合用于3株百香果果浆内生细菌的培养。
2.2.2 最适生长pH值的选择

图5 百香果果浆内生细菌最适生长pH值的测定Fig.5 Determ ination of optimalgrow th pH of endophytic bacteria from passion fruit pulp
由图5可知,该3株内生细菌在pH 4.0~9.0之间生长良好,其最适pH值均为5.5,但在pH 3.0以下其生长均受到强烈的抑制。百香果果浆的pH在2.0~3.0之间,说明从百香果果浆中分离到的泛菌具有较强的耐酸性,百香果鲜果果浆可抑制泛菌属的生长,但不能杀死该泛菌属。
2.2.3 最适生长温度
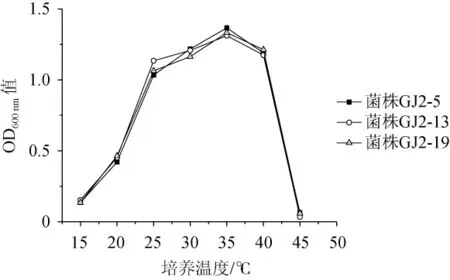
图6 百香果果浆内生细菌最适生长温度的测定Fig.6 Determ ination of optimalgrow th temperature of endophytic bacteria from passion fruit pulp
由图6可知,3株内生细菌在培养温度为24~40℃之间均呈现良好的生长状况,在该范围内其生长受温度变化的影响小,属于中温型细菌,且最适生长温度均为35℃。但当温度低于24℃之前(或高于40℃之后),其生物量随着温度的降低(或温度的升高)呈现显著下降的趋势(P<0.05),即在低温下和在高温下对温度的敏感性明显增强。
2.2.4 生长曲线

图7 百香果果浆内生细菌的生长曲线Fig.7 Grow th curves of endophytic bacteria from passion fruit pulp
由图7可知,这3株内生细菌的生长趋势一致,均在接种后的6h以内生长缓慢,处于适应期,该时期细菌主要进行细胞分裂必需物质的准备;在6~18h范围内快速生长,处于对数生长期,主要进行细胞分裂;在18~22h范围内处于平稳期,主要进行次级代谢产物的合成;22 h以后进入衰亡期。
3 结论
本研究利用PCA培养基从百香果果浆中分离得到3株菌落形态单一、均呈浅黄色的内生细菌,编号为GJ2-5、GJ2-13、GJ2-19,经革兰氏染色,均呈革兰氏阳性。通过分子生物学鉴定,鉴定3株内生细菌均为泛菌属(Pantoea),其中菌株GJ2-5和GJ2-13均为分散泛菌(Pantoea dispersa),菌株GJ2-19为Pantoeaeucrina。同时,对这3株菌的生长条件进行了研究,结果表明,3株内生细菌的最适生长培养基为LB液体培养基,最适生长pH值为5.5,最适生长温度为35℃,生长周期为迟滞期(0~6 h)、对数生长期(6~18 h)、平稳期(18~22 h)和衰亡期(22 h以后)。
