急性胰腺炎合并感染患者的病原菌分布及耐药性
2019-08-30谭波宇韦鸿雁肖俊峰谷俊远谢良伊
谭波宇,韦鸿雁,肖俊峰,陈 丽,谷俊远,邓 楠,谢良伊
(1. 湖南省人民医院 湖南师范大学第一附属医院药学部, 湖南 长沙 410002; 2. 湖南省人民医院 湖南师范大学第一附属医院检验科, 湖南 长沙 410002; 3. 中国人民解放军南部战区总医院药学部, 广东 广州 510010)
急性胰腺炎(acute pancreatitis, AP)是多种病因引起的胰酶激活,继以胰腺局部炎症反应为主要特征,伴或不伴有其他器官功能改变的临床常见急重症。近年来AP发病率逐年增高,尤其是重症急性胰腺炎(severe acute pancreatitis, SAP)起病凶险,病死率高达36%~50%[1-2]。AP患者各阶段均可合并感染,耐药菌感染是影响SAP患者预后的独立危险因素[3-4]。本研究收集2016年1月—2018年11月AP合并感染患者的资料,对其感染细菌的分布及耐药情况进行统计分析,以期为临床合理选用抗菌药物提供参考。
1 对象与方法
1.1 研究对象 2016年1月1日—2018年11月30日湖南省人民医院AP合并细菌感染的住院患者。纳入标准:AP诊断符合《急性胰腺炎诊治指南(2014)》的临床与分期标准,并参照第8版《外科学》[5],急性生理学和慢性健康评分标准(APACHE II评分)≥8分,提示重症胰腺炎。排除标准:妊娠、哺乳期妇女;有严重免疫系统疾病者,如有人类免疫缺陷病毒(HIV)感染史、器官移植史的患者;以及患血液系统疾病或恶性肿瘤的患者。入院后予禁食、胃肠减压、肠外营养等对症支持治疗,药物治疗包括解痉、止痛、质子泵抑制剂抑酸和胰酶抑制等。SAP患者予以液体复苏、重症监护及器官功能的维护治疗,有感染指征及早予以广谱抗菌药物治疗,合并肝胆结石患者予以手术,胰腺脓肿等予以引流。
1.2 标本来源 送检标本包括严格无菌操作下首次腹腔置管引流液,手术中胰腺与周围坏死组织、渗液、脓液、胆汁,血液或深静脉导管尖端血等。
1.3 培养鉴定及药敏试验 将标本及时接种培养,采用VTIEK-32全自动微生物鉴定仪对病原菌进行鉴定,质控菌株为金黄色葡萄球菌ATCC 25923、大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853。采用纸片扩散法(K-B法)进行药敏试验,药敏结果的判断按照美国临床实验室标准化协会(CLSI)2015版标准进行。
1.4 多重耐药菌(MDRO)判断标准 参照《多重耐药菌医院感染预防与控制中国专家共识》[6]中MDR的定义进行判断。
2 结果
2.1 一般资料 共收集AP合并细菌感染患者262例,其中SAP 73例。男性144例,女性118例,平均年龄(55.21±13.99)岁,平均住院日数(30.35±28.50)d。胆源性AP 201例,高脂血症性AP 26例,创伤性AP 13例,其他原因导致的AP 22例。166例伴有基础疾病,256例出现并发症。患者预后情况:治愈73例、好转172例、恶化13例、死亡4例。
2.2 病原菌分布 262例AP合并感染患者,共分离出病原菌291株,其中革兰阴性菌207株,革兰阳性菌84株。居前5位病原菌依次为大肠埃希菌(24.40%)、肺炎克雷伯菌(15.46%)、鲍曼不动杆菌(13.75%)、屎肠球菌(13.40%)和粪肠球菌(6.88%)。将AP按疾病严重程度分成SAP组与非SAP组,两组患者均以大肠埃希菌检出率最高,分别为21.54%、26.71%;与非SAP组相比,鲍曼不动杆菌、肺炎克雷伯菌在SAP组中检出率较高,分别占21.54%、19.23%,且鲍曼不动杆菌检出的构成比两组之间比较,差异具有统计学意义(χ2=8.13,P<0.05)。见表1。
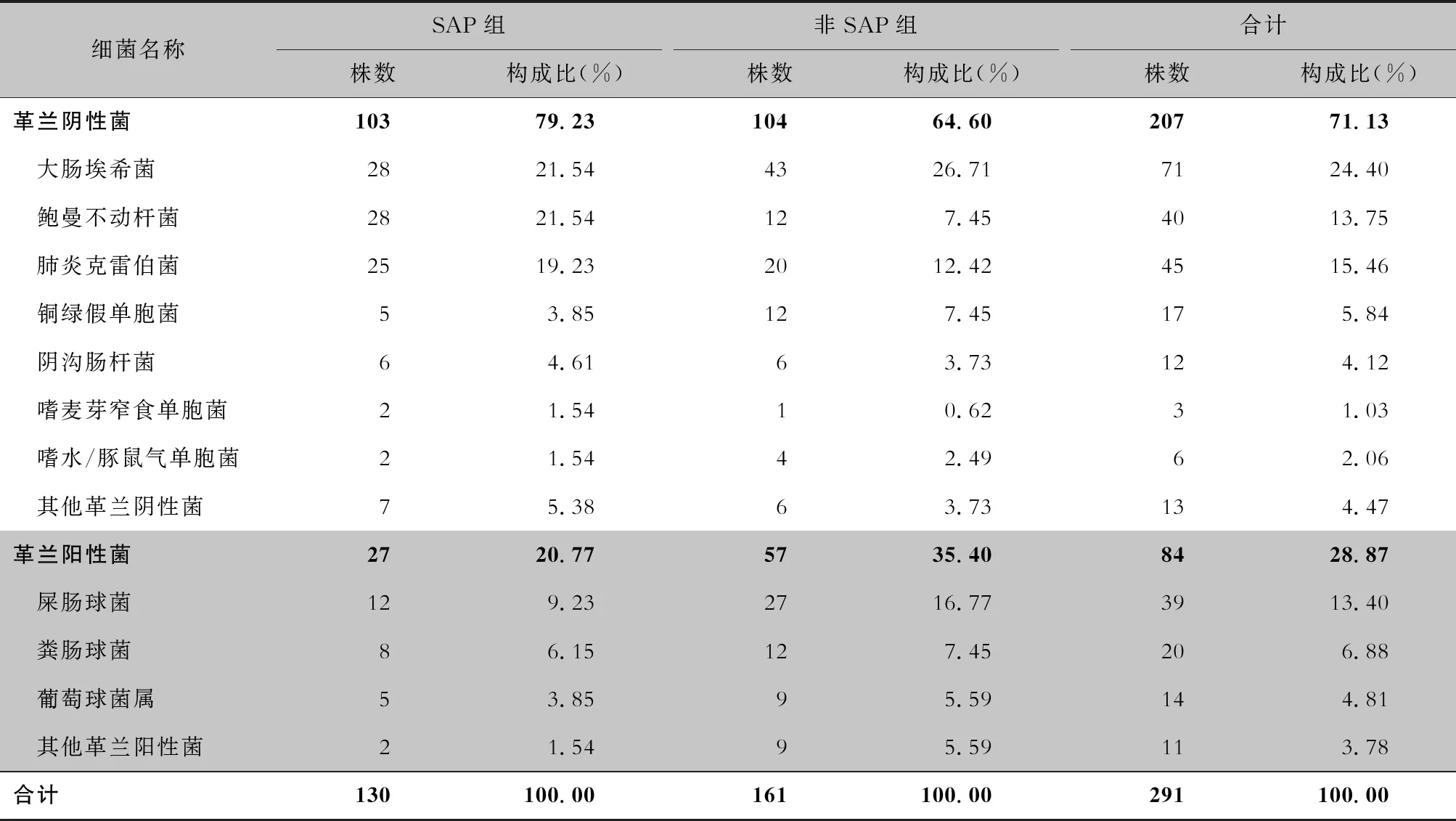
表1 SAP组与非SAP组患者感染病原菌种类及构成比
2.3 病原菌标本来源分布 病原菌分离主要源自腹腔内和胆汁,占全部病原菌的79.04%。见表2。
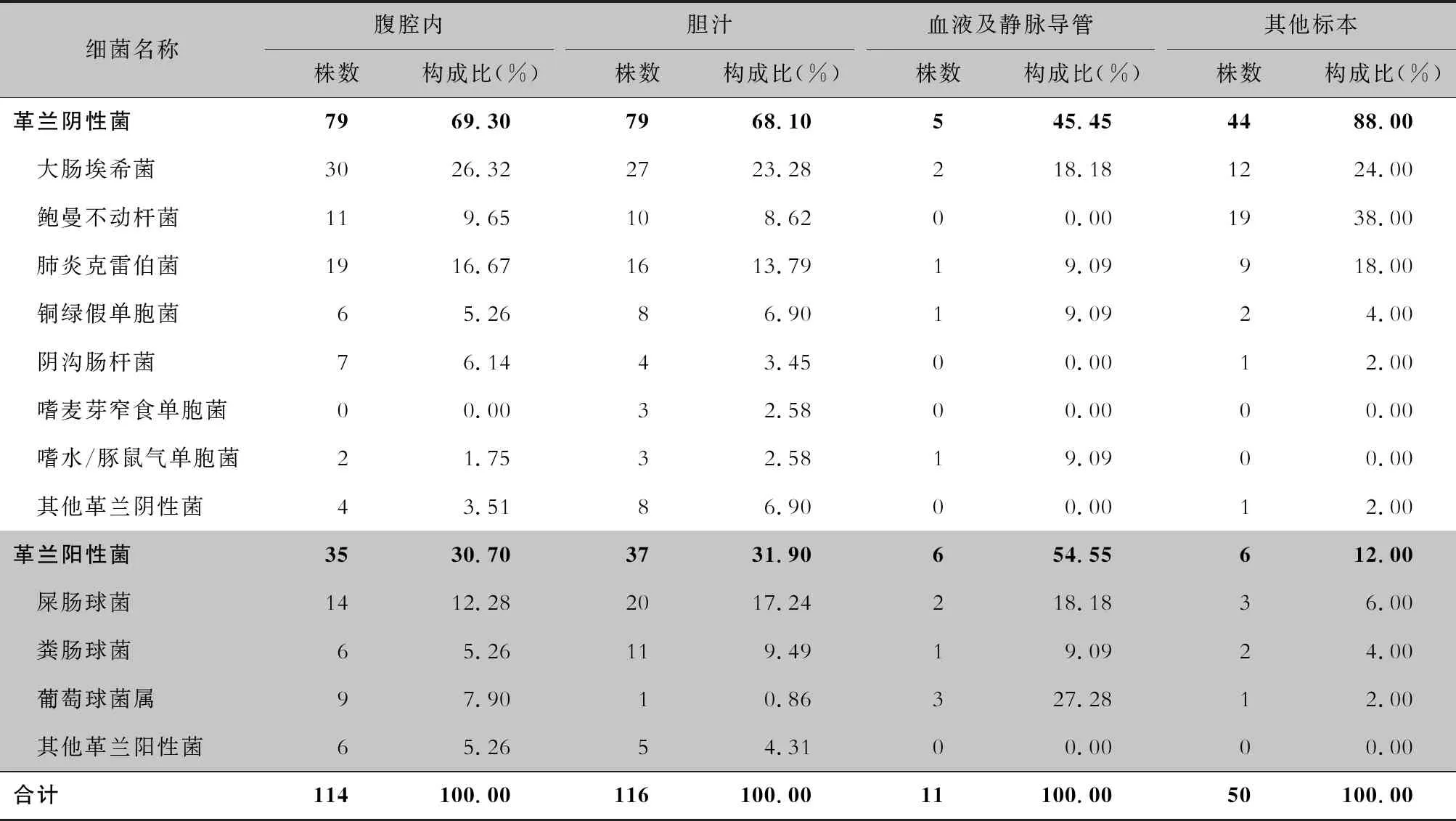
表2 病原菌标本来源分布及构成比
注:腹腔内标本包括胰腺与周围坏死组织、渗液、脓液,其他标本包括留置导管、分泌物
2.4 革兰阴性菌药敏结果 大肠埃希菌及肺炎克雷伯菌中,产超广谱β-内酰胺酶(extended-spectrum β-lactamase, ESBLs)菌株检出率分别为66.20%(47/71)及68.89%(31/45),对第三代头孢、氟喹诺酮类抗菌药物耐药率均在50%以上,对亚胺培南耐药率分别为9.86%和35.56%,未检出对替加环素耐药的菌株。阴沟肠杆菌对含酶抑制剂抗生素哌拉西林/他唑巴坦及头孢哌酮/舒巴坦耐药率分别为75.00% 和58.33%,对亚胺培南耐药率为16.67%;鲍曼不动杆菌除对氨苄西林/舒巴坦、阿米卡星的耐药率<35%外,对其他大部份抗菌药物的耐药率均>60%;铜绿假单胞菌对含酶抑制剂、氟喹诺酮类、氨基糖苷类抗生素的耐药率<30%,对亚胺培南耐药率为35.29%。见表3。
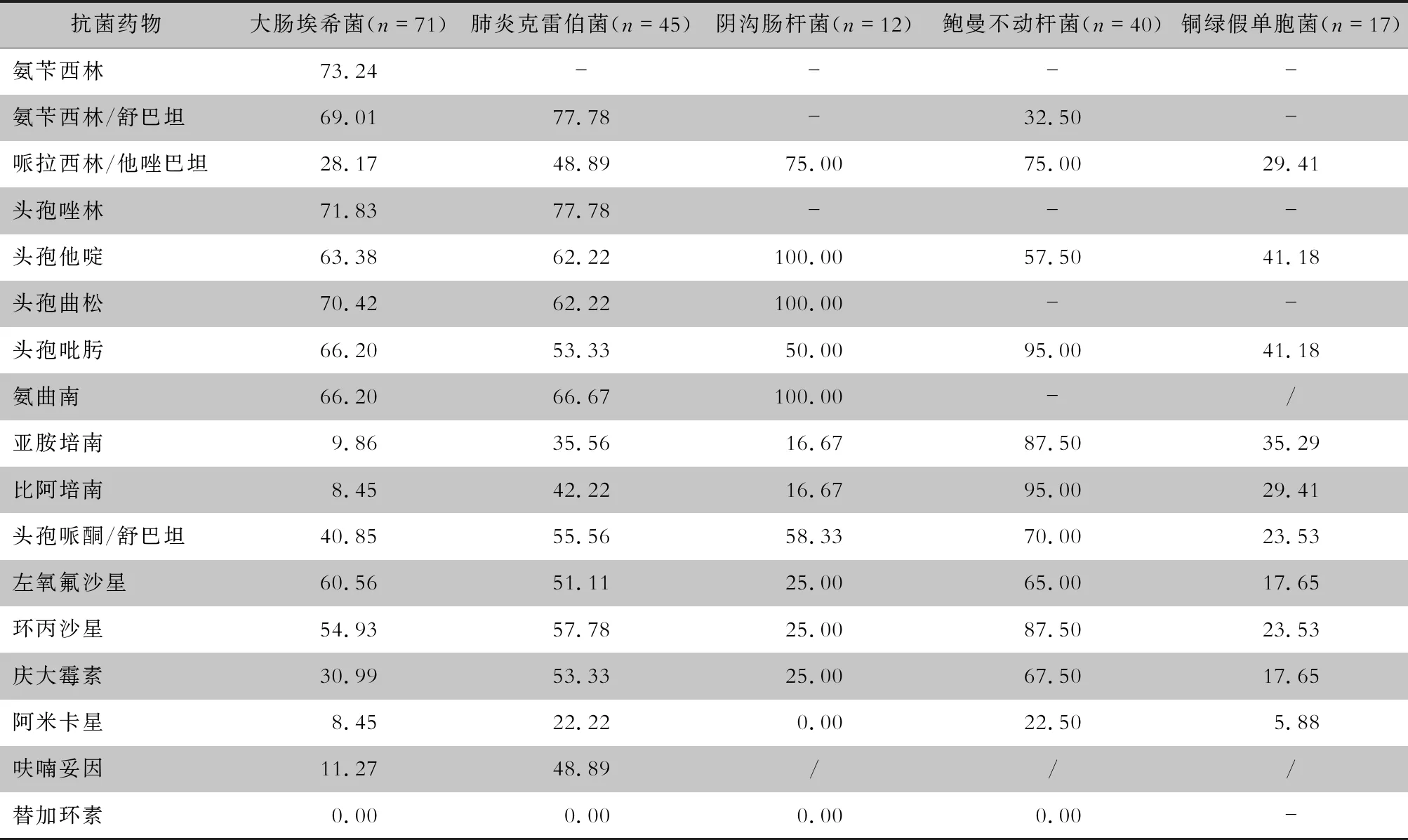
表3 主要革兰阴性菌对常用抗菌药物的耐药率(%)
-:天然耐药;/:未检测
2.5 革兰阳性菌药敏结果 屎肠球菌对临床常用的氟喹诺酮类抗菌药物、红霉素和克林霉素耐药率较高,均>60%。粪肠球菌对红霉素、克林霉素和四环素的耐药率≥50%。葡萄球菌属细菌对大部分临床常用抗菌药物的耐药率>50%。未检测出耐利奈唑胺、万古霉素、替加环素及替考拉宁的革兰阳性菌株。见表4。
2.6 MDRO感染情况 207株革兰阴性菌中,有MDRO 63株(30.43%),以鲍曼不动杆菌为主(35株,占55.56%)。AP患者中混合感染144例(54.96%),单一感染者118例(45.04%)。SAP患者较非SAP患者、胆源性AP患者较非胆源性AP患者MDRO感染率高(分别为47.52% vs 14.15%、34.93% vs 19.67%),差异均有统计学意义(均P<0.05)。见表5。
3 讨论
胰腺炎可能为胆结石并梗阻、血脂过高(代谢性疾病)[2, 7]、饮酒[8]、高钙离子浓度等因素引起的炎性疾病[9],具体机制不明。胆源性胰腺炎是中国AP最常见的病因,约占50%~80%[10-11]。本研究发现合并细菌感染的AP患者中胆源性胰腺炎患者占76.71%,与既往文献[12]报道相比偏高。可能与该院肝胆科是临床特色科室之一,大多数患者来自肝胆科有关;也可能与本研究中SAP患者较多(占27.86%),年龄偏大(55.21±13.99岁),平均住院时间长,入住ICU比例较高,进行肝胆结石切除及引流等有创手术,合并糖尿病、高血压等多种基础疾病,存在低蛋白血症及心、肾等多器官衰竭等易发生感染的因素有关。
表4主要革兰阳性菌对常用抗菌药物的耐药率(%)
Table4Antimicrobial resistance rates of major gram-positive bacteria(%)
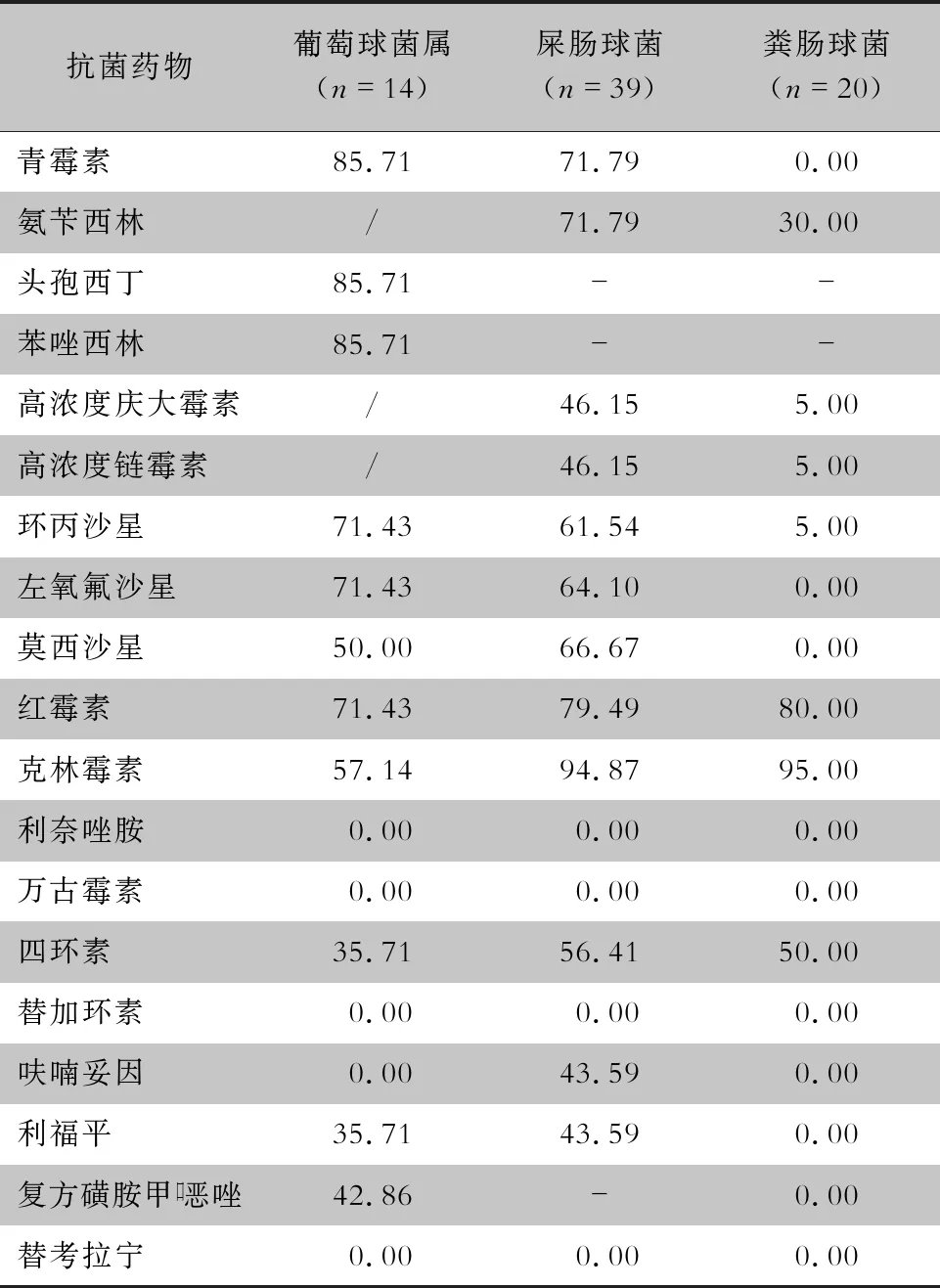
抗菌药物葡萄球菌属(n=14)屎肠球菌(n=39)粪肠球菌(n=20)青霉素85.7171.79 0.00氨苄西林/71.7930.00头孢西丁85.71--苯唑西林85.71--高浓度庆大霉素/46.15 5.00高浓度链霉素/46.15 5.00环丙沙星71.4361.54 5.00左氧氟沙星71.4364.10 0.00莫西沙星50.0066.67 0.00红霉素71.4379.4980.00克林霉素57.1494.8795.00利奈唑胺 0.00 0.00 0.00万古霉素 0.00 0.00 0.00四环素35.7156.4150.00替加环素 0.00 0.00 0.00呋喃妥因 0.0043.59 0.00利福平35.7143.59 0.00复方磺胺甲口恶唑42.86- 0.00替考拉宁 0.00 0.00 0.00
-:天然耐耐;/:未检测
表5AP患者病情严重程度、病因与MDRO感染的关系
Table5Relationship between the severity, etiology and MDRO infection in AP patients
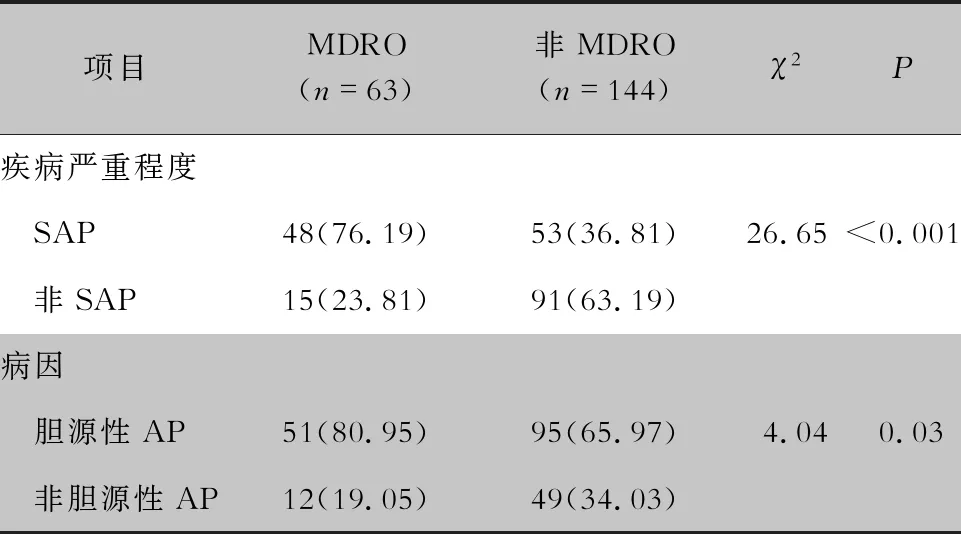
项目MDRO(n=63)非MDRO(n=144)χ2P疾病严重程度 SAP48(76.19)53(36.81)26.65<0.001 非SAP15(23.81)91(63.19)病因 胆源性AP51(80.95)95(65.97)4.040.03 非胆源性AP12(19.05)49(34.03)
本研究所分离的病原菌主要来源于腹腔内及胆汁,革兰阳性菌占28.87%,以肠球菌属及葡萄球菌属为主,病原菌分布与国内研究[13]类似,其中SAP患者革兰阳性菌感染率占20.77%,低于文献[14]报道的36.57%。革兰阴性菌占71.13%,以大肠埃希菌、肺炎克雷伯菌、鲍曼不动杆菌为主,病原菌的分布情况与文献[14]报道结果基本一致。207株革兰阴性菌中,MDRO占30.43%,主要为鲍曼不动杆菌(35株,占55.56%),其次为肺炎克雷伯菌(14株,占22.22%),与上海瑞金医院报道[15]的MDRO占革兰阴性菌的58.97%,以肺炎克雷伯菌为主(占56.52%),其次为鲍曼不动杆菌(31.88%)不同。对比该院与瑞金医院前后两次追踪的数据结果[15-16],发现胰腺或胰周感染的细菌学随时间发生了改变,而且细菌谱也有变迁,此结果可能与抗菌药物的选择性压力和交叉耐药有关,值得进一步研究探索。
与非SAP组患者相比,SAP组患者MDRO感染的发生率更高,病原菌以鲍曼不动杆菌、肺炎克雷伯菌为主,与许志伟等[15]报道基本一致。Moka等[17]研究显示,556例AP感染患者,MDRO感染约占50%,甚至出现了耐替加环素和多粘菌素的菌株。胆源性AP组患者MDRO感染发生率高于非胆源性AP组。文献[1]报道胆汁细菌感染可诱发胰腺炎,而且可以加速胰腺炎的进程,导致肺、心及肾等多器官功能的衰竭,进展为SAP,病死率大幅增高[18]。AP合并感染患者细菌主要来源于肠道菌群移位或者有细菌的胆汁[3, 19]。SAP患者机体免疫力下降,有创操作,长疗程应用抗菌药物、质子泵抑制剂、肠外营养液等因素更易导致肠道菌群移位[20],以及条件致病菌感染[13, 21];加之SAP患者ICU入住时间相对较长,多重感染、 混合感染比例高,均可导致SAP患者更容易发生MDRO感染。各种胆道原因引起的Vater壶腹部梗阻导致胆胰管排空不畅,影响胆汁的正常排出,导致肠道细菌上行侵入,继而引发或加重胰腺炎。因此,相对于高脂血症性、酒精性AP等病因,胆源性AP患者合并MDRO感染的发生率更高。与此同时,AP患者合并感染的革兰阳性菌,其耐药形势也不容乐观。本研究结果显示,葡萄球菌属细菌对青霉素、头孢西丁及苯唑西林的耐药率几乎为100%,屎肠球菌对青霉素类、头孢菌素及氟喹诺类抗生素的耐药率也为50%以上。虽然未检出耐万古霉素、利奈唑胺、替考拉宁的革兰阳性菌,但是随着抗菌药物的广泛应用,细菌耐药性逐渐变迁,选择性压力逐渐增大,给临床治疗带来了巨大的挑战[17]。
应用抗菌药物预防胰腺炎继发细菌感染仍然存在学术争议[17],最近的Meta分析结果显示,不支持常规预防性使用抗菌药物来避免胰腺坏死感染的发生[22]。抗菌药物诱导病原菌耐药及耐药病原菌的传播可增加胰腺炎患者的病死率[23]。因此,应合理使用抗菌药物,进行多学科合作及管理,以降低SAP患者细菌感染的耐药率及病死率。加强对MDRO感染患者的有效隔离,严格执行无菌操作规程及手卫生,有效防止MDRO传播及其医院感染的发生。
