脓毒症患者血清SOD水平与病情及预后的关系探讨
2019-08-29夏誉叶素贞
夏誉 叶素贞
脓毒症是感染引起的全身炎症反应,当病情进一步发展可导致器官功能障碍或组织低灌注,经充分的液体复苏仍持续存在组织低灌注情况会演变为脓毒性休克[1]。尽管目前广泛使用抗生素进行治疗,但脓毒症依旧是威胁人类健康的难治性疾病,尤其是脓毒性休克的死亡率更是高达20%~50%[2]。早期判断评估脓毒症患者的病情有利于改善其预后。脓毒症时炎症细胞激活产生大量活性氧物质(reactive oxygen species,ROS),导致机体的氧化和抗氧化失衡。超氧化物歧化酶(superoxide dismutase,SOD)可以特异性清除体内ROS,但脓毒症时SOD被大量消耗,体内大量聚集的ROS导致细胞发生氧化损伤。目前已发现SOD是最主要的抗氧化剂,其浓度与器官受损程度相关,且便于快速及重复测量[3]。本研究旨在探讨SOD水平对脓毒症病情及预后的关系,现报道如下。
1 对象和方法
1.1 对象 选取2018年5月至9月本院急诊科收住的脓毒症患者78例,男45例,女 33例,年龄18~91(62.26±15.84)岁;并选取本院健康体检者20例为对照组,男12例,女 8 例,年龄 24~89(54.65±16.93)岁。两组受试者的性别、年龄比较无统计学差异(P>0.05)。纳入标准:脓毒症及脓毒性休克临床诊断依据《2012国际严重脓毒症和脓毒性休克诊治指南》[1]。排除标准:恶性肿瘤、自身免疫性疾病、妊娠及哺乳期妇女、年龄<18岁。本研究经本院伦理委员会批准,患者及家属同意。
1.2 检测项目及方法 脓毒症患者入院24h内、对照组于体检时抽取静脉血10ml,不抗凝,室温下凝固后5 000g×5min离心,取上层血清,置于-20℃保存,检测SOD、血常规、C-反应蛋白(CRP)、活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、纤维蛋白原(FIB)、肌酐(Cr),脓毒症患者并检测降钙素原(PCT)、乳酸(LAC)水平。血清SOD水平测定采用ELISA法,试剂盒购自南京建成生物工程研究所。检测步骤严格按照试剂盒说明操作。
1.3 脓毒症患者分组 根据患者是否发生休克分为脓毒症未休克组54例和脓毒症休克组24例;根据患者28d的生存情况,随访28d后仍存活的患者为存活组,院内死亡或自动出院后28d内死亡者为死亡组。
1.4 统计学处理 采用SPSS 19.0统计软件。计量资料以表示,两组间比较采用独立样本t检验;计数资料组间比较采用χ2检验;相关性分析采用Spearman相关。P<0.05为差异有统计学意义。
2 结果
2.1 脓毒症组与对照组的SOD水平和炎症指标比较 与对照组相比,脓毒症患者的SOD水平明显降低,而WBC、PT、APTT、FIB、Cr明显升高,差异均有统计学意义(均P<0.05)。见表 1。

表1 脓毒症组与对照组SOD水平和炎症指标比较
2.2 脓毒症休克组与未休克组SOD水平和炎症指标比较 脓毒症患者休克组与未休克组比较,SOD水平明显降低,而 PT、Cr、CRP、PCT、LAC 相比于未休克组明显升高,差异均有统计学意义(均P<0.05)。两组患者的FIB、WBC、APTT 均无统计学差异(均 P >0.05),见表2。

表2 脓毒症休克组与未休克组SOD水平和炎症指标比较
2.3 脓毒症存活组与死亡组SOD水平和炎症指标比较存活组72例,死亡组6例。脓毒症死亡组患者的PT、Cr、PCT、LAC、CRP明显低于存活组,均有统计学差异(均P<0.05);两组间的 WBC、SOD、APTT、FIB 比较均无统计学差异(均 P >0.05),见表3。
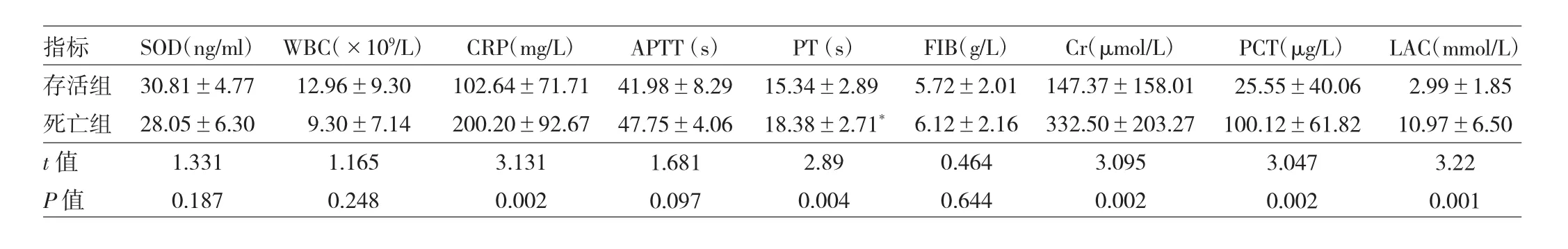
表3 脓毒症存活组与死亡组SOD水平和炎症指标比较
2.4 脓毒症患者 SOD 水平与 FIB、Cr、CRP、PCT关系分析 脓毒症患者的SOD水平与FIB、Cr、CRP、PCT呈负相关(r=-0.244、-0.267、-0.309、-0.243,均P<0.05)。
3 讨论
脓毒休克是重症监护室患者死亡的主要原因,其病理生理机制主要表现为巨噬细胞和中性粒细胞产生大量的活性氧自由基ROS和炎症因子,过量的ROS形成以及抗氧化功能障碍,促炎和抗炎反应失衡,导致器官功能不全、脂质过氧化以及DNA损伤[4-5]。研究表明,脓毒症患者的血清CRP、PCT明显升高,可以作为脓毒症可靠的诊断及预后评估指标,而PCT的灵敏度和特异度更是优于CRP[6-7]。脓毒症患者PCT升高,并且与疾病严重程度及预后相关,已将其作为脓毒症的诊断标准之一[1]。SOD是主要的特异性清除体内氧自由基的抗氧化物酶,发生脓毒症时SOD被大量消耗,催化超氧自由基转化为过氧化氢,最终分解为无害的水[8]。脓毒症患者的抗氧化能力降低,并且随着病情进展,SOD水平进一步降低,从而导致血管内皮损伤、血管内凝血直至器官功能衰竭、死亡[9]。
既往研究显示,脓毒症患者的CRP、PCT明显高于对照组,可以作为早期脓毒症感染的诊断指标,并且对评估脓毒症患者的病情有帮助[10]。赵倩等[11]研究表明,在APACHEⅡ评分的基础上联合PCT测定,可以更加准确的评估脓毒症患者病情及预后情况,并且可以评估脓毒症合并多脏器功能不全风险。我国一项对ICU住院患者的研究显示,约54.7%的脓毒症患者发生急性肾功能不全,而且急性肾功能不全是脓毒症患者病死率的独立危险因素[12]。芦丁可以通过调节肾脏的氧化应激、炎症和凋亡,如使肾脏NF-κB、TOLL样受体4、COX2、IL-6等介质恢复正常水平,改善脓毒症的急性肾功能损害[13]。本研究结果与以往研究一致,脓毒症患者的PT、APTT和Cr水平相比于对照组明显升高,脓毒性休克组的PCT、CRP、Cr和PT明显高于未休克组,表明脓毒症组的炎症因子大量释放,产生炎症高反应,并引起急性肾功能不全和凝血障碍等多脏器功能不全。
本研究还发现脓毒症患者的血清SOD水平明显低于对照组,差异有统计学意义,表明脓毒症SOD被大量消耗,导致氧自由基清除障碍,与以往研究相似[8]。研究发现,脓毒症肺炎患者血浆SOD、CRP、PCT水平明显低于单纯肺炎未发生脓毒症患者,且与CRP、PCT呈负相关,与脓毒症的病情相关联[9]。脓毒症患者并发急性肾功能不全时,产生大量氧自由基引起脂质过氧化,导致氧化损伤,血清SOD水平明显降低,经过治疗后血清SOD水平明显升高,可以改善脓毒症患者肾功能[14]。脓毒症小鼠合并急性肺损伤时,相比于无肺损伤组,肺组织中的SOD水平明显降低,通过减少炎症反应和氧化应激逆转SOD水平,可以起到保护肺组织功能[15]。此外,Li等[16]发现,通过逆转因脓毒症氧化应激而导致的SOD水平降低,从而改善脓毒症引起肺损害。
但以往研究集中在分析脓毒症与对照组间的SOD水平测定,对SOD评估脓毒症休克及预后影响因素报道较少。在此基础上,本研究进一步研究探讨脓毒症休克患者与未发生休克脓毒症患者SOD水平变化对脓毒症患者病情评估和预后影响。结果发现,脓毒症休克患者的SOD水平较脓毒症未休克患者降低更加明显,而且血清SOD水平与PCT、CRP、Cr和休克时间呈负相关,表明SOD水平与脓毒症病情严重程度相关。以往研究发现,脓毒症合并肺损伤的患者,相比于单纯脓毒症,其血清SOD水平降低[17]。乌司他丁通过抑制JNK/c-Jun磷酸化途径,减少脓毒症ROS的产生,调节SOD水平保护血管内皮细胞损害[18]。因此,血清SOD水平可以作为预测脓毒症患者病情发展的指标。
本研究中脓毒症患者死亡组与存活组的PT、Cr、CRP、PCT、LAC有明显差异,这与以往的研究一致[9]。虽然脓毒症死亡组与存活组相比,SOD水平更低,有进一步降低的趋势,但两组间无明显统计学差异,可能与本研究样本量偏少有关。这也是本研究的不足之处。
总之,脓毒症时炎症介质大量释放,炎症指标明显升高,促使ROS大量生成,SOD被大量消耗,活性明显降低,且SOD活性与PCT、CRP、Cr和FIB呈负相关。脓毒症休克患者合并脏器功能不全时,SOD水平降低更明显,可以作为评估脓毒症预后趋势的指标。
