微小RNA-122降低乳腺癌细胞Warburg效应抑制其增殖、侵袭的作用机制研究
2019-08-29王瑾杨毅盛泳佳李文燕韩晨阳
王瑾 杨毅 盛泳佳 李文燕 韩晨阳
近几年来研究表明,肿瘤为了逃避代谢压力,发生了转移,这个过程需要能量支持,同时伴随着物质代谢[1-3]。正常细胞的能量代谢以有氧糖代谢为主,而肿瘤细胞以无氧糖酵解的代谢方式为主,这种代谢方式可以使得肿瘤获得更高的侵袭能力,逃避正常的细胞凋亡程序。正常细胞中糖类代谢的主要方式是有氧代谢,在缺氧条件下则发生糖酵解,产生乳酸[4-5]。研究证实,肿瘤细胞即使在有氧环境中依然进行无氧糖酵解,而不经过线粒体的氧化磷酸化过程[6],因此调控肿瘤物质能量代谢成了肿瘤治疗新的方向。
微小 RNA-122(microRNA,miRNA)是一种<20nt的非编码RNA,可以结合到mRNA编码区,影响蛋白质合成,在细胞生理和病理过程中发挥着重要的调控作用。乳腺癌存在多种miRNA的异常表达,其中miRNA-122在乳腺癌中呈低表达。研究表明,miRNA-122在乳腺癌中的表达水平直接影响到肿瘤患者的预后,但是miRNA-122低表达的调控原因不明,其作用机制也尚未明确[7-8]。课题组前期研究发现,miRNA-122是M型丙酮酸激酶(pyruvate kinase M,PKM)和柠檬酸合酶(citrate synthase,CS)的调控非编码RNA。PKM和CS是糖代谢的关键酶,其表达水平可以影响糖酵解过程,尤其是PKM表达增高可以促进肿瘤细胞对于葡萄糖的摄取和利用,提高其代谢水平。本研究拟以人乳腺癌细胞为对象,从能量代谢的角度探讨miRNA-122抑制乳腺癌细胞增殖、侵袭的作用机制。
1 材料和方法
1.1 细胞和试剂 人乳腺癌细胞株MCF-7、DMEM高糖培养基购于武汉普诺赛生命科技有限公司(批号:CL-0149、158758)。miRNA-122 mimic 购于德国 QiAGEN公司(批号:Q1854241);cDNA试剂盒购于凯基生物技术有限公司(批号:KGA1311);实时定量PCR试剂盒/SYBR Green Real time PCR Master Mix购于Sinobio公司(批号:E090);总 RNA 提取试剂盒(Trizol法)购于BioTeKe公司(批号:RP2041);双荧光素酶检测试剂盒、T4 DNA连接酶和感受态大肠杆菌DH5α购于Promega公司(批号:A18243654、M1794185、D1814522);Opti-MEM无血清培养基购于Gibco公司(批号:15685);CCK-8检测试剂盒购于碧云天生物技术有限公司(批号:C0037);PKM和CS单克隆抗体购于Cell signaling technology公司(批号:3827、14309);GOD-POD 法葡萄糖检测试剂盒、乳酸检测试剂盒(乳酸脱氢酶法)购于北京雷根生物技术有限公司(批号:TC0711、TC0731)。
1.2 方法
1.2.1 荧光素酶报告基因验证miRNA-122和PKM、CS的调控关系 设计野生型PKM的3′非翻译区(untranslated region,UTR)片段,序列为 3′-CUGUCCUHCAGCAAACACUCCA-5′,突变型序列为 3′-CUGUCCUGCAGCAACCUCACAC-5′。野生型CS的3′UTR片段序列为3′-GAAAGGAUUAAGAUACAACUCCU-5',突变型序列为3'-GAAAGGAUUAAGAUCUACGACU-5′。序列设计合成由吉玛生物公司完成,并进行质粒的构建,试验所用的质粒为实验室原有。PCR扩增条件为:反应体系50μl,95℃预热 4min,95℃变性 30s,55℃退火 30s,72℃延伸 90s,5 个循环;95℃变性 30s,60℃退火 30s,72℃延伸90s,25个循环;72℃延伸10min,4℃保存。将切胶回收的产物和载体酶切,T4 DNA连接酶线性化后与CD163 3′UTR片段连接,取连接产物转化至感受态大肠杆菌DH5α筛选阳性克隆。将miRNA-122转染后,PBS洗涤1次,加入裂解缓冲液后剧烈震荡15min,然后移入1.5ml离心管,10 000r/min 离心 1min 后,取上清液 20μl加入96孔板,采用多功能酶标仪检测荧光素酶活性。
1.2.2 细胞分组及 miRNA-122 类似物(mimic)转染MCF-7细胞体外采用DMEM高糖培养基培养,待细胞长至对数期后消化,将细胞分为Con组和miRNA-122组,Con组为未行miRNA-122转染的细胞;miRNA-122组进行mimic的转染。将mimic加入用DEPC处理的双蒸水,稀释浓度为100nmol/μl,将细胞接种至培养皿中,调节细胞浓度为7×105/ml,每孔体积1ml。细胞贴壁后进行转染,500μl的 opti-MEM 培养基中加入 20μl的mimic溶液,将细胞培养基更换成混合了mimic的无血清DMEM培养基。转染后12h弃去培养基,更换成DMEM完全培养基过夜培养。
1.2.3 流式细胞术检测细胞周期 Con组和miRNA-122组细胞接种在6孔板中贴壁培养24h,之后弃去培养基,加入500μl胰蛋白酶消化细胞,以PBS洗涤2~3次后,3 000r/min离心10min,收集细胞,加入 PI染液50μl,避光染色15min,洗去染液后上机检测。
1.2.4 CCK-8法检测细胞增殖能力 将Con组和miRNA-122组细胞接种到96孔板中,设置3组平行对照,待细胞贴壁后继续培养6、12、24、48h后检测细胞活力。弃去每孔的培养基后加入新鲜培养基100μl,同时加入10μl的CCK-8溶液继续孵育4h。轻轻摇匀培养板后,在450nm处检测OD值,同时设置空白培养基为空白对照。细胞增殖能力(%)=(OD实验组-OD空白对照)/OD空白对照×100%。
1.2.5 克隆形成实验 收集Con组和miRNA-122组细胞,调整细胞浓度为500~1 000个/孔,接种到6孔板中,每组设置3个复孔,同时采用含有30%FBS的DMEM培养基培养,每隔3d观察细胞状态。待细胞形成克隆后(2周时间),弃去培养基,PBS清洗2次后加入多聚甲醛固定,每孔加入结晶紫染色液1ml,摇匀后染色2min,弃去染色液后双蒸水洗2~3次,拍照后计算克隆形成数。
1.2.6 Transwell小室实验检测细胞侵袭能力 Con组
1.3 统计学处理 采用SPSS 17.0统计软件。计量资料以表示,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 荧光素酶报告基因验证 miRNA-122与 CS及PKM的靶向关系 空载体转染后,对荧光素酶活性无影响。miRNA-122转染后,miRNA-122组细胞中野生型 PKM 荧光素酶活性为(4.52±0.85),突变型 PKM 荧光素酶活性为(8.35±0.95),突变型 PKM 荧光素酶活性明显高于野生型,差异均有统计学意义(均P<0.05);miRNA-122组细胞中野生型CS荧光素酶活性为(3.57±0.35),突变型 CS 荧光素酶活性为(8.75±0.67),突变型CS荧光素酶活性明显高于野生型,差异均有统计学意义(均P<0.05)。Con组细胞中野生型PKM荧光素酶活性为(8.13±0.87),突变型 PKM 荧光素酶活性为(8.39±0.65),差异无统计学意义(P >0.05);野生型 CS 的荧光素酶活性为(8.05±0.74),突变型 CS 荧光素酶活性为(8.32±2.35),差异无统计学意义(P >0.05),见图 1。和miRNA-122组细胞加入Transwell小室,待细胞贴壁后,上室用无血清的DMEM培养基培养,下室加入10%FBS的DMEM完全培养基培养,培养24h后取出小室,弃去培养基,甲醇固定后用0.1%的结晶紫染色,棉签擦去上层未迁移的细胞后,镜下计算迁移的细胞数。
1.2.7 Western blot检测糖代谢关键酶 HK、PKM、CS 的表达水平 Con组和miRNA-122组细胞培养48h后,弃去培养基,收集细胞,PBS洗涤2次,加入RIPA蛋白裂解液冰上裂解细胞30min,离心后取上清液,BCA试剂盒测定蛋白浓度,经过SDS-PAGE凝胶电泳,PVDF转膜、脱脂奶粉封闭,加入一抗孵育过夜后以TBST漂洗,加入IgG-HRP二抗孵育,ECL显色液显色后,成像系统成像,条带采用凝胶定量分析软件Quantity One 4.4处理后,以GAPDH为内参校正。
1.2.8 葡萄糖消耗量及乳酸水平的检测 细胞培养前,按照说明书操作检测MCF-7培养基以及DMEM高糖培养基中葡萄糖浓度,结果以mmol/L为单位表示,换算后作为初始葡萄糖含量A(mmol)。将Con组和miRNA-122组细胞接种到6孔板后,设置3组平行孔,待细胞贴壁后继续培养48h后,参照说明书操作再次检测葡萄糖含量,结果为A1(mmol),细胞对于葡萄糖的消耗量(mmol/h)=(A-A1)/48h。乳酸水平的检测采用试剂盒进行,最终乳酸水平以mmol/L为单位表示。

图1 荧光素酶报告基因实验结果(与Con组比较,*P<0.05)
2.2 两组细胞的细胞周期检测结果比较 miRNA-122组细胞中S期和G1/G0期细胞比例高于Con组,差异有统计学意义(P<0.05),而G2期细胞比例与Con组比较无统计学差异(P>0.05)。细胞周期检测提示,miRNA-122组中细胞周期阻滞在G0/G1期,见图2-3。
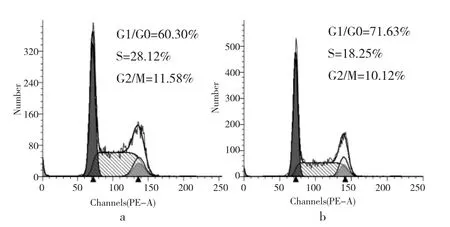
图2 流式细胞术检测细胞周期(a:Con组;b:miRNA-122组)
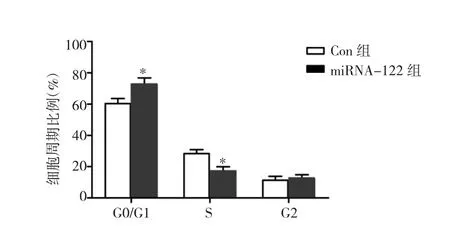
图3 两组细胞的细胞周期分布比较(与Con组比较,*P<0.05)
2.3 两组细胞增殖能力比较 miRNA-122转染后6、12、24、48h,CCK-8 检测显示,miRNA-122 组细胞增殖能力显著低于Con组,差异有统计学意义(P<0.05)。说明miRNA-122类似物可以抑制细胞的增殖,见图4。
2.4 两组细胞克隆实验结果形成比较 在克隆实验的2 周内,Con 组细胞形成的克隆数为(58.65±8.15)个,显著高于 miRNA-122 组的(19.35±3.58)个,差异有统计学意义(P<0.05),见图 5(见插页)。
2.5 各组细胞侵袭能力比较 Con组和miRNA-122组细胞均具有侵袭能力,在同一条件下培养24h后,Con组侵袭细胞(112.55±19.32)个,而 miRNA-122 组为(65.85±19.36)个,两组比较差异有统计学意义(P<0.05),见图6(见插页)。

图4 细胞增殖能力的检测结果(与Con组比较,*P<0.05)

图5 克隆形成实验(A:Con组;B:miRNA-122组;结晶紫染色)

图6 细胞侵袭实验结果(a:Con组;b:miRNA-122组;结晶紫染色,×200)
2.6 各组细胞糖酵解关键酶HK、PKM、CS的蛋白表达比较 Con组细胞中糖酵解关键酶HK、PKM和CS的蛋白水平显著低于miRNA-122组,差异均有统计学意义(均P<0.05),说明细胞糖酵解被抑制,见图7。
2.7 两组细胞葡萄糖利用率和乳酸水平比较 培养48h后,Con组中葡萄糖的消耗水平显著高于miRNA-122组,而乳酸的产生水平也显著高于miRNA-122组,差异均有统计学意义(均P<0.05),见图8。
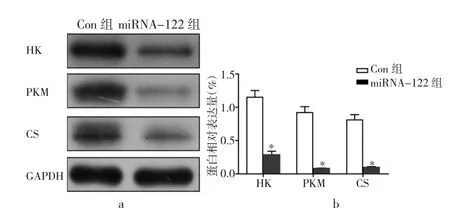
图7 两组细胞糖酵解关键酶的表达比较(a:蛋白电泳条带图;b:蛋白相对表达量统计柱状图;与Con组比较,*P<0.05)

图8 细胞葡萄糖利用率和乳酸水平(a:葡萄糖消耗水平;b:乳酸产生水平;与Con组比较,*P<0.05)
3 讨论
肿瘤细胞的能量代谢不同于正常细胞,1930年Warburg就发现肿瘤细胞中糖代谢的主要方式是无氧糖酵解,这种代谢方式不依赖于环境,称为Warburg效应。相比有氧代谢,糖酵解能够消耗更多的葡萄糖,产生乳酸,有利于维持肿瘤微环境。研究发现,绝大多数实体肿瘤中都存在代谢异常,Warburg效应广泛存在[9-10]。肿瘤细胞葡萄糖有氧代谢减少后,丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase,PDK)、乳酸脱氢酶(lactate dehydrogenase,LDH)等的高表达可以进一步促进糖酵解的发生,而糖酵解作为肿瘤糖代谢的主要方式,可以产生三磷酸腺苷(adenosine triphophate,ATP)提供能量,也可以维持肿瘤微环境的乳酸供给,从而提高了肿瘤细胞抗凋亡能力,也为延长肿瘤细胞生存期提供了物质和能量的保证[11-12]。乳腺癌是一种转移能力较高的恶性肿瘤,随着病情的发展,往往会发生骨转移、肺转移、脑转移等[13],转移过程中需要大量的能量供给,所以乳腺癌细胞的代谢异常旺盛,这种代谢能力也和Warburg效应直接相关。
miRNA能结合到mRNA 3′UTR区,导致mRNA降解或翻译受阻,从而下调靶基因的表达。miRNA表达失调与肿瘤的发生、进展和转移等有着密切联系,外周血液循环中的miRNA可作为肿瘤诊断和预后的分子标志之一。miRNA可通过小囊泡作为载体(如:外泌体exosomes)分泌到细胞外微环境中。越来越多的证据表明,miRNA能够通过这些小囊泡被转运到邻近或远处的细胞中,参与细胞功能调节[14]。研究发现,miR-122能调节细胞胆固醇外流、肝脏甘油三酯含量及β氧化率,PKM是miR-122潜在的靶基因之一[15-16]。由于脂代谢和糖代谢密切相关,以往的研究已经证实miRNA-122与脂代谢的关系,而miRNA-122也是PKM的重要调控非编码RNA之一,因此在脂代谢和糖代谢中miRNA-122可能都有一定的作用,除了可以调节脂的代谢水平外,也可以降低糖代谢的水平[17]。研究已经发现,在乳腺癌细胞中miRNA-122低表达,而外周血中miRNA-122表达增高,这提示miRNA-122可能通过细胞外分泌的方式产生生物学效应,但是miRNA-122是否影响乳腺癌细胞糖代谢还需要进一步深入的研究[18-19]。
本研究采用荧光素酶报告基因法证实了miRNA-122是PKM和CS的调控基因,miRNA-122可以抑制PKM和CS翻译过程。而PKM和CS是糖酵解的关键酶,对于葡萄糖转化成乳酸的关键环节具有调控作用。后续实验中也发现,miRNA-122类似物转染后,糖酵解相关的酶活性受到抑制,葡萄糖利用率下降,乳酸水平也下降,这表明,miRNA-122抑制了细胞的Warburg效应,降低了乳酸的产生。同时细胞周期发生阻滞,细胞增殖率也下调,细胞克隆形成能力和侵袭能力也减弱,笔者认为这也是因为细胞能量供应不足所致[20]。综合上述实验结果,笔者得出结论,miRNA-122可以通过靶向抑制PKM和CS基因表达,抑制蛋白质的翻译,同时抑制了细胞Warburg效应,降低乳腺癌细胞转移侵袭的能力。
综上所述,本研究发现miRNA-122可以通过调节乳腺癌细胞Warburg效应,抑制乳腺癌细胞转移和侵袭,这是miRNA-122在肿瘤细胞内的作用,而在细胞外和细胞间信息传递和功能依旧需要进一步深入研究。
