病毒性心肌炎与人类主要组织相容性复合体 多态性的相关性研究
2019-08-28刘嫚嫚都鹏飞
刘嫚嫚 都鹏飞
(安徽医科大学第二附属医院儿科,合肥 230000)
病毒性心肌炎是常见的儿童心血管疾病,可由多种病毒诱导,以柯萨奇B组3型病毒(coxsackievirusB3,COXB3)最为常见。研究表明,在病毒性心肌炎早期,心肌损伤的主要原因来自病毒对心肌的直接损伤,急性期之后则是以病毒介导的免疫损伤为主[1],研究表明,其发病过程与宿主的自身遗传背景因素相关,不同个体对于病毒的易感性不同[2],感染后也会出现不同结果,本研究首先建立病毒性心肌炎体外模型,在此基础上通过检测小鼠心肌组织中MHC基因的表达并以IFN-γ作为参照物,来探究对感染柯萨奇病毒的小鼠心肌细胞的MHC基因多态性的易感及保护作用,以阐明对MHC基因多态性对于病毒性心肌炎的作用机制。
1 材料与方法
1.1 材料
动物:SPF级4周龄雄性Balb/C小鼠,购买于安徽医科大学动物实验中心;
病毒:COXB3 Nancy株由安徽医科大学教研实验室赠予,使用前进行病毒滴定半数致死量;
主要材料与试剂:人宫颈癌细胞(Hela细胞)购买于南京凯基生物公司;Trizol提取液、多聚甲醛、0.25%胰酶、 DL2000marker、氯、TaKaRa One-Step RNA PCR Kit(AMV)、ELISA试剂盒、RT试剂、荧光定量PCR试剂Sybr green I、苏木素-伊红染色、中性树脂等;
1.2 方法
1.2.1细胞实验部分:将Hella细胞进行培养、传代处理,C0XB3病毒进行接种及毒力扩增,收集病毒上清液,进行毒力滴定并计算TCID50;
1.2.2动物实验确定病毒感染量:选取实验小鼠40只并随机分为A、B、C、D 4组,选取D组作为对照组,予以TCID50病毒浓度接种A组、10-1TCID50浓度接种B组、10-2TCID50浓度接种C组,3种浓度病毒毒力的病毒液0.1 mL/只,观察4组小鼠的活动状况、精神状态及体质量变化等,于第7天处死小鼠,记录血清CKMB水平及心肌组织病理改变,选择合适的造模病毒感染量;
1.2.3观察血清IFN-γ水平:选取120只小鼠,随机均匀分为病毒组及对照组,根据上述实验确定的病毒感染量进行腹腔接种病毒,建立宏观体征表,同时每天随机从2组中各选取两只小鼠进行取血解剖,ELISA法检测血清IFN-γ浓度,按照对照组结果,记录IFN-γ的水平变化;
1.2.4检测基因表达:选取病毒组及对照组小鼠各40只,分别于实验第3、7、14及28天分别处死两组小鼠各8只进行解剖处理,ELISA法检测血清IFN-γ浓度,心肌组织HE染色观察,计算心肌病变积分;
1.2.5等位基因表达水平检测:根据文献报道的Balb/c小鼠H2-Eb区第二个外显子的核酸序列设计4组序列特异性引物(分别称为MudoEb1、MudoEb4、MudoEb5、MudoEb7),以IFN-γ基因作为内参照,RT-PCR法检测心肌组织上述基因表达情况,引物序列见下表:

表1 PCR 扩增采用的引物Table 1 Primers used in PCR amplification
1.2.6感染病毒的检测及鉴别:对心肌组织进行病毒分离与RNA提取并以实时荧光定量PCR法(real-time fluorescent quantitative PCR,Q-PCR)进行病毒鉴定:先用随机引物将RNA反转录成cDNA,然后设计特异性的引物和sybr green I荧光染料进行荧光定量PCR检测。SYBR Green I 是一种能与双链DNA 结合发光的荧光染料,其与双链DNA结合后,荧光大大增强。随着扩增循环数的增加,荧光信号不断积累,根据荧光信号检测出PCR体系存在的双链DNA数量。
病毒引物设计:B3F 5′GGA CCT GCT CAA ATC GGT AGA C 3′
B3R 5′CAA ATG TGG TCA ATG CCT GTA AG 3′
1.3 统计方法
采用SPSS17.0软件系统分析,VMC组小鼠与对照组小鼠的心肌组织病理积分用two-way ANOVA检验法进行比较,基因频率=阳性基因数/(样本数×2),等位基因的基因频率比较采用卡方检验,将含有易感基因及不含VMC有此基因的VMC组进行比较,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 病毒TCID50计算
购买的Hela细胞排列紧密整齐,形态规则,包膜完整,折光度均匀,经COXB3 Nancy株感染后72 h后细胞明显皱缩变形,包膜破裂,排列紊乱,培养液中可见较多细胞碎片漂浮,通过观察细胞CPE,运用Reed-Muench法计算TCID50为10-3。
2.2 造模病毒浓度合适量
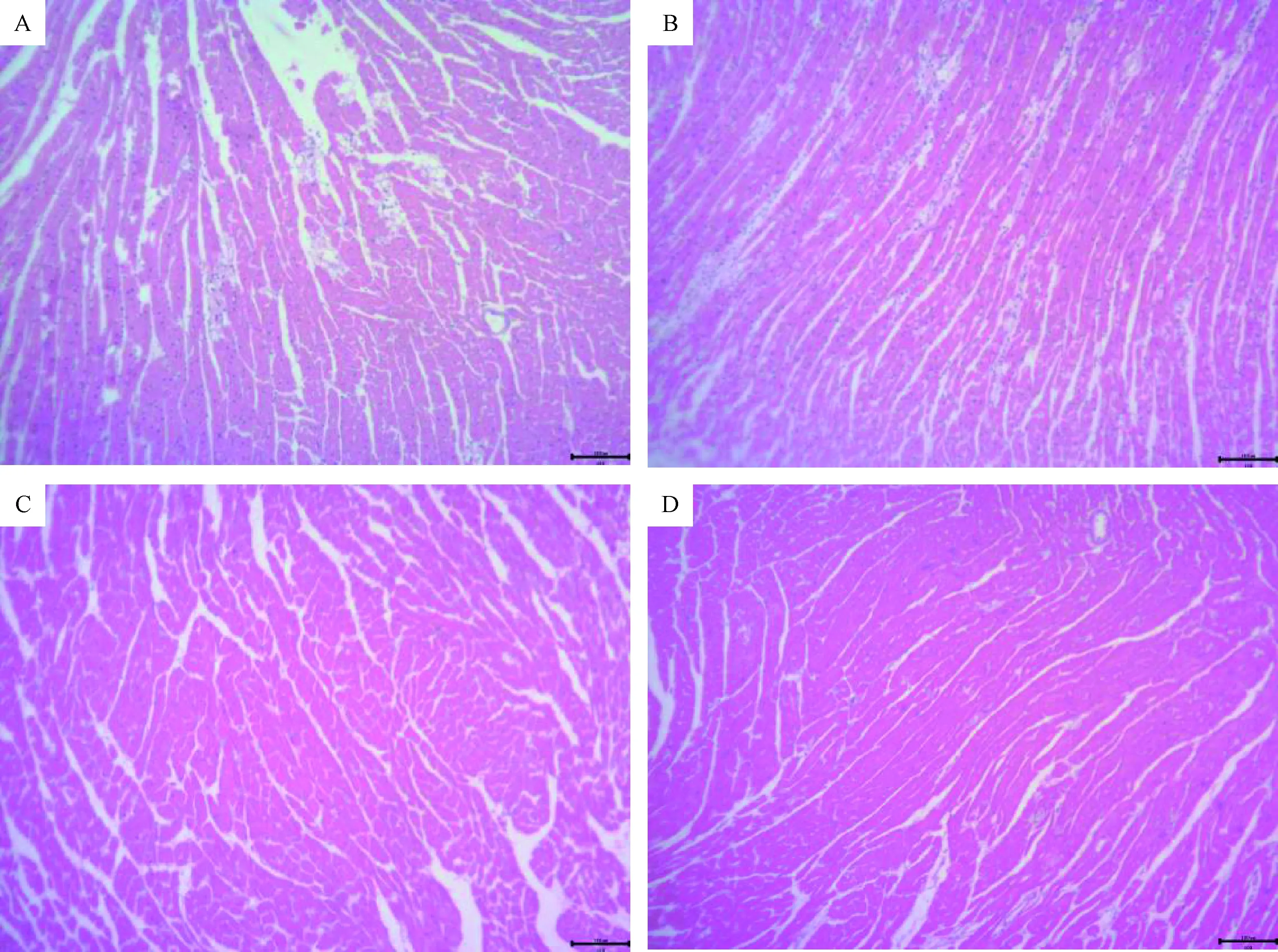
图1 第7天4组小鼠心肌组织病理图片Fig.1 The 7th day pathological image in four groups
A组小鼠第2~3天开始出现活动量及体质量下降,进食水减少,反应迟钝,第4天出现后肢瘫痪并开始死亡,至第7天出现死亡高峰,血清CKMB为(4022.39±260.56)U/L,高倍镜下显示心肌间质水肿,心肌纤维萎缩断裂,单核细胞及淋巴细胞大量浸润。B组及C组小鼠第4天开始出现体质量及活动量下降,第6天开始体质量回升,无小鼠死亡,第7天小鼠血清CKMB水平:A组(1085.78±237.3)U/L、C组(909.34±187.25)U/L,心肌病理显示心肌细胞排列整齐,可见少量的炎性细胞浸润,对照组D组小鼠状态良好,饮食活动量无减少,体质量逐渐增加,无死亡病例,第7天血清CKMB为(779.47±38)U/L,病理示心肌细胞排列整齐,间质内未见明显炎症细胞浸润表现。结合小鼠体质量变化、血清CKMB水平及心肌病理改变选择的造模合适病毒量为103TCID50/mL的COXB3液0.1 mL/只。
2.3 血清IFN-γ水平变化
取血清后进行IFN-γ水平的ELISA检测,以标准物的浓度为横坐标,用酶标仪在450 nm下的波长下测定吸光度(A值)为纵坐标,测绘出标准曲线,计算出标准曲线的直线回归方程式为y=0.002x+0.0034,计算样本实际浓度,并绘制血清IFN-γ水平变化图:及样本的实际浓度,并绘制折线图如下:
以上结果显示小鼠血清IFN-γ水平在接种病毒第3天开始升高,2周达高峰,3周开始慢慢降低。
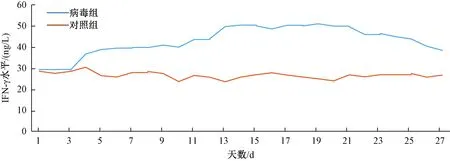
图2 血清IFN-γ水平的变化趋势Fig.2 The changing trend of IFN-γ level
2.4 两组小鼠心肌组织病理积分
经统计学分析,病毒组小鼠与对照组小鼠心肌组织病理积分结果见表2、图3。
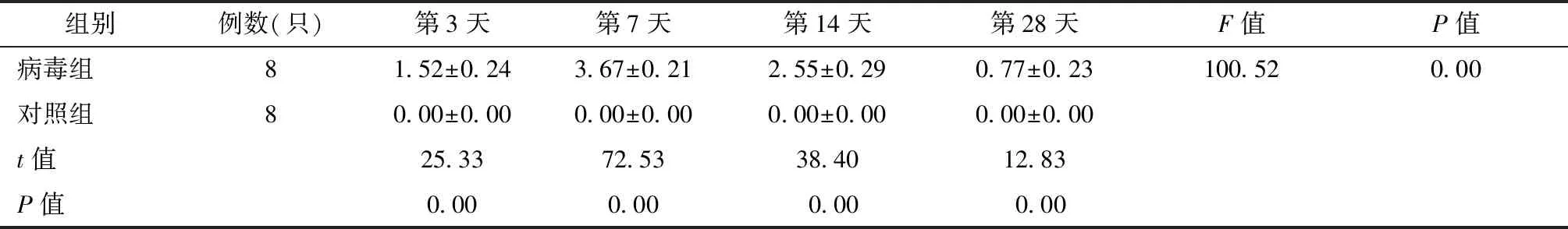
表2 VMC实验组与对照组小鼠的病理积分比较Table 2 The pathological intergral comparison between VMC mice model and normal control group
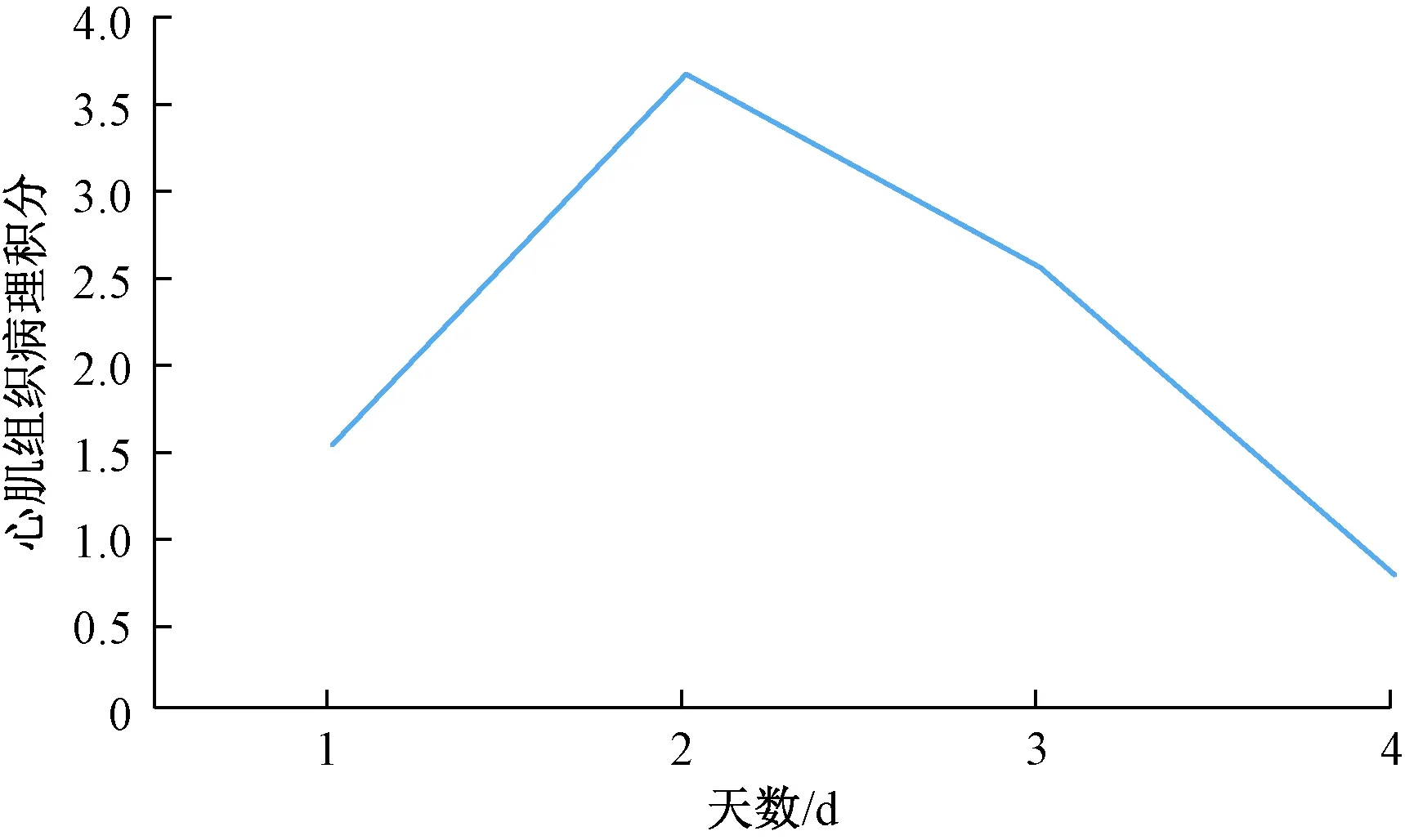
图3 病毒组小鼠心肌组织病理积分变化趋势注:1、2、3、4代表第3、7、14、28天小鼠心肌组织病理积分平均值Fig.3 The changing trend of pathological integral in VMC mice model groupNote:The number 1、2、3、4 represent pathological integral of the mice that anatomized at 3rd/7th 14th/28th day
2.5 基因表达测序结果
结合已研究过的有功能的多态性位点及NCBI数据库,并根据既往文献报道的Balb/c小鼠H2-Eb区第二个外显子核酸序列设计5组序列特异性引物(分别称为MudoEb1、MudoEb4、MudoEb5、MudoEb7)以及IFN-γ基因表达作为内参照,RT-PCR技术检测上述基因表达水平,在32只病毒组小鼠中,MudoEb 5检测阳性的共有24只(基因频率37.5%),MudoEb 7检测阳性的有9只(基因频率14.1%),对照组中检测出MudoEb5 阳性的有6只(基因频率9.4%),MudoEb7阳性共2只(基因频率3.1%),两种等位基因的表达与对照组相比差异均有统计学意义(MudoEb 5λ2=20.33P=0.00OR=13,MudoEb 7,λ2=5.38P=0.02OR=5.7)未测出其余2组等位基因阳性结果,同时与相应日龄的病理积分进行相关性分析,经计算第3天的病理积分与MudoEb5阳性的结果的相关系数r=0.449P<0.05,第7天,r=0.745P<0.05,第14天 r=0.712P<0.05,第14天 r=0.676P<0.05,表明VMC小鼠病理积分与MudoEb 5表达水平之间存在正相关关系,同时进行MudoEb 7表达水平与病理积分的相关性分析表明,两者也存在正相关。
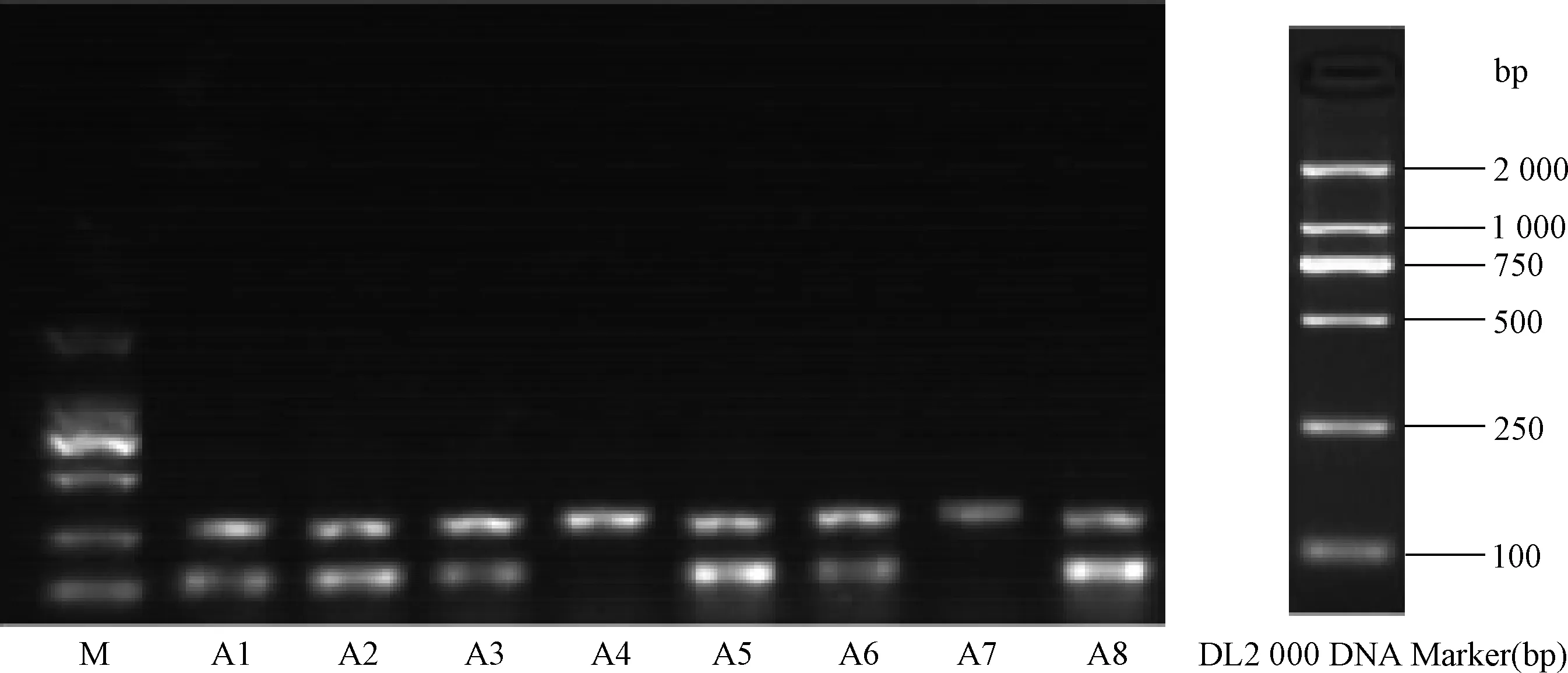
图4 第3天A组病毒组小鼠MudoEb 5基因序列电泳结果注:MudoEb 5 PCR产物大小为109 bp,A组小鼠中有6只MudoEb 5基因检测阳性,其中A1、A2、A3、A5、A6、A8为阳性;A4、A7为阴性;M: DNA Marker DL2 000Fig.4 MudoEb 5 PCR expression in VMC model mice group in 3rd dayNote:PCR result of MudoEb 5 base number is 109 bp,6 mice MudoEb 5 gene is positive,Among group A,mice; A1、A2、A3、A5、A6 and A8 MudoEb5 gene is posiive;A4 and A7 are negative;M:DNA Marker DL2 000
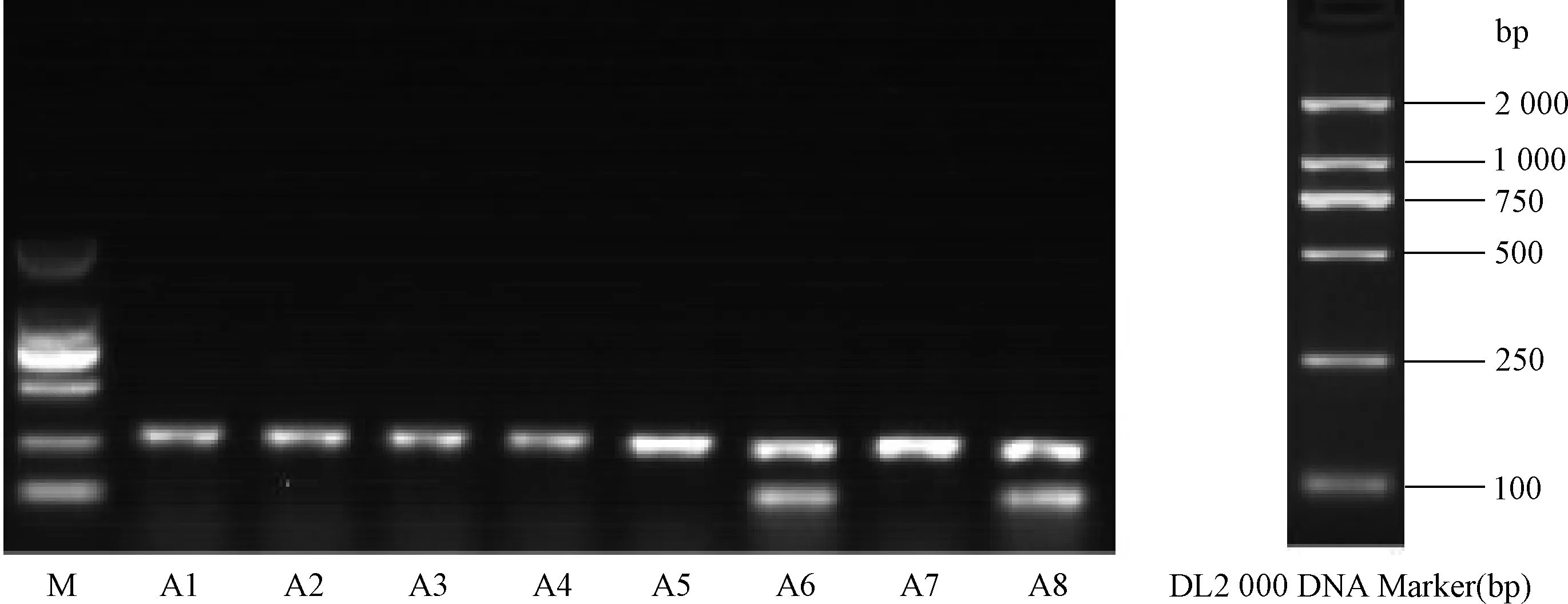
图5 第3天A组病毒组小鼠MudoEb 7 基因序列电泳结果注:MudoEb 7 PCR产物大小为103 bp, A组小鼠中2只MudoEb 7基因检测阳性,其中A6、A8为阳性;余为阴性;M: DNA Marker DL 2000Fig.5 MudoEb 7 PCR expression in VMC model mice group in 3rd dayNote:PCR result of MudoEb 7 base number is 103 bp,2 mice MudoEb 7 gene is positive, Among group A,A6 and A8 MudoEb 7 gene is positive;others are negative;M: DNA Marker DL2 000
2.6 实验小鼠感染病毒检测
Q-PCR定量检测感染心肌小鼠病毒与设计的COXB3引物序列进行比对,表明实验组小鼠确实为COXB3嗜心型病毒引起,结果如图6、图7。
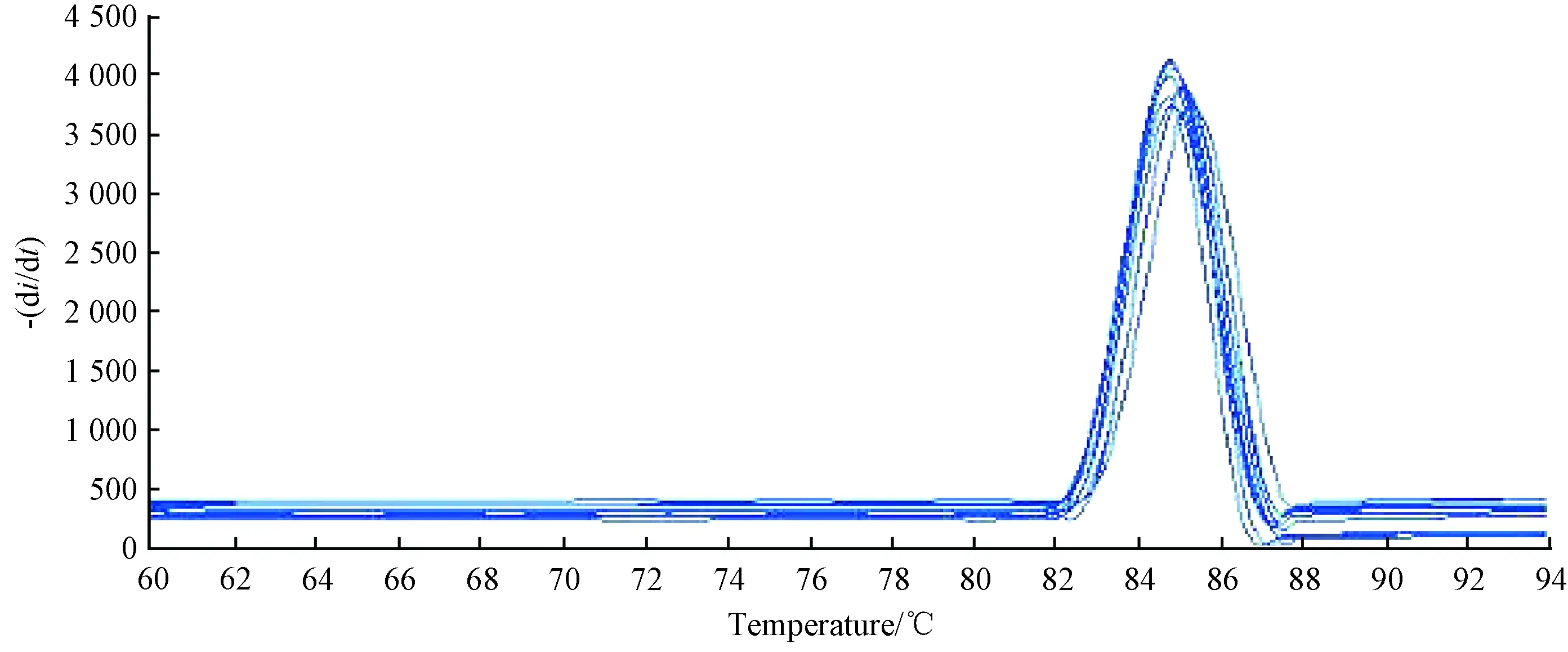
图6 COXB3的Q-PCR定量情况Fig.6 Quantitative situation of Q-PCR in COXB3
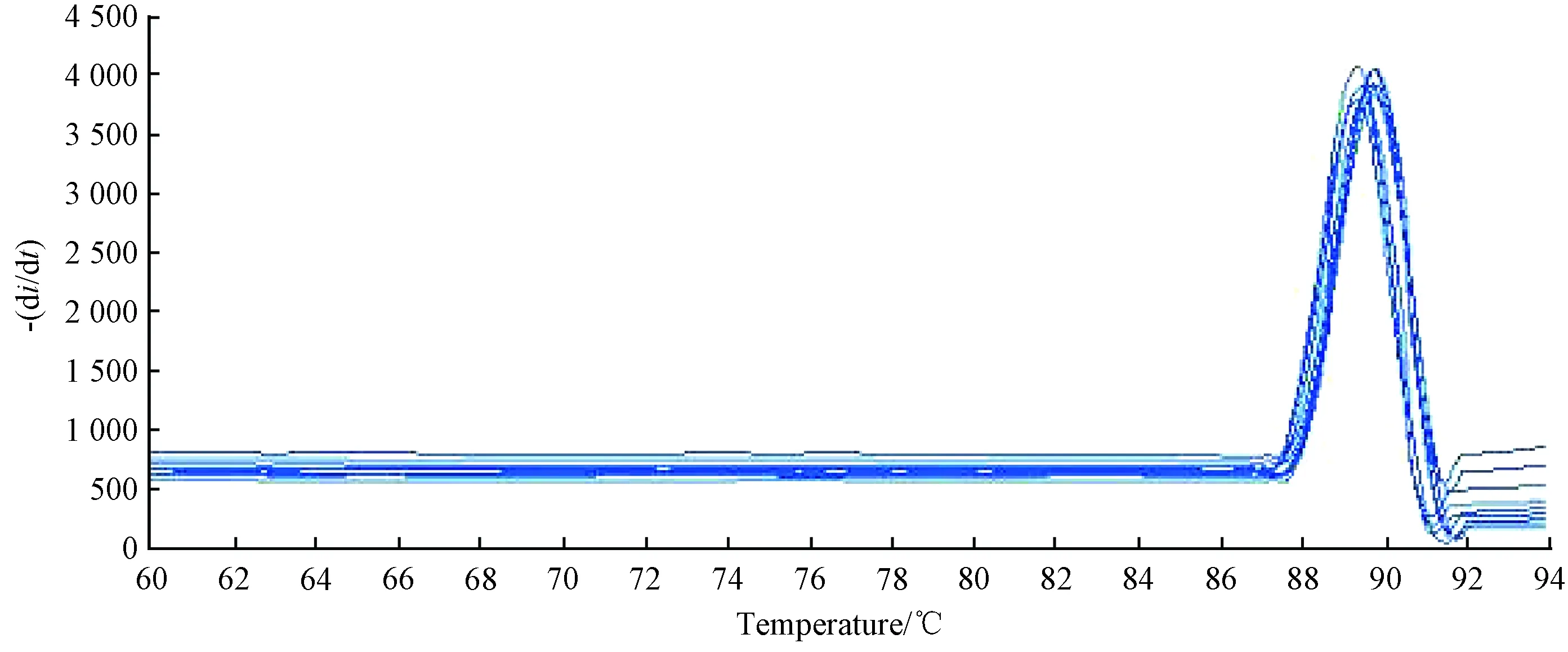
图7 内参引物序列的Q-PCR定量结果Fig.7 Q-PCR quantitative results of internal ginseng primer sequences
3 讨论
病毒性心肌炎是指由嗜心肌病毒感染引起心肌及其间质的炎性损伤,可导致心功能障碍和(或)心律失常,甚至猝死,多发于儿童。发病轻重程度不一,缺乏特异性诊疗方法,对患者的健康及生活质量影响较大。国内外学者通过血清学检测、原位杂交、反转录-聚合酶链式反应等分子生物学技术,证实可引起心肌炎的病毒常见有30余种[3],包括柯萨奇病毒、脊髓灰质炎病毒、埃可病毒、腺病毒、流感及副流感病毒等,以柯萨奇病毒最为常见,文献报道,VMC致死患者心内膜活检中,50%可检测出COXB3感染[4]。目前普遍认为VMC的发病机制主要包括:病毒的直接损伤;病毒介导的免疫损伤及多种致炎因子和NO等介导的心肌损害和微血管损伤[5]。其中以机体炎症反应最为主要,病毒入侵机体后心肌肌球蛋白等抗原暴露,此抗原与病毒表面抗原之间存在交叉作用,可直接作用于机体免疫细胞或间接通过信号转导分子促进病毒传播和激发T细胞,伴随着炎症细胞的浸润和炎症因子(TNF-α、IL-2、IL-6、IL-12、IFN-γ 等)表达量升高[6]; 心肌组织的持续炎症反应导致了心肌组织损伤和心肌细胞的凋亡坏死, 部分患者最终可演变为扩张性心肌病(dilated cardiomyopathy, DCM)和慢性心脏损伤, 在人类中有很高的发病率和致死率[7]。
机体感染嗜心肌型病毒后需依赖T细胞对病毒抗原进行识别和清除,抗原的加工提呈过程又影响T细胞对抗原的识别,进而影响疾病的发展及转归,此外不同人群对于同一株病毒的易感性不同可引起不同的慢性化或自限性清除,而免疫反应的强弱与宿主的人类白细胞抗原(human leucocyte antigen,HLA)基因的单核苷酸多态性(single nucleotide polymorphisms,SNPs)有关,HLA受控于MHC基因簇,位于人类第6号染色体短臂(6p21.31-6p21.32),HLA基因编码表达的产物在免疫系统中主要负责细胞间相互识别以及诱导免疫反应,具有免疫应答的调节功能[8]。MHC基因包括Ⅰ、Ⅱ和Ⅲ 3类基因。Ⅰ类基因包括A、B、C、E、F、G等基因座,编码组织相容性抗原的基因,编码产物存在于所有有核细胞表面;Ⅱ类基因含有DP、DQ、DR、DM、DO、DN 6个亚区,编码调节淋巴细胞增殖和相互作用及控制机体免疫反应强度的基因;Ⅲ类基因位于Ⅰ、Ⅱ类基因之间,编码控制某些补体成分和其受体产生的基因[9]。三者在常染色体上紧密连锁形成单倍型,表现共显性遗传,又有超基因(supergene)之称[10]。每类基因都有很多基因位点,而每个基因位点存在着大量的等位基因,使得MHC基因成为迄今所发现的结构最为复杂的遗传多样性系统,这些等位基因出现的频率具有显著的人种和地区差异。MHC的多样性由碱基的变化所形成[11]。碱基变化是人体适应外环境的调节方式,碱基变化导致氨基酸的变化,因此碱基突变如果发生在抗原肽结合区有可能对功能和抗原有所影响。在体液免疫反应中,有3方面的因素影响着病毒抗原递呈及抗原肽与MHC分子、TCR三元复合物之间的相互作用,包括抗原肽侧链和TCR之间的相互作用、肽骨架和MHC II类分子之间形成的序列非依赖性的氢键、抗原肽侧链和MHC II类分子抗原结合槽(antigen binding cleft)之间的相互作用[12]。根据已研究MHC的晶体结构:II类α链和β链的远膜区的抗原结合槽中分布与疾病密切相关的氨基酸序列,其由MHC 等位基因编码[13]。因此,MHC II等位基因多态性可引起抗原结合槽的构象、结合及递呈抗原肽的效率不同,从而引起不同的MHC II类等位基因对疾病的易感性不同。Balb/c小鼠的主要组织相容性复合体位于17号染色体,又称为H-2复合体(Histoeompatibility 2 eomplex,H-2 eomplex),与小鼠的特异性体液免疫应答相关的基因簇位于其I区内的E亚区,而E亚区的多态性又绝大部分体现在其β座位(H2一Eb)的第二个外显子上[14],既往研究表明,经过调控MHC II上的免疫原件可以改变VMC小鼠模型的症状表现及预后[15],本实验通过利用小鼠H2-Eb基因位点多态性,采用PCR-SSP基因技术检测出H2-Eb位点上等位基因在小鼠机体感染同一COXB3病毒株之后的表达水平不同,结果显示:MudoEb5、MudoEb7基因型与COXB3的感染转归密切相关,同时VMC小鼠炎症水平与两种等位基因型的表达水平之间存在正相关性,MudoEb5基因型的VMC小鼠炎症反应更强烈,但由于缺乏H2-Eb在COXB3感染中确切作用机制,未来需要进一步探索H2-Eb等位基因,甚至HLA等位基因及其SNPs的分子生物学功能。
本研究存在着一些局限性,首先缺少明确的作用机制研究结论,其次实验研究对象为小鼠,关于人类的病毒性心肌炎与HLA基因多态性的关系尚待研究。但本实验结果证实了H2-Eb基因多态性与病毒感染小鼠的相互关系,使之成为病毒性心肌炎发病机制的可能解释,但关于HLA基因多态性与VMC关系仍需大样本、不同民族、前瞻性及相关功能性研究中得到进一步验证,同时本实验为开展与机体免疫反应相关疾病的发病机制等研究提供新思路和方向。
综上所述,H2-Eb基因多态性可显著影响小鼠机体对于COXB3的易感性以及感染后的免疫反应水平,但仍需要大样本的实验研究和严格设计的生物学研究进一步证实。
