浓缩果汁中游离糖的组成分析
2019-08-27李开曾鸣宋昊王冬
李开,曾鸣,宋昊,王冬
(1.北京一轻研究院,北京 101111;2.北京市食品工业研究所,北京 100075)
糖类在植物体的结构和功能方面起着非常重要的作用,不仅是植物生长过程中的能量来源和物质基础,还是糖代谢和基因表达过程中通过糖感知系统调节酶促反应的信号[1-2]。糖类是食品中的主要营养物质,同时对食品的风味、甜味、质构和稳定性有一定的影响,其种类和含量直接影响食品的营养价值。最近几年,我国果汁饮料加工业发展迅速,已经成为了全球最大的浓缩果汁生产国和出口国,浓缩果汁的品质控制显得尤其重要。糖类是浓缩果汁的主要成分,糖类的组成成分影响着浓缩果汁的甜味,同时糖类也是浓缩果汁中可溶性固形物的重要组成[3],所以监测浓缩果汁中糖类的组成对产品质量的控制有着重要意义。
目前国内外对糖含量的分析方法包括化学法和仪器分析法,化学法有直接滴定法、高锰酸钾滴定法、铁氰化钾法、奥氏试剂滴定法测定食品中的还原糖[4]和总糖,虽然化学法相对便宜、准确度高,但是耗时长、效率低、无法准确定性糖的种类。仪器分析法包括分光光度法[5]、毛细管电泳法(capillary electroph-oresis,CE)[6-7]和色谱法,分光光度法和化学法一样不能确定糖的种类;糖类既不带电,也没有紫外吸收和荧光特性,使用CE 检测糖类化合物需要让糖带电或者衍生化,技术要求较高,操作耗时长,结果重现性较差;色谱法种类较多,主要有离子交换色谱法[8-9](ion exchange chromatography,IEC)、气相色谱法[10-11](gas chromatography,GC)和高效液相色谱法[12-14](high performance liquid chromatography,HPLC),IEC 灵敏度高,但是糖类在电极表面发生氧化还原反应会导致稳定性不够好,另外设备昂贵;糖类化合物沸点高、难挥发、难气化和热稳定差,不能直接用GC 进行分析,需要对样品进行衍生化处理、需用有毒试剂、操作比较复杂、稳定性差[15];相比之下,HPLC 具有简便、准确、样品前处理容易等优势,因此成为了食品中糖分离鉴定、定量分析的主要手段。由于糖类在紫外可见光区无吸收以及无荧光特性,将二极管阵列检测器(diode array detector,DAD)和荧光检测器(fluorescence detector,FLD)应用于糖类的检测需要将糖进行衍生化处理[16-17],这就使分析流程变得复杂,降低了其通用性;相比其他检测器,蒸发光散射检测器(evaporative light-scattering detector,ELSD)和示差折光检测器(differential refraction detector,RID)在糖类的分析中应用得最广[18],虽然ELSD 相对于RID 灵敏度更高、基线更稳定,但是ELSD 更昂贵、操作更复杂,所以在满足定性定量的基本前提下,日常生产过程中糖的检测分析使用RID 更具优势。
本文采用HPLC-RID,建立了快速、准确地分离分析木糖、果糖、葡萄糖、蔗糖、麦芽糖和乳糖的方法,为浓缩果汁中游离糖的检测、监管提供技术支撑。
1 材料与方法
1.1 仪器、试剂与材料
配备 G1311C 泵、G1329B 进样器、G1316A 柱温箱和G1362A 示差折光检测器的1260 高效液相色谱系统:安捷伦科技有限公司;HF-2000R 高速离心机:上海利鑫坚离心机有限公司;HC-C18萃取小柱(4.6 mm×12.5 mm,5 μm):上海安谱实验科技股份有限公司。
浓缩桔汁、浓缩橙汁:南充佳美食品工业有限公司;浓缩苹果汁:天水长城果汁集团有限公司;乙腈(色谱纯):上海安谱实验科技股份有限公司;木糖、果糖、葡萄糖、蔗糖、麦芽糖、乳糖(含量≥99%):Sigma-Aldrich LLC.;超纯水(电阻率为 18.2 MΩ·cm)。
1.2 方法
1.2.1 色谱条件
色谱柱为Agilent ZORBAX Carbohydrate Analysis Column(4.6 mm×150 mm,5 μm);流动相为 75 ∶25 的乙腈-水;流速为 1.3 mL/min;柱温为 35 ℃;RID 温度为 35 ℃;进样量为 5 μL。
1.2.2 样品前处理
称取样品2 g~5 g,用超纯水溶解,定容至50 mL,然后10 000 r/min 离心20 min,取上清液备用。为了除去样品中可能影响到目标物分析的诸如有机酸、色素等杂质,本文将样品溶液经过C18萃取小柱进行净化处理,首先将C18萃取小柱先用2 mL 甲醇活化,然后用2 mL 超纯水冲洗以去除甲醇,取5 mL 离心后的上清液至萃取小柱,弃去开始的2 mL 流分,收集后续溶液,用孔径为0.45 μm 的滤膜过滤,滤液待分析。
2 结果与分析
2.1 标准物质色谱峰的确定
按照1.2.1 的色谱条件,测定6 种糖的混合标准溶液,得到如图1所示的色谱图,然后分别测定每种糖的标准溶液,确定每种糖的保留时间,最终得到各组分的出峰顺序为木糖、果糖、葡萄糖、蔗糖、麦芽糖、乳糖。
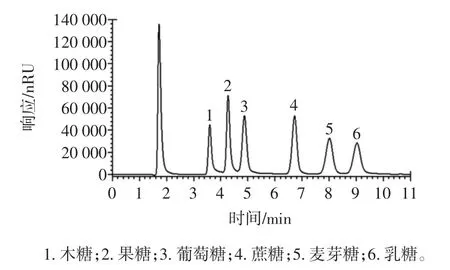
图1 糖标准品的色谱图Fig.1 HPLC chromatogram of the sugar standards
2.2 色谱条件的优化
2.2.1 流动相比例的选择
改变流动相乙腈和水的比例,其他条件不变(流速为1.0 mL/min,为了保持RID 状态稳定,柱温与RID温度一致为 30 ℃)。分别考察在乙腈/水为 70 ∶30、75 ∶25、80 ∶20 时对6 种糖的分离效果的影响,得到的色谱图如图2所示。
随着乙腈的浓度增大,分离度逐渐增大,但是保留时间也逐渐增大,峰宽逐渐加大;流动相比例为70 ∶30 时,果糖和葡萄糖没有完全分离,峰形较差,随着乙腈比例的增大,分离效果变好,75 ∶25 时完全分离,并且峰形都较好,如果继续增大乙腈的比例,峰的展宽加重且分离时间变长。综合分离时间与分离度,选择75 ∶25 为流动相比例。
2.2.2 测试温度的选择
柱温是色谱分析的一个重要参数,直接影响化合物的分离度和分析速度。为了考察柱温对分离6 种糖的影响,保持流动相比例(乙腈∶水=75 ∶25)、流速(1.0 mL/min)不变,控制分析温度为 25、30、35、40 ℃,分离结果如图3所示。

图2 不同流动相比例时糖标准溶液的色谱图Fig.2 HPLC chromatograms of the sugar standards in different volume ratios of the mobile phases
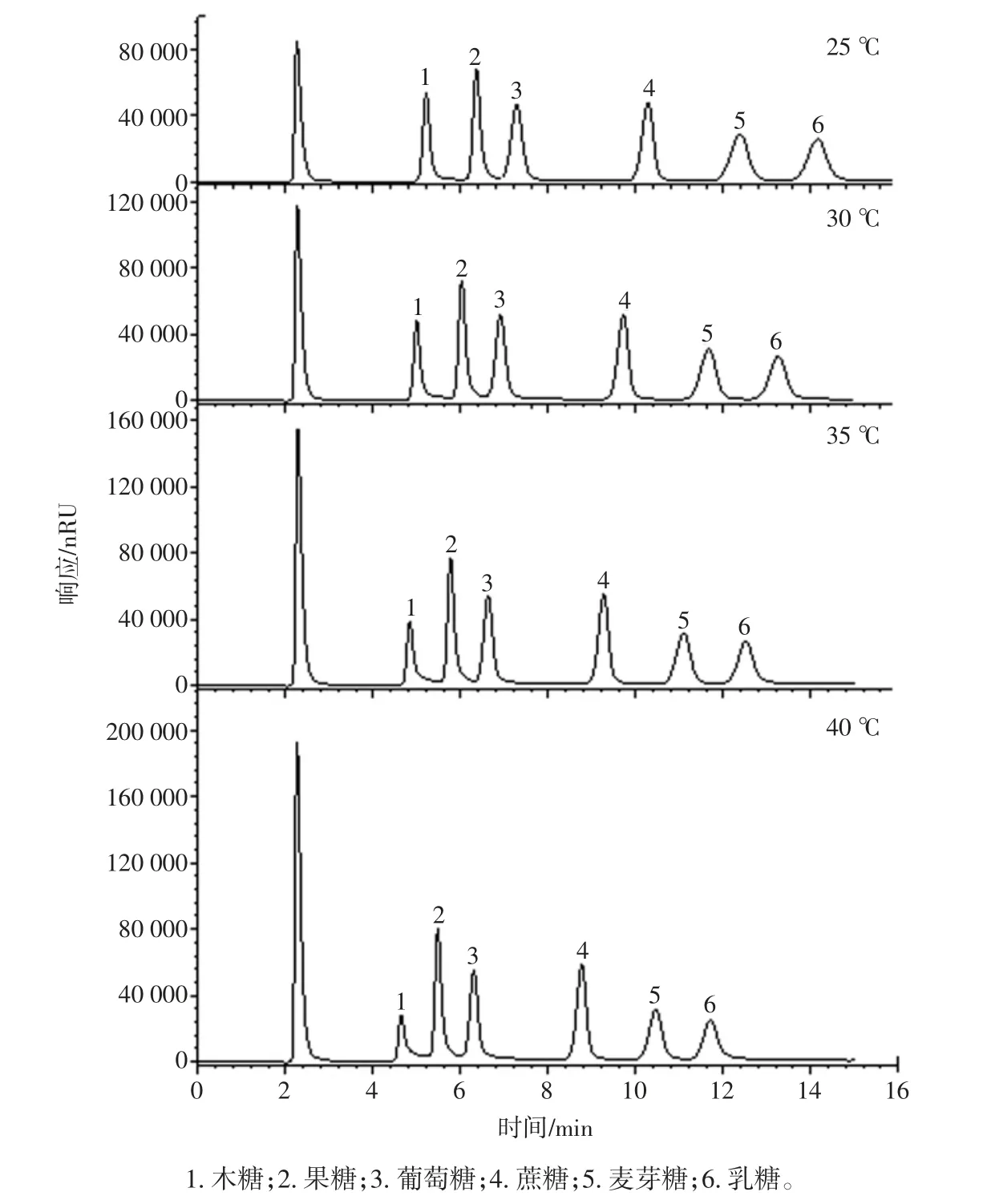
图3 不同分析温度时糖标准溶液的色谱图Fig.3 HPLC chromatograms of the sugar standards analyzed in different temperatures
随着温度的升高,各化合物的保留时间逐渐变短,但是分离度和保留时间变化都不是太明显,综合考虑选择35 ℃为分析温度。
2.2.3 流速的选择
根据van Deemter 速率理论方程式H=A+B/u+Cu(A、B、C 为常数,H 为理论塔板高度,u 为流动相线速度),在一定范围内,随着流速的降低,H 降低、柱效升高、分离度变大,但是流速过低时,分析时间变长、柱效反而降低;提高流速可以缩短分离时间,但是流速过高时,待分析化合物来不及分离就被洗脱出,柱效就会降低,分离效果变差。保持流动相比例(乙腈∶水=75 ∶25)、温度(35 ℃)不变,考察流速为 1.0、1.3、1.5 mL/min 时6 种糖的分离情况,如图4所示。

图4 不同流速时糖标准溶液的色谱图Fig.4 HPLC chromatograms of the sugar standards analyzed on different flow rates of the mobile phase
在3 种流速下,6 种糖的分离效果都较好,随着流速的升高,分析时间显著缩短。另外,流速升高增大,柱压会随之升高,会影响色谱柱寿命,从1.3 mL/min 到1.5 mL/min 分析时间差别较小,所以最终确定1.3 mL/min为流动相速度。
2.3 样品前处理
浓缩果汁的组成非常复杂,含有糖类、色素、酚类和有机酸类等化合物,色素、酚类和有机酸类化合物的疏水性比糖类化合物强,容易吸附在色谱柱上不被洗脱,长期这样会降低色谱柱的柱效,缩短色谱柱的寿命,所以正式分析前应对样品进行净化处理。HCC18萃取小柱的填料具有较高的疏水性,糖类化合物在柱子上很难保留,而色素等干扰物质相较于待测化合物的疏水性强、在柱子上保留强,从而可以净化样品溶液。浓缩苹果汁样品净化前后的对比效果见图5,经固相萃取后色素去除完全,待测化合物的峰形、峰面积没有影响,柱压明显降低,说明该方法能简单快速净化果汁待测样品。

图5 样品处理前后的效果Fig.5 The results before and after treatment of samples
2.4 方法的验证
配制6 种糖的一系列浓度标准溶液,按照优化过的分析条件进样测试,同一浓度分析3 次,对峰面积(y)和浓度(x)进行拟合,得到6 种糖的线性方程和相关性系数(如表1所示),线性范围较宽,R2>0.999 0。

表1 方法的线性方程Table 1 Linear equations of six sugars
为了研究方法的重现性,按优化后的色谱条件,将6 mg/mL 的标准溶液连续进样6 次,分别计算每种化合物保留时间(tR)和峰面积的相对标准偏差(relative standard deviation,RSD),结果见表2,tR的 RSD 为0.05%~0.07%,峰面积的RSD 为0.77%~4.54%;另外,为了研究方法的稳定性,连续6 d 对6 mg/mL 的混合标准溶液测试,分别计算每种化合物的tR和峰面积的 RSD,结果见表2,tR的 RSD 为 0.41%~1.75%,峰面积的RSD 为1.39%~2.99%。以上结果说明方法重现性良好并具有较好的稳定性,这可能是由于糖溶液比较稳定、在不同日期检测其含量波动较小[19]。
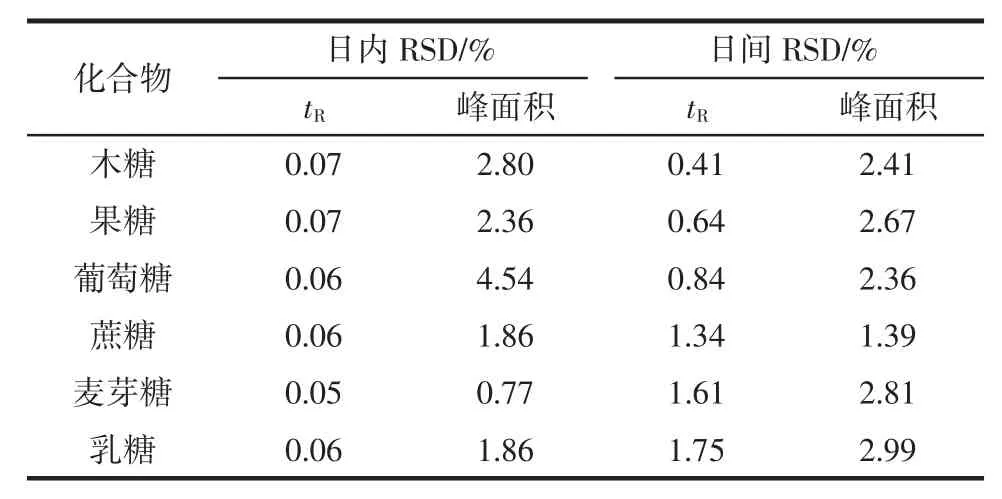
表2 精密度试验结果(n=6)Table 2 Results of the precision experiments(n=6)
为了检验方法的准确度,以浓缩苹果汁为基质进行加标回收试验,向浓缩苹果汁中加入24.575 mg/g 和48.750 mg/g 的混合标样,然后根据优化后的条件进行测试,平行分析3 次,结果见表3。
6 种糖的回收率在87.20%~105.22%,证明该方法准确性较好。通过以上线性范围、精密度和回收率结果可知,该方法准确可靠,能满足浓缩果汁中糖类定性定量分析的要求,可以用于浓缩果汁品质的控制。
2.5 实际样品测定
采用优化后的条件对3 种浓缩果汁进行分析,根据保留时间对样品的色谱峰进行定性,色谱图见图6。测定结果见表4,浓缩苹果汁、浓缩桔汁和浓缩橙汁中都只检出果糖、葡萄糖和蔗糖。其中,浓缩苹果汁中,果糖含量>葡萄糖含量>蔗糖含量;而浓缩桔汁和浓缩橙汁中蔗糖含量>果糖含量>葡萄糖含量,柑橘汁中葡萄糖与果糖的含量比值基本上保持在0.85 与1 之间,这个指标可以作为识别浓缩柑橘汁的真伪[3,20],本文中被测浓缩桔汁和浓缩橙汁这个指标分别为0.95 和0.90。
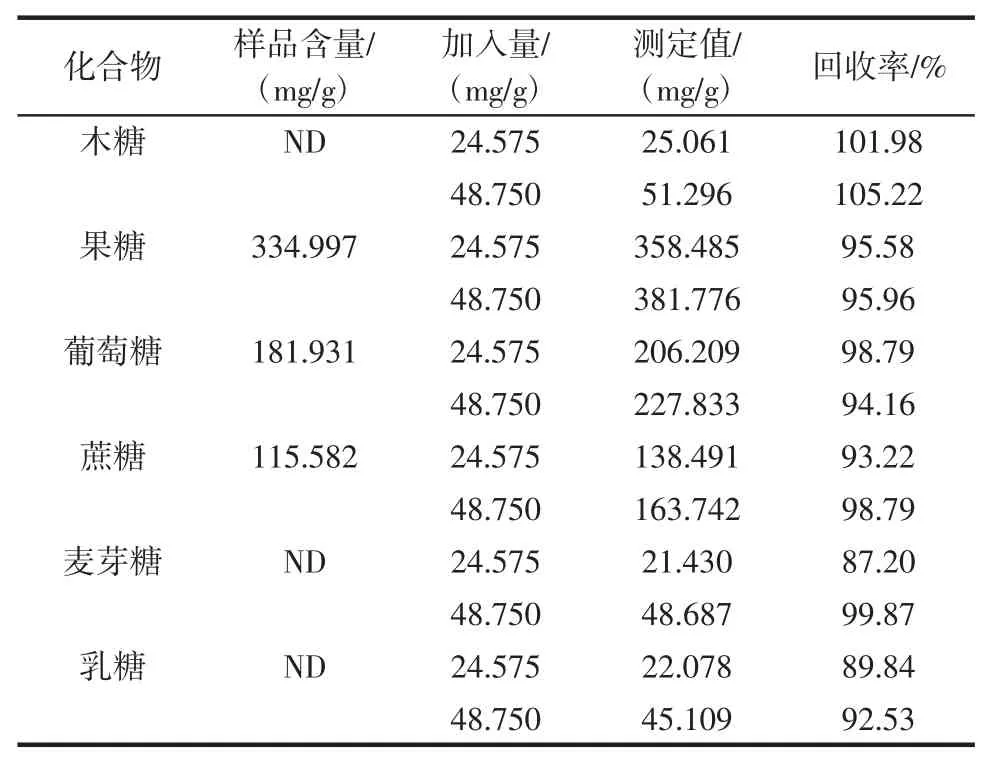
表3 浓缩苹果汁中糖的加标回收率(n=3)Table 3 Spiked recoveries of the six sugars in the concentrated apple juice(n=3)

图6 浓缩果汁的液相色谱图Fig.6 HPLC chromatograms of the concentrated juices

表4 3 种浓缩果汁中糖含量的测定结果(n=3)Table 4 Contents of sugars in three concentrated juices(n=3)
3 结论
本文建立了HPLC-RID 同时分离分析木糖、果糖、葡萄糖、蔗糖、麦芽糖和乳糖的方法,同时将该方法应用到了浓缩果汁中游离糖的组分分析中。结果表明,本方法前处理简单,具有较宽的线性范围,精密度、准确度和稳定性良好,结果可靠,对浓缩果汁生产加工品质监控以及浓缩果汁原料真伪鉴别具有重要的应用价值。
