乙醇熏蒸对红薯尖冷藏期间品质的影响
2019-08-26肖婷陈东秀罗鸿匡世瑶张敏
肖婷,陈东秀,罗鸿,匡世瑶,张敏*
1(西南大学 食品科学学院,重庆,400715) 2(食品科学与工程国家级实验教学示范中心(西南大学),重庆,400715) 3(农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆,400715)
红薯尖(sweet potato leaves)是红苕秧茎顶端及嫩叶,又称红薯叶、地瓜叶,是一种有机蔬菜,翠绿鲜嫩、味美爽口,红薯尖还具有保健功能,其富含的黄酮类化合物可抗炎防癌、抵抗氧化、延缓衰老。因此,红薯尖被誉为“蔬菜皇后”、“长寿蔬菜”及“抗癌蔬菜”。但红薯尖采摘后容易失水萎蔫、黄化褪绿、褐变、腐烂变质,常温下寿命只有2~3 d[1],这对薯尖的销售及食用品质极为不利。
乙醇熏蒸作为一种安全无毒、化学污染小的保鲜技术,可以降低果蔬生理代谢速度[2],减少果蔬营养物质消耗[3],保持高质量的果蔬品质[4]。SUZUKI等[5]用乙醇蒸汽处理西兰花,结果显示乙醇蒸汽量为7.2 g时能有效抑制乙烯的产生,维持较高的叶绿素含量,有效延长西兰花保鲜期。李勃等[6]的研究发现,用12 g酒精缓释剂处理青花菜能够最有效地控制失重率,延缓黄化速度。邢皓[7]研究了乙醇熏蒸对荷兰豆采后贮藏品质的影响,结果表明200 μL/L乙醇处理可降低腐烂发生,保持较高的好果率。RITENOUR等[8]将蜜瓜和甜瓜暴露在乙醇蒸汽中,结果表明6 mL/kg的乙醇可以保持甜瓜和蜜瓜较高的硬度,延迟软化,发挥良好的保鲜效果。目前,有关红薯尖采后贮藏及物流过程中的保鲜研究极少,更未见乙醇熏蒸处理对红薯尖的保鲜研究的报道。本试验以红薯尖为材料,对其进行乙醇熏蒸处理,研究不同浓度乙醇对红薯尖保鲜品质的影响,为解决红薯尖采后贮藏及物流过程中的保鲜问题提供科学依据。
1 材料与方法
1.1 材料与试剂
新鲜红薯尖购于重庆市北碚菜市场,该批薯尖于下午5点左右采摘,4 h内到达实验室,为防止叶片失水萎蔫,在叶片上均匀洒水,次日早7点进行乙醇熏蒸处理。薯尖的拣选标准为:色泽鲜绿饱满,叶边平整硬挺,无明显病虫害和机械损伤。
PE包装袋,35 cm×50 cm×8丝,石家庄诚胜塑业;丙酮、冰醋酸、无水醋酸钠、聚乙烯吡咯烷酮、曲拉通X—100、邻苯二酚、30%过氧化氢、二硫代苏糖醇、L-蛋氨酸、核黄素、乙二胺四乙酸二钠、氮蓝四唑、三氯乙酸、硫代巴比妥酸,成都市科龙化工试剂厂;无水乙醇(分析纯),重庆北碚化学试剂厂;聚乙二醇6 000、愈创木酚、氢氧化钠,重庆川东化工试剂公司。
1.2 仪器与设备
UV-2450PC型紫外可见分光光度计,日本岛津公司;DDS-307A型电导率仪,上海雷磁公司;Pac Check®Model 650EC型顶空分析仪,美国MOCON公司;HWS型低温恒温恒湿箱,宁波东南仪器有限公司;H1650R型台式高速冷冻离心机,湖南湘仪公司。
1.3 试验方法
选取色泽鲜绿、叶边无卷曲、大小一致、无病虫害和机械损伤的红薯尖进行处理。以泡沫箱为熏蒸单元,每箱放入挑选好的薯尖350 g(薯尖量不宜过多,以免影响箱内可利用空间体积),箱盖内部中央粘有4层叠放的纱布,分别取一定体积的95%乙醇均匀滴在纱布上,迅速封箱(动作尽量轻,防止液体滴落),于室温(25 ℃左右)下熏蒸3 h。试验中乙醇熏蒸浓度分别为20、50、100 μL/L,如式(1)所示。

(1)
另设对照组,共4组。熏蒸结束后开箱通风1 h,最后将红薯尖装入PE袋,每袋(100±5)g,每组3个平行,每个平行6袋。PE袋封口放入4 ℃左右、RH 90%~95%的恒温恒湿箱中贮藏18 d,每3 d测定1次指标。
1.4 测定指标及方法
1.4.1 呼吸强度
静置法测定[9]。用顶空气体分析仪测定大气中的CO2含量,记为初始体积分数Ψ1,每个平行随机称取薯尖100 g,放入真空干燥皿,封盖,25 ℃静置1 h,测量最终CO2体积分数Ψ2。重复3次。薯尖呼吸强度根据(2)计算:

(2)
式中:Ψ2,薯尖在干燥皿中呼吸1 h后的CO2体积分数,%;Ψ1,大气中的初始CO2体积分数,%;V,干燥皿中密闭空间体积(排水法测定),mL;1.96,CO2摩尔质量与摩尔体积之比(=44/22.4,绝对零度);m,薯尖质量,kg;t,静置时间,h。
1.4.2 腐烂指数
红薯尖腐烂的判断依据为薯尖表面出现水渍状腐烂斑点。参照蔡佳昂等[10]的方法,根据薯尖表面出现腐烂斑点的数量可划分为4个级别标准:0级,无腐烂斑点;1级,有1~5个小面积腐烂斑点;2级,有5~10个小面积腐烂斑点;3级,腐烂斑点个数>10。红薯尖的腐烂指数采用(3)式进行计算:

(3)
1.4.3 电导率
参照程曦[11]的方法。
1.4.4 丙二醛(malondiadehyde, MDA)含量
参照MOSTAGHIMI等[12]的方法且稍作修改。称取1.0 g样品,置于研钵中,加入5 mL 100 g/L TCA溶液,室温(25 ℃)研磨匀浆后,于4 ℃、10 000 r/min离心20 min,收集上清液,低温保存备用。取2 mL上清液(对照空白管以100 g/L TCA溶液2 mL代替提取液),加入2 mL 0.67% TBA,混合后在沸水浴中煮沸20 min,取出冷却再离心20 min。分别测定上清液在450、532、600 nm处的吸光度。重复3次。
1.4.5 多酚氧化酶(polyphenol oxidase, PPO)活性
参照曹建康等[13]方法测定,稍加改动。称取1.0 g薯尖叶片(避开粗脉取样),置于研钵中,加入5 mL提取缓冲液(1 mmol PEG、4% PVPP和1% Triton X-100),在冰浴条件下研磨成浆,于4 ℃、12 000 r/min离心30 min,收集上清液即为酶提取液,于4 ℃低温保存备用。往试管中加入4.0 mL 0.05 mol/L磷酸缓冲液(pH 6.8)、1.0 mL 50 mmol/L邻苯二酚溶液、100 μL酶提取液。以蒸馏水为参比,记反应体系在波长420 nm处吸光度,测定120 s,制作OD420值随时间变化曲线。重复3次。
1.4.6 超氧化物歧化酶(superoxide dismutase, SOD)活性
酶液提取时提取缓冲液含5 mmol/L DTT、5% PVP和pH 7.5磷酸钠缓冲液,其他步骤同PPO。测定方法:取5支试管,分别加入1.7 mL 50 mmol/L pH 7.8磷酸缓冲液、0.3 mL 130 mmol/LL-蛋氨酸、0.3 mL 750 μmol/L氮蓝四唑溶液、0.3 mL 100 μmol/L EDTA-Na2溶液,最后加入0.3 mL 20 μmol/L核黄素溶液和0.1 mL酶提取液(2支对照管中以50 mmol/L pH 7.8磷酸缓冲液代替)。混匀后将1支对照管置于暗处,其他各管置于30 W日光灯下反应30 min后立即取出,并放于暗处终止反应。以暗处光管为参比调零,于560 nm波长处测其他各管吸光度。重复3次。
1.4.7 过氧化氢酶(catalase, CAT)活性
酶液提取时提取缓冲液含5 mmol/L DTT、5% PVP和pH 7.8磷酸钠缓冲液,其他步骤同PPO。测定方法:向试管中加入20 mmol/L H2O2溶液2.9 mL和酶提取液50 μL。以蒸馏水为参比,在波长240 nm处测吸光度,测定180 s,制作OD240值随时间变化曲线。重复3次。
1.4.8 过氧化物酶(peroxidase, POD)活性
酶液提取方法同PPO。测定方法:往试管中加入3 ml 25 mmol/L愈创木酚溶液、25 μL酶提取液和200 μL 0.5 mol/L H2O2。以蒸馏水为参比,记反应体系在波长470 nm处吸光度,测定80 s,制作OD470值随时间变化曲线。重复3次。
1.4.9 叶绿素含量
参照YANG等[14]测定叶片的方法,用分光光度计测定。用打浆机将薯尖叶片(避开粗脉)打成细小均匀的碎片,称取1.0 g置于100 mL三角瓶中。加入20 mL乙醇与丙酮混合液(比例1:1,现配现用),保鲜膜封口并用橡皮筋固定,放置于暗处反应24 h后过滤。以乙醇与丙酮混合液为空白参比调零,用1 cm光径比色皿测定645、663 nm处吸光度,并计算叶绿素含量。重复3次。
1.4.10 感官评分
参照张学杰等[15]方法,稍作改动。感官评定小组由经过专门训练的5人组成,分别从薯尖的颜色、质地、形态、气味和水渍5个方面进行评分,加权平均,每项的加权系数均为0.2,满分为5分。表1为评分标准。

表1 红薯尖感官评分标准
1.5 数据处理
采用Microsoft Excel 2010进行数据处理,用SPSS 22进行统计分析,使用最低显著性差异法(LSD)进行显著性差异检验,显著性水平为0.05,制图使用Origin 8.6软件。
2 结果与分析
2.1 乙醇熏蒸对红薯尖呼吸强度的影响
如图1所示,薯尖经乙醇处理后呼吸强度呈先上升后下降的趋势。前3 d,乙醇处理组的呼吸强度较低。从第 6天起100 μL/L组均高于CK组,可能原因是乙醇浓度太高,熏蒸时大量渗入细胞,使乙醇在薯尖体内过量积累,贮藏期间逐渐削弱薯尖抵抗力[16],加快腐烂进程,导致呼吸强度升高,这与张洪翠等[17]发现600 μL/L乙醇熏蒸会使双孢蘑菇呼吸强度升高的结果一致。前9 d,20、50 μL/L处理组与CK组具有极显著差异(P<0.01)。CK组和100 μL/L处理组均在第9天达到峰值;20 μL/L和50 μL/L处理组均在第9天后出现呼吸高峰,峰值也低于前2组,说明适宜浓度的乙醇可以延缓薯尖呼吸高峰出现的时间并降低峰值。生物体呼吸作用会产生活性氧,活性氧随着呼吸代谢的加强蓄积在细胞中,可攻击细胞生物膜,与生物体内的核酸、蛋白质和脂质等发生反应损害生物体机能[18-19]。乙醇熏蒸通过降低呼吸作用,减少活性氧自由基的产生,减小了生物体损伤。另有研究表明乙醇处理可以抑制双孢蘑菇[17]、茎瘤芥[20]和西兰花[21]的呼吸强度。
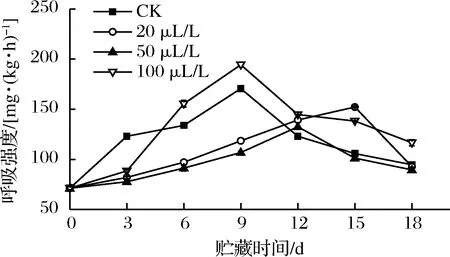
图1 乙醇熏蒸对红薯尖呼吸强度的影响
Fig.1 Effects of ethanol fumigation on respiratory intensity of sweet potato leaves
2.2 乙醇熏蒸对红薯尖腐烂指数的影响
薯尖水分多、组织脆嫩,招致微生物侵害引起叶片腐烂,薯尖的生理机能易被破坏[22]。由图2可知,在整个贮藏期间,薯尖的腐烂指数呈上升趋势。第3天,CK组已出现小面积腐烂斑点,乙醇处理组均无明显腐烂现象,3个处理组腐烂指数分别为0.53%、0.31%、0.62%,三组间差异尚不显著(P>0.05)。6 d后薯尖腐烂速率加快,50 μL/L组显著(P<0.05)低于20 μL/L组,极显著(P<0.01)低于CK组和100 μL/L组。18 d时,4组的腐烂指数依次为35.1%、21.3%、10.4%、39.5%。由此可见,50 μL/L乙醇熏蒸在延缓薯尖腐烂上效果最佳。程曦等[11]研究发现无氧呼吸会加速腐烂,因此适宜浓度的乙醇熏蒸可以通过减弱呼吸作用,延迟无氧呼吸,从而减慢腐烂速率。
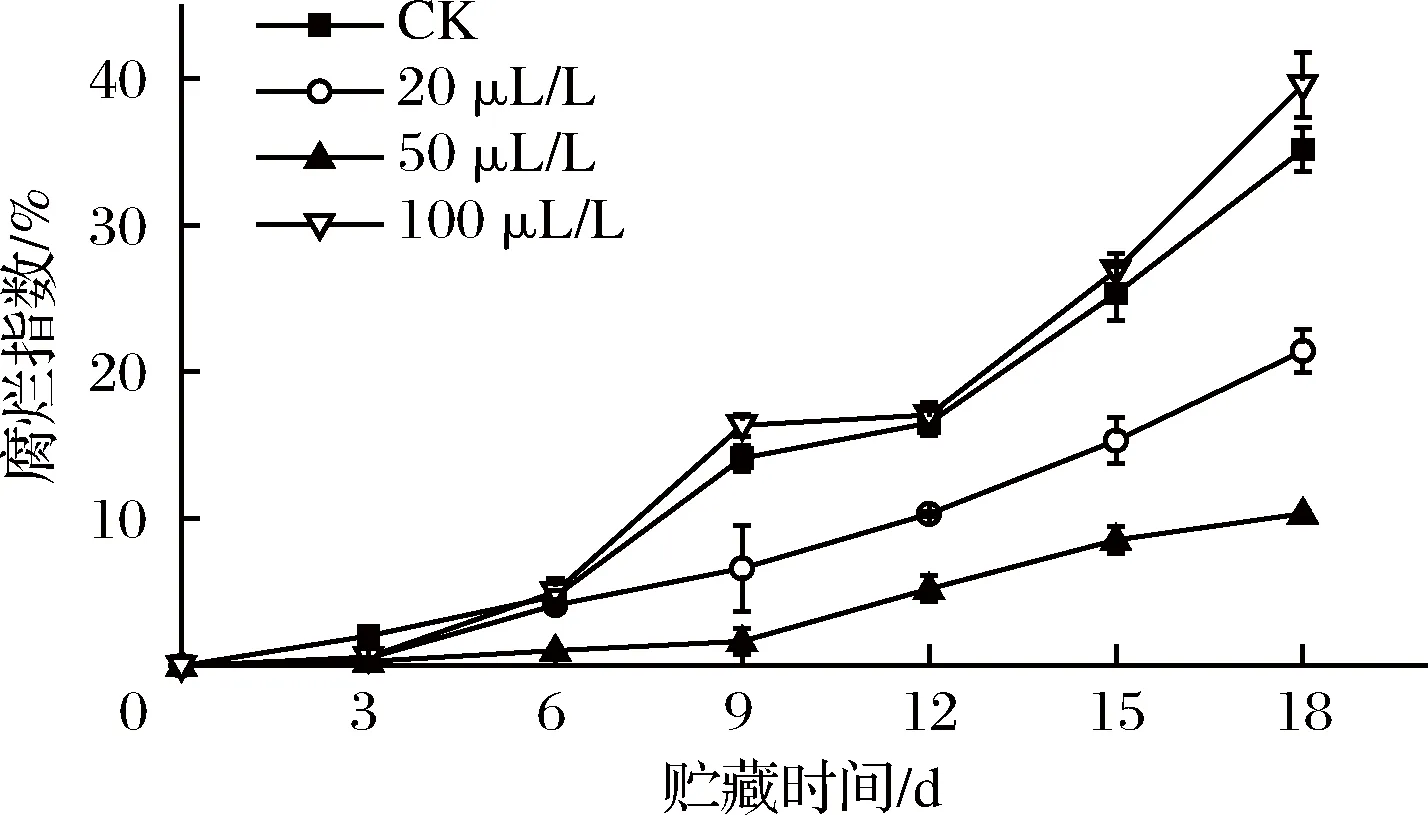
图2 乙醇熏蒸对红薯尖腐烂指数的影响
Fig.2 Effects of ethanol fumigation on decay index of sweet potato leaves
2.3 乙醇熏蒸对红薯尖相对电导率的影响
贮藏期间,各处理组电导率呈上升趋势。前9 d,50 μL/L组与CK组之间差异并不显著(P>0.05);12~18 d,50 μL/L组电导率显著(P<0.05)低于CK组。第15天,100 μL/L组电导率显著(P<0.05)高于其他3组。贮藏结束时,100 μL/L组的电导率最大,表明此时100 μL/L组薯尖细胞受损伤最大,难以维持细胞的完整性,这可能与乙醇浓度过高加快细胞原生质膜破裂,使离子泄露增加相关[23]。如图3所示,50 μL/L组的电导率始终低于其他3组,20 μL/L组在贮藏后期仍然能减缓电解质渗出,因此20和50 μL/L组均能够有效维持薯尖细胞完整性。李江阔等[24]研究发现,处于厌氧状态时间过长的果实,细胞膜透性上升迅速,而乙醇熏蒸能够推延薯尖的无氧呼吸,减缓膜透性上升,从而更好地维持细胞膜的完整程度。
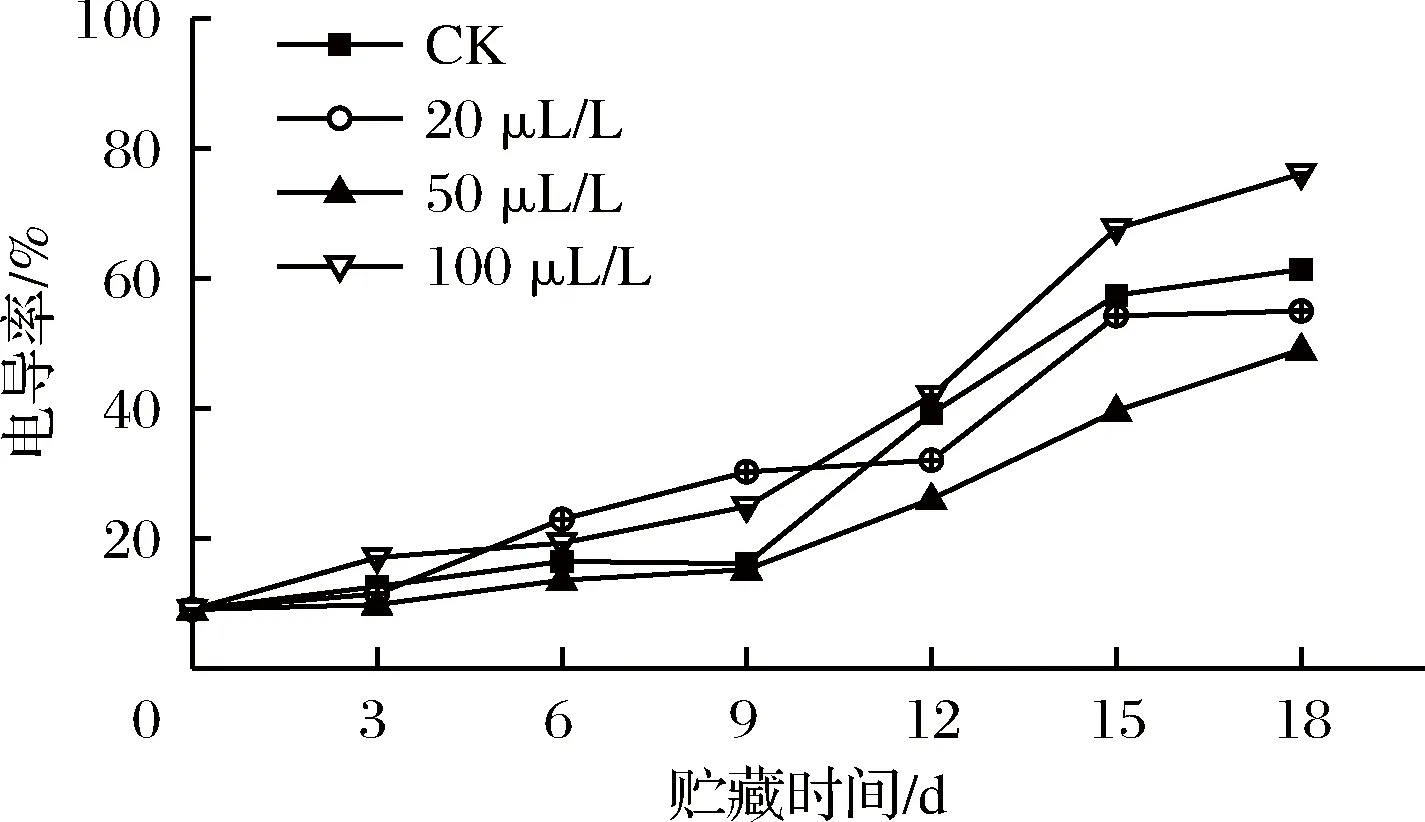
图3 乙醇熏蒸对红薯尖相对电导率的影响
Fig.3 Effects of ethanol fumigation on relative conductivity of sweet potato leaves
2.4 乙醇熏蒸对红薯尖MDA含量的影响
MDA含量可作为膜损伤的直接指标[13]。由图4知,50 μL/L处理组在贮藏期间始终能够维持较低的MDA含量,20 μL/L组能够在贮藏前期和后期抑制MDA含量的上升,然而100 μL/L组在整个贮藏期间MDA含量始终高于其他3组,其中15~18 d显著(P<0.05)高于CK组和20 μL/L处理组,极显著(P<0.01)高于50 μL/L组,这可能是由于薯尖遭受了高浓度乙醇胁迫,细胞产生的自由基逐渐诱导不饱和脂肪酸过氧化,最终诱发了膜脂过氧化,使细胞膜受损伤程度严重[25]。有研究表明,膜脂过氧化产物会随SOD、CAT活性的下降而增加[26],因此乙醇可通过提高这2种酶的活性(见图6、图7)来抑制MDA含量的上升。
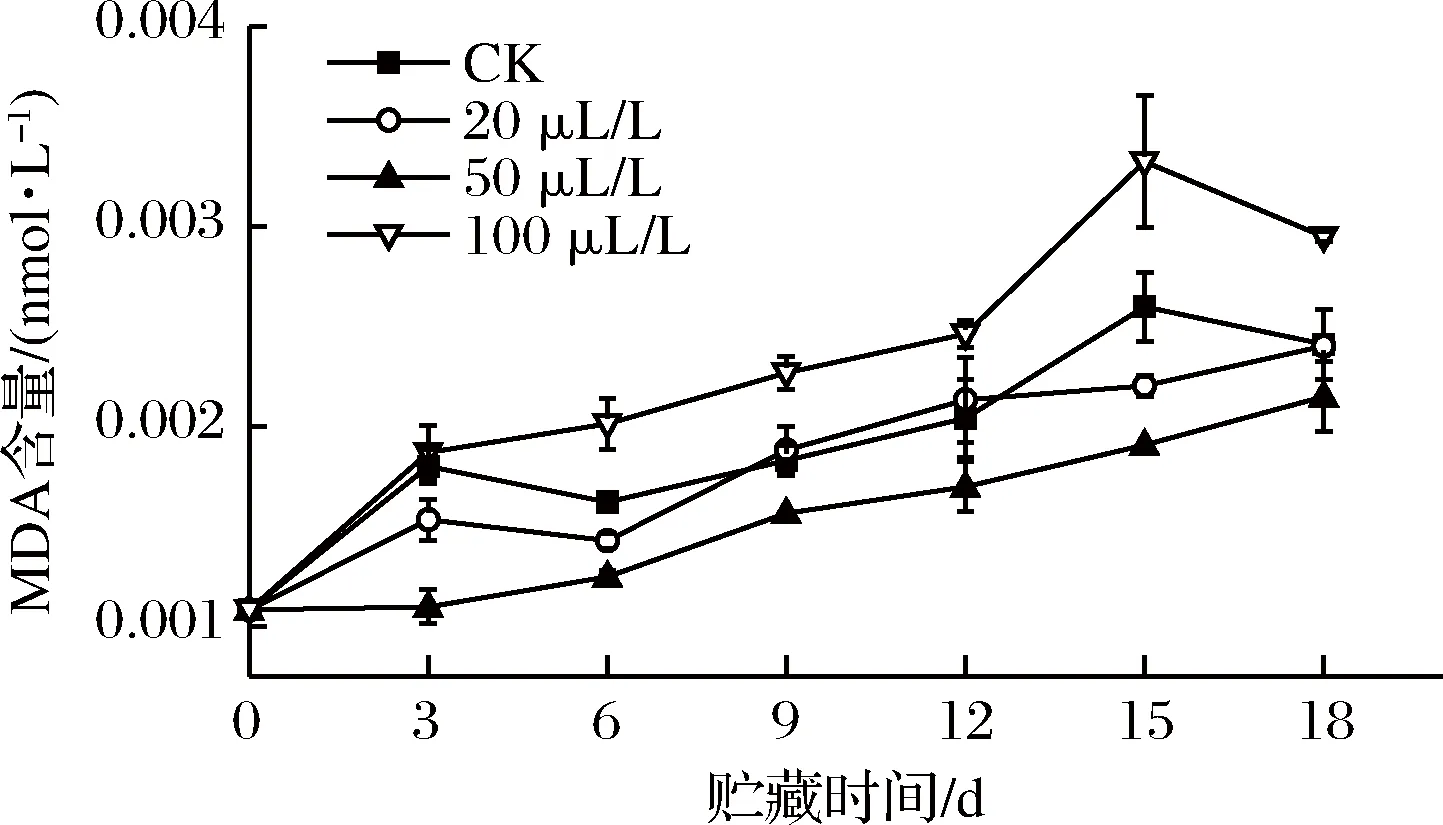
图4 乙醇熏蒸对红薯尖丙二醛含量的影响
Fig.4 Effects of ethanol fumigation on malondialdehyde content of sweet potato leaves
2.5 乙醇熏蒸对红薯尖PPO活性的影响
PPO是一种以铜为辅基的酶,能催化多种简单酚类物质氧化形成醌类,醌类化合物进一步聚合形成呈褐色、棕色或黑色的聚合物[13]。如图5,贮藏期间薯尖PPO活性整体呈上升趋势。

图5 乙醇熏蒸对红薯尖PPO活性的影响
Fig.5 Effects of ethanol fumigation on polyphenol oxidase of sweet potato leaves
0~3 d,薯尖PPO活性上升迅速,可能与薯尖应对机械损伤的生化过程相关,薯尖在损伤部位产生较多的酚类物质来抑制伤口病原菌侵染[27]。第6天,100 μL/L组PPO活性极显著(P<0.01)高于其他3组。第15天,CK组达PPO活性最大值0.45 U/g,显著(P<0.05)高于20、50和100 μL/L组,分别为0.22、0.24和0.29 U/g。贮藏结束时,50 μL/L组PPO活性最低,表明50 μL/L乙醇能较好地延缓PPO活性上升,抑制薯尖褐变。乙醇熏蒸通过诱导SOD、CAT的活性(见图6和图7),很好地防御了活性氧及其他过氧化物对细胞膜系统的毒害,降低了细胞膜的破坏程度,由此阻碍酚类和PPO的相互作用,减缓薯尖褐变。
2.6 乙醇熏蒸对红薯尖SOD活性的影响
SOD是含金属辅基的酶,是活性氧清除系统中首先发挥作用的抗氧化酶,通过防御活性氧或其他过氧化物自由基对细胞膜系统的伤害,以减轻自由基对有机体的毒害[13,28]。如图6所示,贮藏期间薯尖各处理组SOD活性达到高峰值后下降,BARTOLI等[29]推测这是一种复杂的、特异的抗氧化防御机制。贮藏前期和后期,100 μL/L组SOD活性不如CK组,且在第6天显著(P<0.05)低于其他3组。20、50 μL/L组在整个贮藏期间都能有效诱导SOD活性提高,其中50 μL/L组效果最佳。YA-RU等[30]研究表明0.1%乙醇熏蒸处理可诱导蓝莓果实SOD基因的表达,抑止亚细胞结构中活性氧积累。王中元等[31]用乙醇处理木薯,结果也发现处理组能维持较高SOD活性,更好清除细胞中的有害物质。
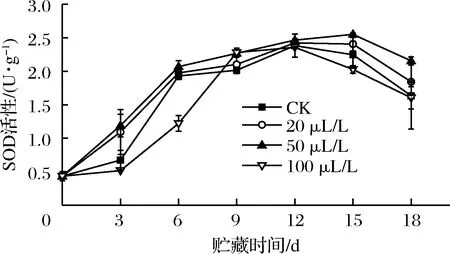
图6 乙醇熏蒸对红薯尖SOD活性的影响
Fig.6 Effects of ethanol fumigation on superoxide dismutase of sweet potato leaves
2.7 乙醇熏蒸对红薯尖CAT活性的影响
CAT是含铁的血红蛋白酶,它通过催化分解积累的H2O2,减少H2O2对果蔬组织可能造成的氧化伤害[13]。由图7知,各处理组CAT活性在贮藏前期呈下降趋势,可能是与薯尖采摘时受到机械损伤有关[32]。CAT是清除因伤胁迫产生的活性氧的主要酶,对伤胁迫有较强的调节作用[33],因此随着贮藏时间的延长,各处理组CAT活性回升。贮藏至12 d时,50 μL/L组CAT活性达17.67 U/g,显著(P<0.05)高于CK组(13.33 U/g)、20 μL/L组(13.51 U/g)、100 μL/L组(13.06 U/g)。贮藏后期,薯尖衰老导致CAT活性下降[34],100 μL/L组CAT活性低于CK组,20 μL/L组略高于CK组,50 μL/L组显著(P<0.05)高于CK组。可见,50 μL/L处理组能够在贮藏期间一直保持较高CAT活性,降低活性氧毒害。乙醇熏蒸通过诱导抗氧化酶CAT的活性来清除活性氧自由基,延缓采后薯尖衰老速度,这与韩俊华[35]用6 mL/kg乙醇处理西兰花得出的结论相似。

图7 乙醇熏蒸对红薯尖CAT活性的影响
Fig.7 Effects of ethanol fumigation on catalase of sweet potato leaves
2.8 乙醇熏蒸对红薯尖POD活性的影响

图8 乙醇熏蒸对红薯尖POD活性的影响
Fig.8 Effects of ethanol fumigation on peroxidase of sweet potato leaves
2.9 乙醇熏蒸对红薯尖叶绿素含量的影响
叶绿素含量是判断红薯尖是否保持鲜绿状态的重要指标。图9显示,薯尖叶绿素含量随着贮藏时间的延长呈下降趋势,20、50 μL/L组的叶绿素含量始终高于其余2组,且50 μL/L组延缓叶绿素降解效果最佳。第3天时,50 μL/L组的叶绿素含量为88.03 mg/100 g,极显著(P<0.01)高于CK组、20 和100 μL/L组,叶绿素含量分别为84.78、84.86 和79.65 mg/100 g。整个贮藏期间,20、50 μL/L组在第3天、第6天与100 μL/L组差异极显著(P<0.01),其他时间差异显著(P<0.05),可见乙醇浓度过高,加强呼吸代谢(见图1),加快叶绿素从绿色被降解成无色化合物[39]。王慧倩等[40]也得出高浓度乙醇处理鲜切西兰花会促进花蕾黄化的结论。
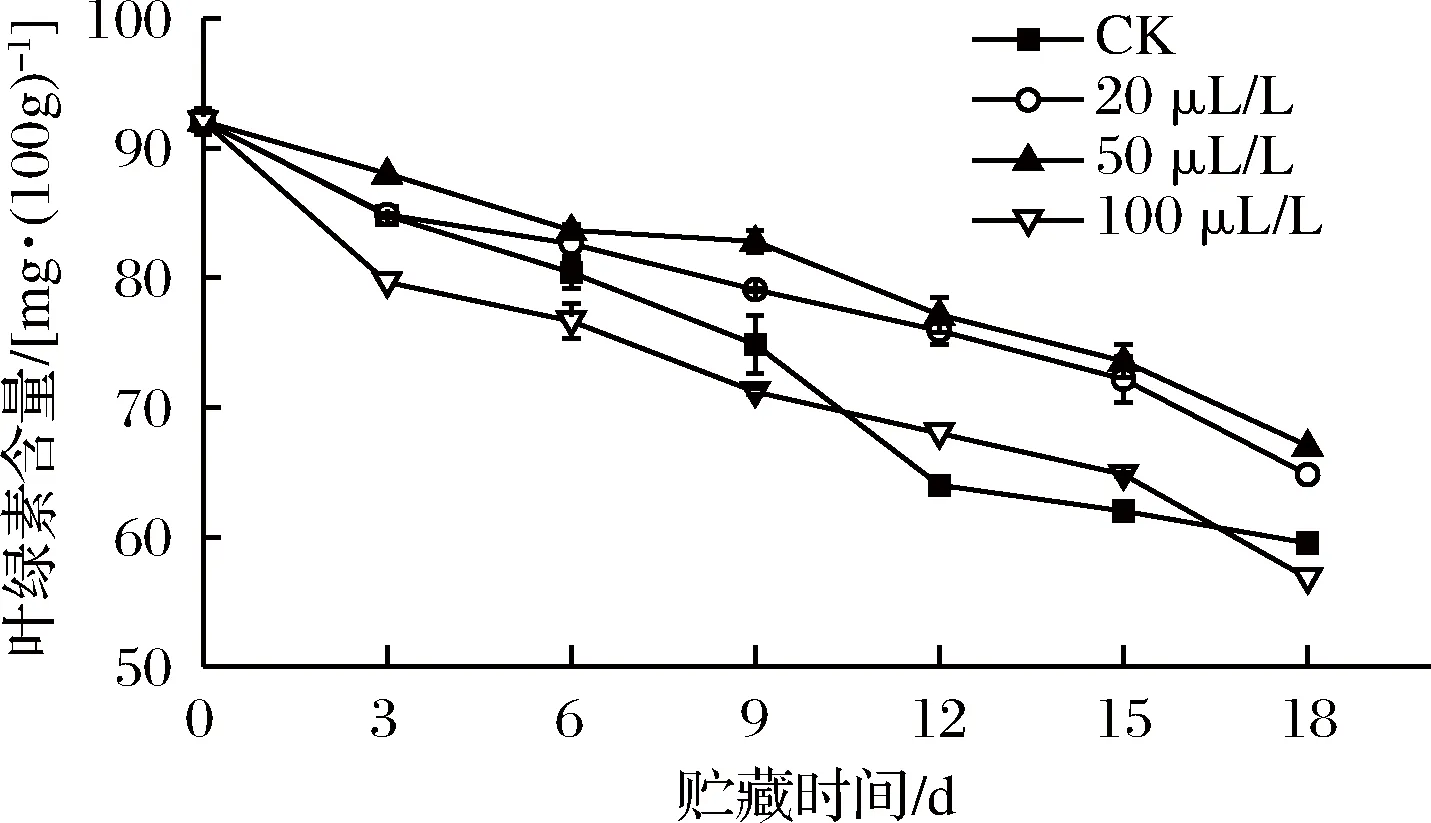
图9 乙醇熏蒸对红薯尖叶绿素含量的影响
Fig.9 Effects of ethanol fumigation on chlorophyll content of sweet potato leaves
2.10 乙醇熏蒸对红薯尖感官评分的影响
薯尖的感官品质从颜色、质地、形态、气味和水渍5个方面来进行评定。由图10可知,随着贮藏时间的延长,薯尖的感官品质逐渐下降。前6 d,薯尖品质下降平缓,各组之间未形成显著差异(P>0.05),20与50 μL/L组品质略好于其他2组。第9天,CK组表现为清香味明显变淡、软韧和萎蔫,100 μL/L组品质最差,另外2组均能维持4.5 分以上的感官评分。第9天后,CK组与100 μL/L组品质剧烈下降。12~18 d,CK、100 μL/L组与其他2组形成极显著(P<0.01)差异。在整个贮藏期间,100 μL/L组最快出现异味、软烂等不良现象。20、50 μL/L组均能保持较好的感官评分,50 μL/L组保鲜效果最佳。
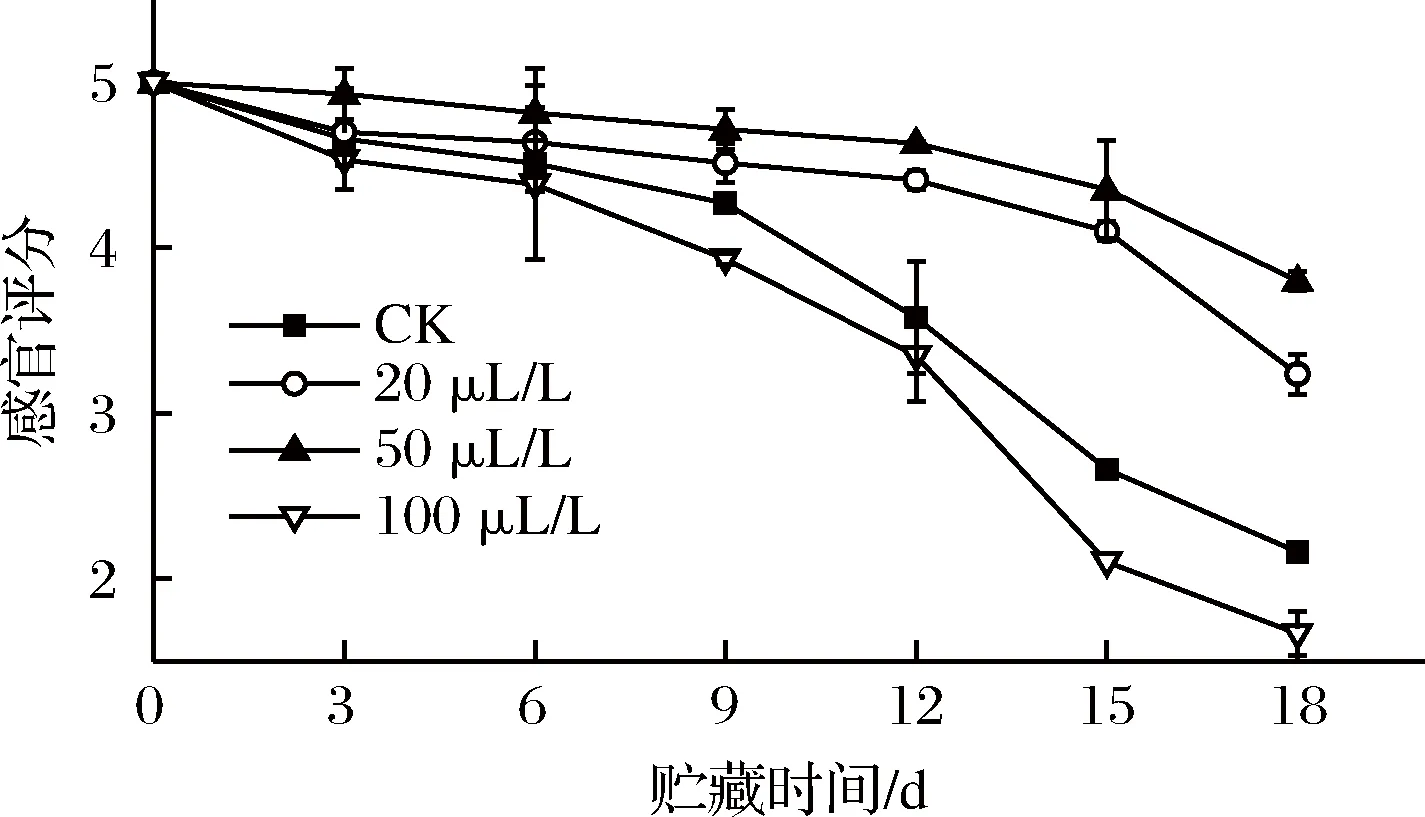
图10 乙醇熏蒸对红薯尖感官评分的影响
Fig.10 Effects of ethanol fumigation on sensory evaluation of sweet potato leaves
3 结论与讨论
本试验探究了不同浓度(20、50、100 μL/L)的乙醇熏蒸对红薯尖在冷藏期间品质的影响,结果表明,乙醇熏蒸从控制采后生理变化、维持活性氧代谢平衡及降低细胞膜损伤等方面抑制薯尖的品质劣变。
果蔬采后的生理生化变化有衰老、失绿黄化、褐变、病菌感染、腐烂等。乙醇可抑制乙烯合成相关酶的活性,减少乙烯生成,从而削弱乙烯导致的呼吸强度的变化[41]。本研究中,20和50 μL/L的乙醇熏蒸分别将薯尖的呼吸高峰降低了10.76%和22.32%,说明乙醇可以抑制呼吸作用,从而延缓衰老。果蔬的衰老过程往往伴随着颜色的变化,乙醇通过维持叶绿体内部基粒片层结构及外膜的完整性[35],降低贮藏期间叶绿体的破坏程度,有效延缓叶绿体结构的解体,从而保持薯尖的鲜绿状态;PPO是褐变主要酶,乙醇与PPO作用底物邻苯二酚具有相似化学特性的羟基[42],因此乙醇可通过与底物竞争酶活性中心基团,抑制PPO活性,延缓薯尖褐变。此外,乙醇具有强烈的消毒杀菌作用,可杀死组织表面大部分真菌和细菌,抑制病菌感染。果蔬受微生物侵害后会引发腐烂,外源乙醇通过影响生物体代谢来抑制果蔬成熟衰老,从而维持自身抗性[43],减少腐烂发生,适当的乙醇处理可保持相对较低的腐烂率,这在乙醇处理新鲜生菜[44]、新鲜白芦笋[45]、枇杷[46]中均有体现。
活性氧是一种化学反应性的含氧分子,它可以与蛋白质、DNA和膜脂发生反应,从而增加电解质泄漏,加速衰老和细胞死亡[47]。如果细胞中缺乏清除活性氧自由基的酶或物质时,活性氧的代谢失调从而使机体受到各种自由基的伤害。SOD、CAT、POD都是防御活性氧毒害的酶系统,它们相互协调使活性氧维持在较低水平,防止其对细胞的毒害。韩俊华等[35]的研究指出,经6 mL/kg的乙醇处理后的西兰花,SOD和CAT的活性受到了促进作用,增强了对活性氧毒害的抵抗。本研究中,20和50 μL/L的乙醇处理使得薯尖的SOD、CAT、POD活性增强,有效地防止了细胞活性氧的蓄积,减轻机体受到的自由基伤害。这与乙醇熏蒸有利于油豆角[48]、柿果实[49]的活性氧正常代谢,降低自由基毒害的结果一致。
果蔬细胞膜对维持细胞的微环境和正常的代谢起着重要的作用。MDA是膜脂过氧化作用的主要产物之一,可作为膜损伤的直接指标,相对电导率表示细胞膜渗透率以及膜受到伤害的程度,可反映细胞膜通透性的变化。因此,MDA和相对电导率可作为判断细胞膜损伤的指标。果蔬组织在衰老过程中,细胞内的活性氧自由基代谢平衡往往被破坏,自由基大量积累并引发或加剧脂质过氧化作用,造成细胞质膜系统的损伤。本研究中,适当的乙醇处理可以抑制活性氧的产生[50],提高薯尖的抗氧化能力[51],从而抑制细胞膜的脂质过氧化,较好地维持膜稳定性。由图3、图4可知,到贮藏结束时,50 μL/L组的相对电导率和MDA含量分别为CK组的79.1%和89.21%,说明乙醇熏蒸能够有效降低膜损伤。HOMAIDA等[52]也发现300 mL/L乙醇处理可有效抑制鲜切甘蔗电导率的上升,减轻细胞质膜系统的损伤。FAN等[4]的研究也表明200 mL/L乙醇熏蒸是抑制鲜切山药MDA含量上升的有效方法。
在乙醇熏蒸处理过程中,过高的浓度对果蔬的破坏超出果蔬的修复能力从而引起损伤。王慧倩等[40]用2%、5%、10%和20%乙醇熏蒸处理西兰花6 h,结果表明在2%~10%,乙醇体积分数越高,对西兰花黄化的抑制越明显,货架期越长,以10%乙醇处理效果最佳;而高体积分数(20%)乙醇处理反而促进西兰花黄化,货架期随之缩短。张洪翠等[17]在双孢蘑菇上采用200、400、600 μL/L乙醇熏蒸3 h,发现600 μL/L乙醇过量渗入细胞,促进胞内蛋白变性,对细胞产生毒害。本研究中,50 μL/L乙醇熏蒸组保鲜效果最佳,20 μL/L组次之,而100 μL/L组则会加速红薯尖的腐烂衰老。因此,乙醇熏蒸对红薯尖的品质保护作用受乙醇浓度的影响很大,在一定范围内,乙醇的保鲜效果随着浓度的增加而显著。但乙醇浓度过高,会在薯尖细胞中过量积累,逐渐削弱薯尖抵抗力,加速腐败,其次,高浓度乙醇加快细胞原生质膜破裂,离子泄露增加,此外,高浓度乙醇胁迫下,活性氧清除酶的活性下降,活性氧代谢平衡被打破,细胞产生的自由基最终诱发膜脂过氧化,加剧了细胞膜系统的损伤。
综上所述,适宜浓度的乙醇熏蒸处理可明显抑制薯尖呼吸强度,有效维持活性氧代谢平衡(SOD、CAT、POD),同时能够很好地保持薯尖颜色(PPO、叶绿素含量),降低细胞膜损伤(MDA含量、相对电导率),减少腐烂的发生,且能维持较高的感官品质。整体而言,50 μL/L组综合保鲜效果最佳。然而,高浓度(100 μL/L)乙醇熏蒸处理降低了细胞自身防御力,加快原生质膜破裂,胁迫降低了活性氧清除酶活性,不利于薯尖保鲜。试验结果表明,乙醇熏蒸对抑制薯尖品质劣变、延长物流及运输保鲜期具有应用价值。
