米曲霉和鲁氏酵母协同发酵优化合浦珠母贝肉酶解液风味
2019-08-26赵永强王安凤陈胜军杨贤庆李来好吴燕燕杨少玲
赵永强,王安凤,陈胜军*,杨贤庆,李来好,吴燕燕,杨少玲
1(中国水产科学研究院南海水产研究所,农业农村部水产品加工重点实验室,国家水产品加工技术研发中心,广东 广州,510300) 2(江苏省海洋生物产业技术协同创新中心,江苏 连云港,222005) 3(上海海洋大学 食品学院,上海,201306)
合浦珠母贝(Pinctadafucata)是我国海水珍珠培育的主要品种,占海水珍珠培育总产量的90%以上[1]。作为采珠后副产物,每年有大量合浦珠母贝肉未得到充分利用。合浦珠母贝肉富含多种营养物质及活性成分,具有重要的食用和药用价值,研究表明贝肉中糖胺聚糖具有免疫调节与抗肿瘤等多种功能活性[2-3]。以合浦珠母贝肉为原料,通过酶解制备贝肉水解液,水解液中含有丰富的游离氨基酸、多肽和矿物质等营养成分,但是存在腥味重,香气不协调等缺点,需要进一步优化酶解液的风味[4]。
米曲霉具有较强的蛋白质分泌能力和食品安全性,其分泌的蛋白酶可将蛋白质水解,增强发酵液的风味,并可加快发酵进程[5]。何炘[6]和夏克胜[7]分别利用米曲霉发酵来改良贻贝蒸煮液和马氏珠母贝肉呈味基料的风味。鲁氏酵母是一种增香酵母,在发酵期间可产生醇、呋喃等多种风味物质[8-9]。近年来,利用微生物发酵来改良水产品风味的研究已多见报道[10-13]。相关研究表明,复合菌种发酵过程中产生的酶系更加复杂,可显著改良水产品风味[14]。因此本文采用米曲霉和鲁氏酵母菌协同发酵,以发酵液风味值和游离氨基态氮含量为考察指标,优化合浦珠母贝肉酶解液的发酵工艺,为发酵型海鲜调味料的生产提供理论依据和技术支持。
1 材料与方法
1.1 材料和试剂
合浦珠母贝肉酶解液,由实验室前期酶解试验所得;大豆粉、大麦粉,购于当地超市;风味蛋白酶(≥120 U/mg)、复合蛋白酶(≥120 U/mg),统一购于广州市齐云生物技术有限公司;鲁氏酵母菌、米曲霉(沪酿3.042孢子粉),购于沂源康源生物科技有限公司;Na2HPO4、NaH2PO4、HCHO,购于广州化学试剂厂,分析纯。
1.2 仪器与设备
YXQ-SG46-280S型灭菌锅,上海博迅实业有限公司;Akku-drive型电位滴定仪,德国赫施曼公司;DHG-9240A型鼓风干燥箱,上海恒科仪器有限公司;Delta320型精密pH计,梅特勒-托利多仪器(上海)有限公司;HH-8型数显恒温水浴锅,常州澳华仪器有限公司;3K30型高速冷冻离心机,德国Sigma公司;SLI-700型恒温培养,上海爱朗仪器有限公司;GB204型电子天平,瑞士METTLER公司;SW-CJ-2FD型超净工作台,上海博迅实业有限公司医疗设备厂。
1.3 实验方法
1.3.1 工艺流程
取适量合浦珠母贝肉酶解液,经高温高压灭菌后冷却至室温贮藏待用,菌种经活化与扩大培养后接种至酶解液中进行发酵,随后取发酵液进行风味值和游离氨基态氮含量检测。
1.3.2 菌种活化
将面粉和大豆粉按1∶3的质量比加适量清水混匀后,放高温蒸汽灭菌锅里,121 ℃灭菌15 min,冷却至室温后接入0.1%(以混合后物料总量计)的干菌种,在培养箱里培养一段时间,取样、粉碎,测活菌落数,备用。
1.3.3 曲种中活菌数的测定
菌落总数的测定参考文献[15]。
1.3.4 曲种的制备
将活化好的菌种添加到面粉与大豆粉混合制备的培养基里,进行扩大培养。通过稀释平板计数法,使曲种的菌体浓度保持在(0~1)×108CFU/g,备用。
1.3.5 合浦珠母贝肉酶解液的发酵
将经水解后的合浦珠母贝肉酶解液调整pH至7.0,随后添加适量NaCl及扩大培养的曲种,曲种菌体浓度为(1~5)×108CFU/g。采用两段式发酵方式,先添加米曲霉进行有氧发酵,随后添加鲁氏酵母菌进行无氧发酵,2种菌发酵时间各占总发酵时间的1/2。
1.3.6 发酵液感官风味评定
由12名(6男,6女,20~35岁)具有感官评定经验的人员组成评定小组,事先规定好评定标准,以对发酵后腥味、鲜香度、协调性、醇厚感等主要指标进行评定。然后参照GB/T14454.1—2008[16]、GB/T10220.1—2012[17]与GB/T10221.1—2012[18]进行感官评定。评定前将经冷藏过的贝肉发酵液加热至室温,并对其进行标号后让评定员打分,评定员每评定1个样品后需漱口,并休息1 min之后再评定下1个样品,具体评定标准如表1。
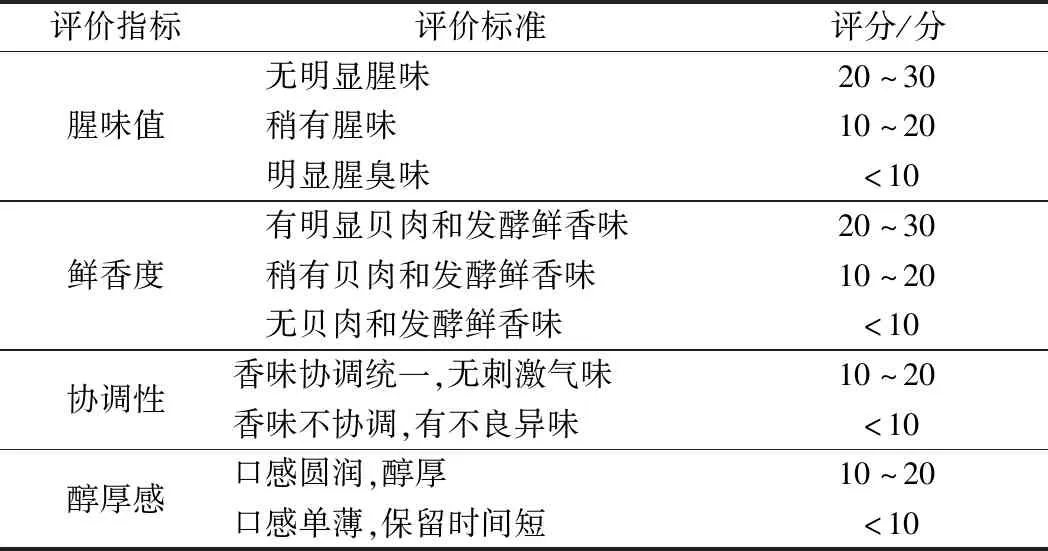
表1 合浦珠母贝肉发酵液感官评分标准
1.3.7 发酵液中氨基态氮含量的测定
发酵液中游离氨基氮含量的测定采用甲醛点位滴定法[19]。
1.3.8 微生物发酵单因素影响试验
(1)米曲霉和鲁氏酵母菌的添加比例对贝肉发酵液风味值及游离氨基态氮的影响
总发酵时间为72 h,发酵温度30 ℃,接种量5%,分别测定不同菌种比例(米曲霉∶鲁氏酵母=3∶1、2∶1、1∶1、1∶2、1∶3)对贝肉发酵液风味值及游离氨基氮含量的影响。
(2)菌种的接种量对贝肉发酵风味值及游离氨基态氮的影响
总发酵时间为72 h,发酵温度30 ℃,菌种比例1∶1,分别测定不同菌种添加量2%、3%、4%、5%、6%对贝肉发酵液风味值及游离氨基氮含量的影响。
(3)发酵温度对贝肉发酵风味值及游离氨基态氮的影响
总发酵时间为72 h,菌种比例1∶1,接种量5%,已知米曲霉最适生长温度30~35 ℃[20],鲁氏酵母最适温度为28~30 ℃[21],因此分别测定2菌种混合发酵温度28、29、30、32、34 ℃时对贝肉发酵液风味值及游离氨基氮含量的影响。
④发酵时间对贝肉发酵液风味值及游离氨基态氮的影响
菌种比例1∶1,发酵温度30 ℃,接种量5%,分别测定不同菌种总发酵时间为56、64、72、80、88 h,对贝肉发酵液风味值及游离氨基氮含量的影响。
1.3.9 微生物发酵正交优化试验
根据单因素试验结果,研究进口温度(A)、进料流量(B)、麦芽糊精添加量(C)3个因素对喷雾干燥产品的水分含量及感官评分的影响,选用正交表L9(34)进行三因素三水平的正交试验,确定合浦珠母贝肉调味液喷雾干燥的最佳工艺,正交试验因素与水平如表2所示。

表2 发酵工艺优化正交试验因素与水平
注:A-米曲霉; B-鲁氏酵母菌。
1.3.10 数据处理
数据分析采用Microsoft Excel 2016软件进行分析,在检验水平为0.05的条件下进行显著性差异分析,且所有实验均重复3次。
2 结果与分析
2.1 菌种添加比例
米曲霉和鲁氏酵母菌的添加比例对贝肉发酵液风味值及游离氨基态氮含量的影响结果见图1。由图1可知,随着鲁氏酵母菌添加比例的增大,合浦珠母贝肉酶解液的风味值和游离氨基态氮含量都呈现先增加后降低的趋势。在米曲霉∶鲁氏酵母=1∶2时,贝肉酶解液的风味值达到最高值(76.98±1.12),但在增加或降低鲁氏酵母菌的添加比例时,风味值都会降低,这可能是因为菌种比例的变化,导致微生物代谢产物中风味物质的变化进而影响发酵液的口感,风味值随之降低[22]。在米曲霉∶鲁氏酵母=1∶1时,贝肉酶解液的游离氨基态氮含量达到最高值(2.73±0.08) g/L,但在增加或降低鲁氏酵母菌的添加比例时,游离氨基态氮含量都将会降低,这因为菌种的生长繁殖受多方面影响,接种量并不一定和氨基氮含量呈正相关[23]。综合考虑风味值和游离氨基态氮在米曲霉∶鲁氏酵母=1∶1和1∶2时2项指标的变化情况,选取最佳菌种添加比例为1∶2。
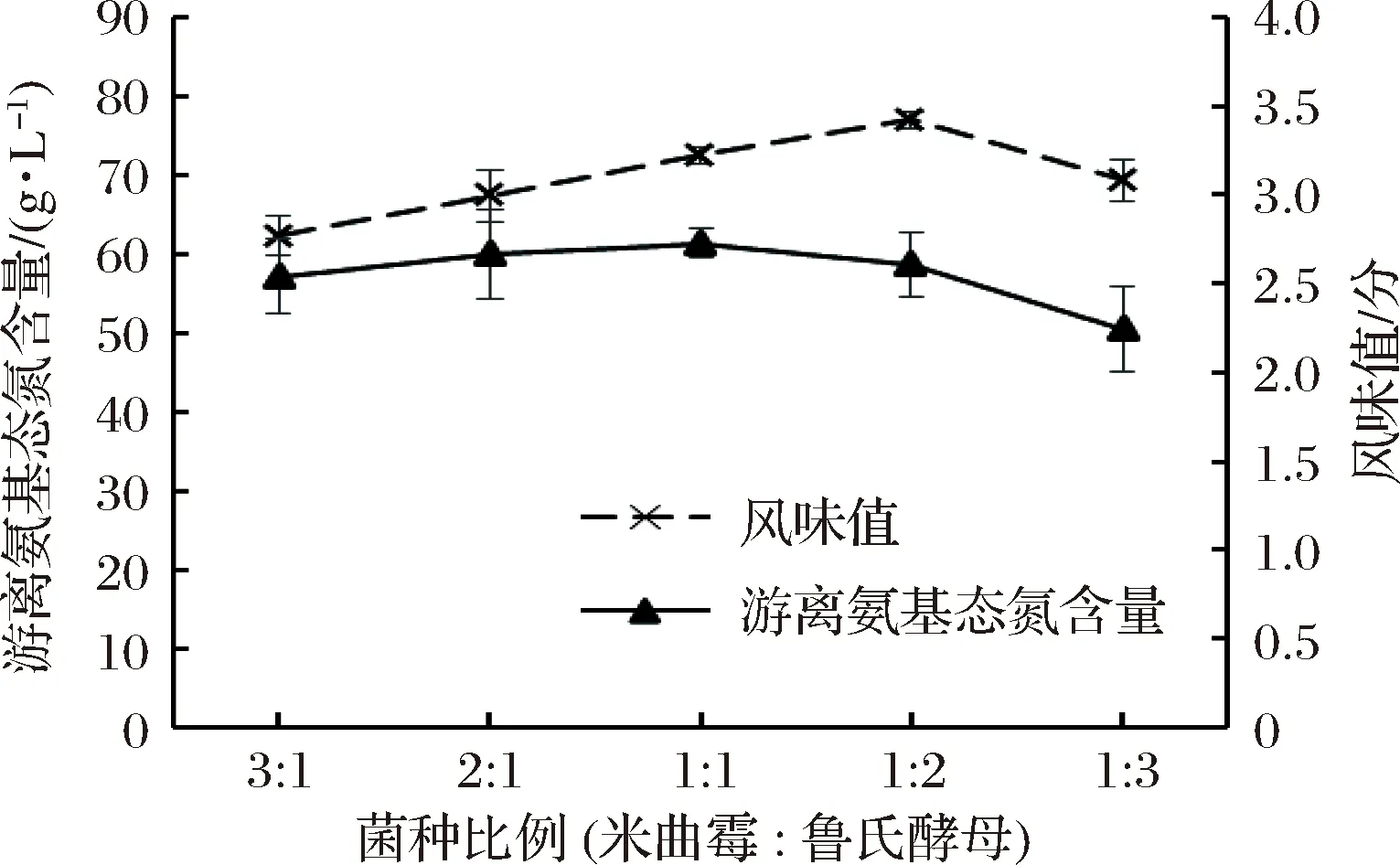
图1 菌种比例对发酵液风味值及游离氨基态氮含量的影响
Fig.1 Effect of strain ratio on flavor value and free amino nitrogen content of fermented liquor
2.2 菌种接种量
菌种接种量对贝肉发酵风味值及游离氨基态氮含量的影响结果见图2。由图2可知,随着总接种量的增大,合浦珠母贝肉酶解液的风味值和游离氨基态氮含量都呈现先增加后降低的趋势。在接种量为5%时,贝肉酶解液的风味值达到最高值(76.67±0.33),但在增加或降低菌种添加量时,风味值都会降低,这可能是因为接种量的变化,导致发酵速率及风味物质含量发生变化,进而影响了发酵液的风味值[24]。在接种量为4%时,贝肉酶解液的游离氨基态氮含量达到最高值(2.71±0.13),但在增加或降低接种量时,游离氨基态氮含量都将会降低,这可能因为接种量的不足或过多,导致相应微生物代谢不足或自身生长消耗游离氨基态氮过多。相关研究也证实了适宜的接种量有利于微生物的生长,加快发酵的进程[25]。因此综合考虑风味值和游离氨基态氮2项指标的变化情况,选取最佳接种量为4%。
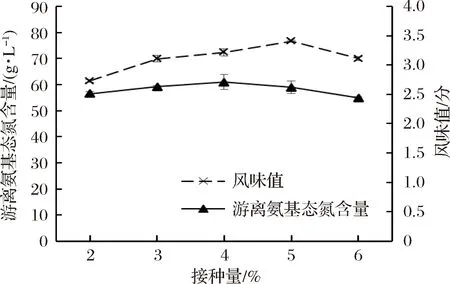
图2 接种量对发酵液风味值及游离氨基态氮含量的影响
Fig.2 Effect of seeding amount on flavor value and free amino nitrogen content of fermented liquor
2.3 发酵温度
发酵温度对贝肉发酵风味值及游离氨基态氮含量的影响见图3。
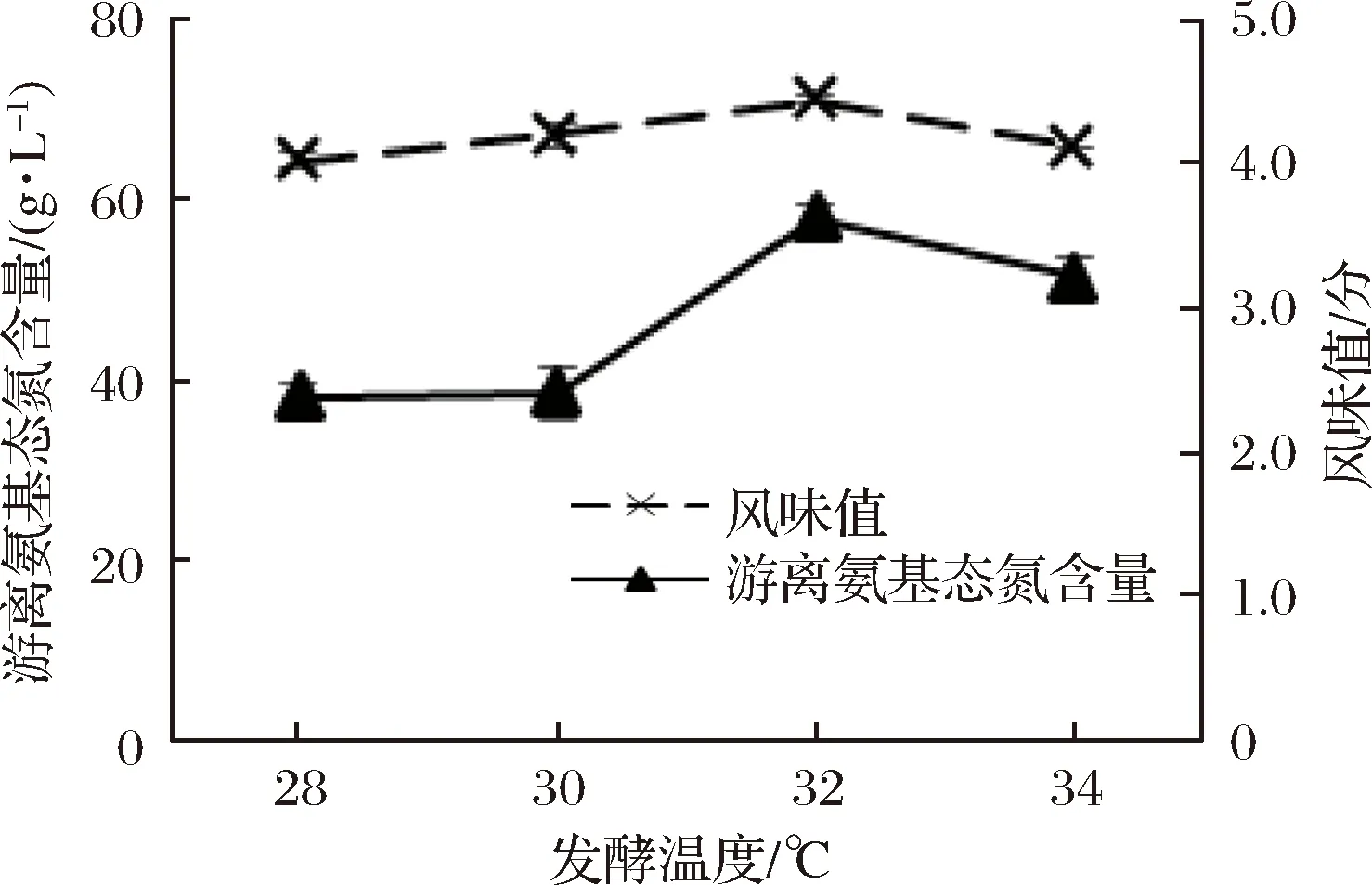
图3 发酵温度对发酵液风味值及游离氨基态氮含量的影响
Fig.3 Effect of temperature on flavor value and free amino nitrogen content of fermented liquor
由图3可知,随着发酵温度的增大,合浦珠母贝肉酶解液的风味值呈现先增加后降低的趋势,在发酵温度为32 ℃时,贝肉酶解液的风味值达到最高值(71.05±0.48),但在增加或降低发酵温度时,风味值都会降低。而发酵液中游离氨基态氮的含量却随着温度的升高而增加,在发酵温度为32 ℃时,贝肉酶解液的游离氨基态氮含量达到最高值(3.62±0.09) g/L。这是因为温度可影响微生物的新陈代谢,升高温度有利于发酵的进行,但在发酵温度达到34 ℃时,可能由于温度过高导致根霉等杂菌的过度生长,产生刺激性氨味[7],风味值大幅下降,因此综合考虑风味值和游离氨基态氮2项指标的变化情况,选取最佳发酵温度为32 ℃。
2.4 发酵时间
发酵时间对贝肉发酵液风味值及游离氨基态氮含量的影响见图4。由图4可知,随着发酵时间的增大,合浦珠母贝肉酶解液的风味值呈现先增加后降低的趋势。在发酵时间为80 h时,贝肉酶解液的风味值达到最高值(73.11±1.13),在增加或缩短发酵时间时,风味值都将有所降低。但随着发酵时间的增大,游离氨基态氮含量却呈上升趋势,但在80 h后,游离氨基酸含量上升幅度不再随时间的增加而大幅增大。因此综合考虑风味值和游离氨基态氮2项指标的变化情况,且提高发酵效率的情况下,选取最佳发酵时间为80 h。
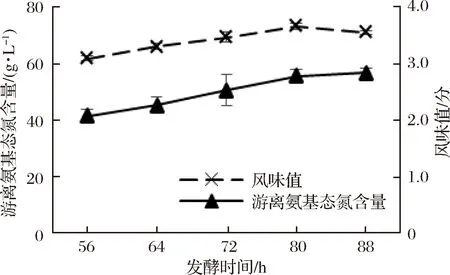
图4 发酵时间对发酵液风味值及游离氨基态氮含量的影响
Fig.4 Effect of time on flavor value and free amino nitrogen content of fermented liquor
2.5 正交实验优化合浦珠母贝肉酶解液发酵工艺
在单因素试验的基础上,选择对试验有较大影响的菌种比(A)、接种量(B)、发酵温度(C)、发酵时间(D)4个因素为考察因子,进行L9(34)正交试验,以合浦珠母贝肉发酵液的风味值和游离氨基态氮含量为评价指标,试验结果和方差分析表3、表4所示。
由表3和表4可知菌种比(A)、接种量(B)、发酵温度(C)、发酵时间(D)对合浦珠母贝肉发酵液的风味值和游离氨基态氮含量都有不同程度的影响。以上4个因素对发酵液的风味值的影响程度顺序为菌种比例>接种量>发酵时间>发酵温度,发酵时间和温度对发酵液的风味值影响不显著。
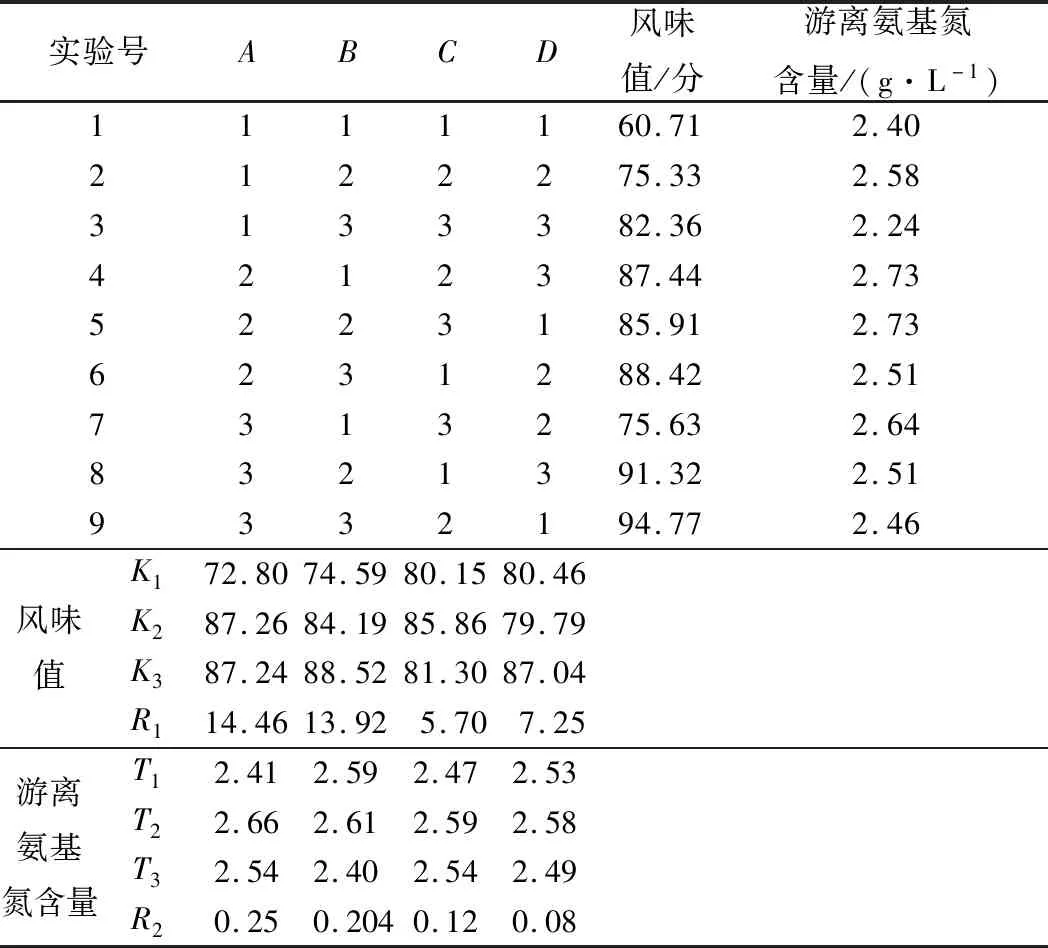
表3 发酵工艺优化正交试验结果与分析
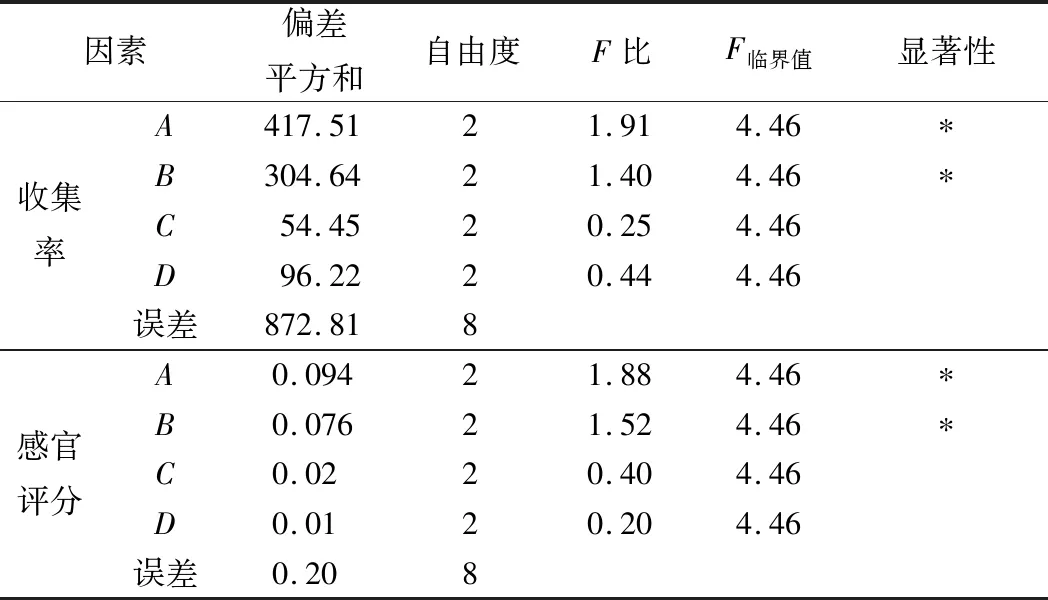
表4 正交试验结果方差分析
注:“*”表示显著影响。
以产品收集率为指标通过K值判断可知,最优条件组合A2B3C2D3。4个因素对游离氨基态氮含量的影响程度的顺序为菌种比例>发酵温度>接种量>发酵时间,发酵温度和发酵时间对游离氨基态氮含量的影响不显著。以发酵液的游离氨基态含量为指标通过T值判断可知,最优组合为A2B2C2D2。分别在2组最优组合下进行验证实验,在A2B2C2D2条件下发酵液的风味值及游离氨基态氮含量都高于A2B3C2D3。因此最终选取最佳发酵优化工艺为A2B2C2D2,即菌种比例1∶2、接种量4%、发酵温度32 ℃、发酵时间80 h。
3 结论
该研究在单因素试验的基础上,采用正交试验设计优化合浦珠母贝肉酶解液的发酵工艺,分别考察菌种比、接种量、发酵温度和发酵时间4个因素对合浦珠母贝肉发酵液的风味值和游离氨基态氮含量的影响,通过统计分析及对比,确定最优的发酵工艺。在4因素3水平的正交实验基础上确定合浦珠母贝肉酶解液的最佳发酵工艺条件为:菌种比例(1∶2)、接种量4%、发酵温度32 ℃、发酵时间80 h,在此条件下,所得发酵液的风味值评分为96.77,游离氨基态含量为2.83 g/L。该研究结果对以合浦珠母贝肉为原料开发海鲜调味品及调味基料过程中风味改良具有重要作用,今后可进一步开展以合浦珠母贝肉酶解液来源开发的海鲜调味品与调味基料风味稳定性的研究,以提升合浦珠母取珠后贝肉综合利用率,对我国海水珍珠产业绿色发展起到积极促进作用。
