超声波对反复冻融鸡肉肌原纤维蛋白功能特性的修复作用
2019-08-26张伊侬董唯徐毅尚永彪
张伊侬,董唯,徐毅,2,3,尚永彪,2,3*
1(西南大学 食品科学学院,重庆,400715) 2(农业部农产品贮藏保鲜质量安全评估实验室(重庆),重庆,400715) 3(重庆市特色食品工程技术研究中心,重庆,400715)
冷冻是生鲜肉制品最有效、最常用的贮藏手段。然而在实际生产中,冷链技术并不完善,肉类从屠宰、加工到零售等环节中,外界温度波动较大,产品会不可避免地经受反复冻融[1],造成内部冰晶体重结晶,破坏细胞组织的结构,造成营养物质流失,并加快蛋白质的冷冻变性,同时产品的色泽、保水性和质构也会发生变化,肉的食用价值及加工品质大大降低,给屠宰和深加工企业带来极大的损失。近年来,越来越多的学者开始关注并尝试解决反复冻融给鲜肉品质带来的问题。祝凯丽[2]发现,随着反复冻融次数的增加,生鲜肉的肌原纤维蛋白(myofibrillar protein,MP)含量、乳化性、总巯基含量、Ca2+-ATPase活性都呈降低的趋势,蛋白质的凝胶化作用也受到影响,但添加海藻酸钠的MP再经过同样冻融处理后,其变性情况得到明显改善。郭锐等[3]将κ-卡拉胶和复合磷酸盐添加到反复冻融猪肉中制成香肠,与对照组相比,处理组香肠的出品率和保水性显著提高,其质构性能以及内部水分分布也有所改善。目前来看,关于改善反复冻融肉制品的品质的研究大多是采用预防的措施,即在肉品发生冻融之前预先加入添加剂,以防冻融后蛋白质特性受到较大影响,但此类方法不适用于已经发生冻融损伤的肉制品,有较大的局限性。
研究表明,超声波能改变蛋白质的构造,引起蛋白质次级结构发生变化,进而改变蛋白质的功能特性[4]。然而,目前应用物理方法处理反复冻融肉制品的研究鲜有报道。本文采用超声波对反复冻融鸡肉进行处理,考察其对MP的功能特性的处理效果,并进一步探究超声波处理对MP功能特性修复的机理,以期为反复冻融肉类原料的科学利用、改善深加工产品的品质、提高加工出品率和企业经济效益等提供一定的技术和理论依据。
1 材料与方法
1.1 材料与试剂
鸡胸肉,选取同批次新鲜白羽鸡的鸡胸肉,购于重庆市北碚区永辉超市;大豆油,益海嘉里食品有限公司,购于重庆市北碚区永辉超市;牛血清蛋白标品、Na2HPO4、NaH2PO4、NaCl、EDTA、CuSO4(分析纯),成都市科龙化工试剂厂。
1.2 仪器与设备
HFJ-25内切式匀浆机,天津市恒奥科技发展有限公司;GL-23MS高速冷冻离心机,湖南赛特湘仪有限公司;CT-3质构仪,美国Brookfield公司;HR-1流变仪,美国TA公司;UV-2450紫外分光光度计,日本岛津公司;Spectrun100红外光谱仪,美国PerkinElmer公司。
1.3 方法
1.3.1 样品的预处理
将购置的新鲜鸡胸肉去除可见的脂肪及结缔组织,切成均匀的小块状,用塑料冷冻包装袋真空包装(每袋约200 g)后,放入-18 ℃冰箱中冻藏3 d,然后约10 ℃室温解冻12 h。如此反复冻融5次,制备试验所需的鸡肉样品。
1.3.2 MP的提取以及超声波处理
MP的提取参考董唯[5]的方法,提取出的MP保藏在4 ℃冰箱中,使用时间不超过3 d。进行超声波处理时,取适量MP于离心管中,采用4 ℃磷酸盐缓冲溶液根据各指标的测定方法分别调整蛋白质浓度,然后将离心管固定于超声清洗器中,超声功率设定为420 W,温度保持在40 ℃,超声处理时间分别为0、3、6、9、12、15、18 min,然后进行相关指标的测定。
1.3.3 MP溶解度的测定
用双缩脲法测定蛋白质的浓度[6],以牛血清蛋白为标准品,所得标准曲线方程为:y=0.076 5x+0.002 6,R2=0.999 8。MP溶解度的计算如公式(1)所示:

(1)
1.3.4 MP乳化活性和乳化稳定性的测定
用4℃磷酸盐缓冲溶液(0.02 mol/L Na2HPO4,pH 7.0)配制质量浓度为1 mg/mL的MP溶液,经超声波处理后,其乳化性的测定参照AGYARE等[7]的方法进行。
1.3.5 起泡性的测定
参照JIANG等[8]的方法并作适当的修改。用4 ℃磷酸盐缓冲溶液(0.05 mol/L Na2HPO4,pH 7.0)配制质量浓度为1 mg/mL的MP溶液,样品经超声波处理后,取10 mL样液高速匀浆,相关指标按公式(2)和公式(3)计算。

(2)

(3)
式中:V,样品的初始体积,mL;V0,匀浆后立即测得的泡沫体积,mL;V0.5,匀浆后样品静置0.5 h后泡沫的体积,mL。
1.3.6 MP热诱导凝胶的制备
用4 ℃磷酸盐缓冲溶液(0.6 mol/L NaCl,0.05 mol/L Na2HPO4,pH 6.25)配制质量浓度为40 mg/mL的MP溶液,经超声波处理后,取7 mL样品于10 mL的离心管中,将其在40℃下水浴20 min,然后在80 ℃下再水浴30 min。操作完成后将离心管放入冰水中,使其快速降温,从而缩短凝胶形成的时间。制备好的MP凝胶应放在4 ℃的冰箱中过夜后再使用。
1.3.7 凝胶硬度和弹性的测定
取出制备好的凝胶样品,在室温下放置30 min,去除表面水分,将凝胶样品修整为约1 cm厚的规则圆柱体,测定凝胶硬度和弹性,具体参数的设置参照董唯[5]的方法。
1.3.8 凝胶保水性的测定
取出制备好的凝胶样品,室温下放置30 min后,将凝胶进行离心并记录相关质量,保水性的计算如公式(4)所示:

(4)
式中:m0,离心管的质量,g;m1,离心前凝胶和离心管的质量,g;m2,离心后并去除水分后凝胶和离心管的质量,g。
1.3.9 MP流变学特性的测定
用4 ℃磷酸盐缓冲溶液(0.6 mol/L NaCl,0.05 mol/L Na2HPO4,pH 6.25)配制质量浓度为40 mg/mL的MP溶液,经超声波处理后,参考白登荣等[9]的方法设定流变仪的参数。
1.3.10 MP粒径大小的测定
用4 ℃磷酸盐缓冲溶液(0.6 mol/L NaCI,20 mmol/L Na2HPO4,pH 6.5)配制质量浓度为1 mg/mL的MP溶液,经超声波处理后,使用激光粒度仪测定蛋白质溶液中粒子大小。具体设定参数参考崔姗姗[10]的方法。
1.3.11 MP凝胶巯基含量的测定
称取10 g凝胶样品溶解于25 mL 0.02 mol/L Tris-HCl缓冲液A中,均质离心后取上清液,并将其蛋白质质量浓度调至1 mg/mL。取0.5 mL蛋白质溶液与5 mL 0.02 mol/L Tris-HCl缓冲液B混合,再加入0.1 mL DTNB(0.01 mol/L),40 ℃条件下保温25 min后在412 nm处测定溶液的吸光度,计算总巯基含量。缓冲液的配制具体参照ELLMAN[11]的方法。总巯基含量的计算如公式(5)所示:
C0=(A/ε)×(D/ρ)
(5)
式中:C0,总巯基的摩尔浓度,mol/g;A,吸光值;ε,吸光系数为13 600 M-1cm-1;D,稀释倍数;ρ,上清液中蛋白质质量浓度,mg/mL。
1.3.12 MP SDS-PAGE凝胶电泳
用不连续的SDS-PAGE对鸡肉MP进行分析,具体操作及参数设置参考LAEMMLI[12]的方法。
1.3.13 紫外光谱分析
用4 ℃磷酸盐缓冲溶液(0.01 mol/L Na2HPO4,pH 7.0)配制质量浓度为1 mg/mL的MP溶液,样品经超声波处理后进行紫外扫描,其速率设定为10 nm/s,扫描波长为200~600 nm。
1.3.14 红外光谱分析
提取的MP溶液经超声波处理后,需先制成MP冻干样品,然后与KBr一起研磨成粉末,制成压片。具体操作方法及测定条件参考林婉玲等[13]的方法。
1.3.15 数据处理
试验重复3次,最终结果取平均值。用Excel 2016对数据进行处理,用Origin 8.1软件进行绘图,用SPSS Statistics 17.0对数据进行显著性分析(P<0.05)。
2 结果与分析
2.1 超声波对MP功能特性的影响
反复冻融的MP经不同时间超声波处理后部分功能特性变化情况如表1所示。由表1可知,经超声波处理后,从MP的水合性质、表面性质和凝胶性质3方面测得的各指标均显著大于对照组(P<0.05),蛋白质功能特性得到很大改善。超声波的空化效应和机械效应能对蛋白质分子之间的相互作用产生影响[14],随着超声波处理样品时间的变化,MP分子间的次级键也会随之不停地发生断裂或者重新建立,蛋白质结构发生改变,相应的功能特性也因此发生变化。超声波使MP分子链慢慢打开,从有序的卷曲紧密结构变为无序松散的伸展状态,原本隐藏在结构内部的亲水基团更多地暴露,形成更易溶于水的非共价键分子,水合能力增强,溶解度提高。而蛋白质的溶解度又与其他功能特性密切相关,比如,溶解度的增加能够促进体系中参与乳化作用的蛋白质浓度增加,使油水界面形成更厚的蛋白膜,提高蛋白质乳化性[15]。MP的凝胶特性随超声波处理时间的延长先升高后降低,在12 min时有很好的硬度、弹性及保水性,可能是因为超声波使MP中非共价键作用力增强,凝胶网络结构结合地更致密、均匀;但是,如果超声波处理时间过长(>12 min),可能会产生过高的局部热量,导致部分蛋白质改变构象发生聚集,部分功能性基团被包埋在蛋白质颗粒内部,从而使形成的凝胶结构无序而粗糙,凝胶性质下降。

表1 超声波处理时间对肌原纤维蛋白功能特性的影响
2.2 超声波对MP流变学特性的影响
如图1所示,随着超声波处理时间的增加,MP的G′值先增加后降低,并在12和15min时有较高的G′值。在升温的第1阶段,在41~43 ℃时出现了第1个峰值,MP分子被打开,蛋白质凝胶网络形成,未经超声波处理的蛋白质样品在43.17 ℃时G′达到最大值,为1 236.4 Pa,而超声波处理组的蛋白质样品出现峰值的时间缩短,且其G′最大值显著大于未经超声波处理;在第2阶段48~50 ℃时出现了第2个峰值,超声波处理的样品的G′最小值显著大于对照组,而且其转变温度低于对照组;第3阶段是随着温度的升高,G′值迅速增大,在71~77 ℃时出现了第3个峰值,此时形成了不可逆凝胶,未经超声波处理的蛋白质样品G′在77.10 ℃时达到最大值,而时间为12 min处理组的蛋白质样品G′在73.91 ℃达到最大值34 130.4 Pa,时间为15 min处理组的蛋白质样品G′在74.26℃达到最大值32 392 Pa。与未经超声波处理的蛋白质样品相比,超声波处理的样品G′值增大速度较快,G′值发生转变的温度点比未经超声波处理组低,且其G′最大值也显著高于未经超声波处理组,这表明超声波处理可以降低蛋白质形成凝胶的热变性温度,提高凝胶的形成能力,这与凝胶弹性和硬度测得结果基本一致。
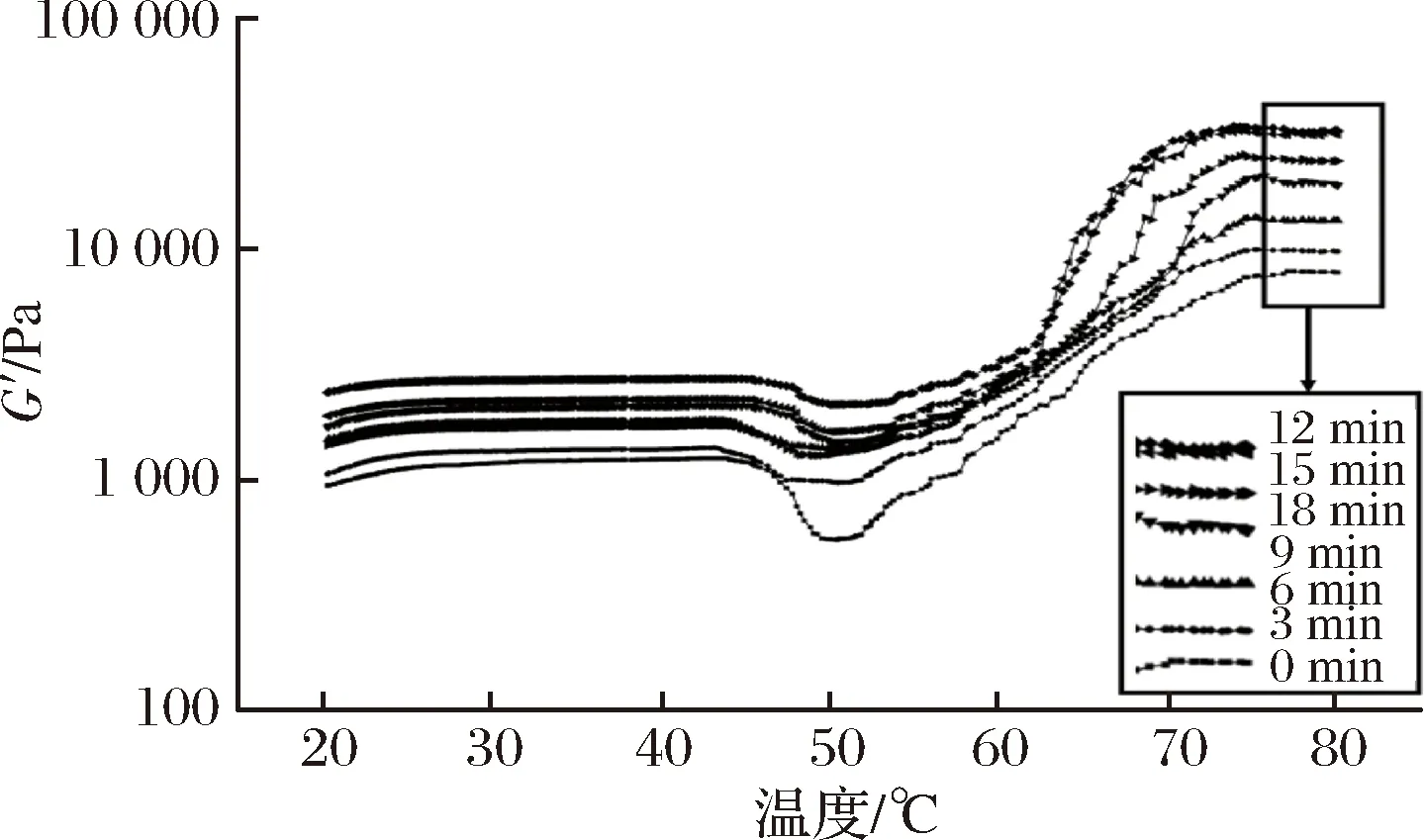
图1 超声波处理时间对肌原纤维蛋白存储模量(G′)的影响
Fig.1 Effects of ultrasonic time on storage modulus (G′)of myofibrillar protein
2.3 超声波对MP粒度的影响
如图2所示,随着超声波处理时间的增加,MP平均粒径呈减小的趋势,当处理时间为0~12 min时,超声波对MP平均粒径减小的作用十分显著(P<0.05),在超声波处理时间为12 min时,蛋白质的平均粒径达到最小值,为1 315 nm;处理时间超过12 min后粒径变化不显著。HU等[16]用高强度超声波处理大豆蛋白时,发现超声波处理减小了蛋白质颗粒尺寸,且处理时间越长,粒径越小;ZHANG等[17]研究超声波处理花生蛋白时也发现5、10、15、20、25、30 min超声处理组的蛋白质的平均粒径比对照组显著减小。WU等发现[18],蛋白质的粒径大小与蛋白质凝胶性质密切相关,当MP粒径较小时,更有利于形成致密均匀的凝胶网络结构。本研究中MP凝胶特性以及MP粒径变化趋势与WU等[18]的观点相符,由此可见,强烈的振荡作用及剪切力使蛋白质分子间非共价相互作用遭到破坏,其颗粒被分散和破碎,有利于MP凝胶特性的提高。

图2 超声波处理时间对肌原纤维蛋白平均粒径的影响
Fig.2 Effects of ultrasonic time on particle size of myofibrillar protein
2.4 超声波对MP分子质量的影响
不同超声时间处理后的MP经SDS-PAGE分析,结果如图3所示,7个时间梯度所处理的MP样品的电泳条带无明显变化,表明处理前后MP的分子质量(主要是肌球蛋白和肌动蛋白)分布没有发生明显变化,即MP的一级结构可能没有明显发生变化,而发生改变的应该是MP的高级结构。常海霞等[19]采用不同时间超声波处理草鱼肌肉MP时,发现处理时间的变化并不会引起MP电泳谱带较大的变化,也未出现蛋白质降解片段或蛋白质共价聚集产物,这与本文结论相似。
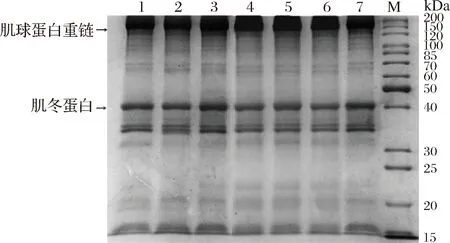
M-标准蛋白(marker);1~7-超声波处理时间分别为0、3、6、9、12、15、18 min
图3 超声波处理时间对肌原纤维蛋白SDS-PAGE
图谱的影响
Fig.3 Effects of ultrasonic time on the SDS-PAGE pattern of myofibrillar protein
2.5 超声波对MP巯基含量的影响
如图4所示,随着超声时间的增加,MP凝胶巯基含量显著下降(P<0.05)。与对照组相比,经超声处理3、6、9、12、15、18 min后,其蛋白质凝胶巯基分别由对照组的7.11×10-5mol/g降低至6.99×10-5mol/g、6.76×10-5mol/g、6.48×10-5mol/g、6.22×10-5mol/g、6.08×10-5mol/g、5.91×10-5mol/g,分别降低了1.69%、4.92%、8.86%、12.51%、14.49%、16.47%。这一变化可能与超声波对MP分子链的打开作用有关,超声波处理使包埋在分子内部的巯基暴露出来,而巯基基团与二硫键这一维持蛋白质特定结构稳定性的共价键密切相关,所以某种程度上,巯基含量的降低说明MP分子内的二硫键重新发生键合,这也必定会导致MP结构改变[20]。刘亚春[21]采用不同方法处理猪肉肌原纤维蛋白,对凝胶机理进行研究时,发现超声波处理组的热诱导蛋白质凝胶巯基含量比空白组要低,认为超声波通过物理作用使巯基转变为二硫键,导致了巯基含量下降。
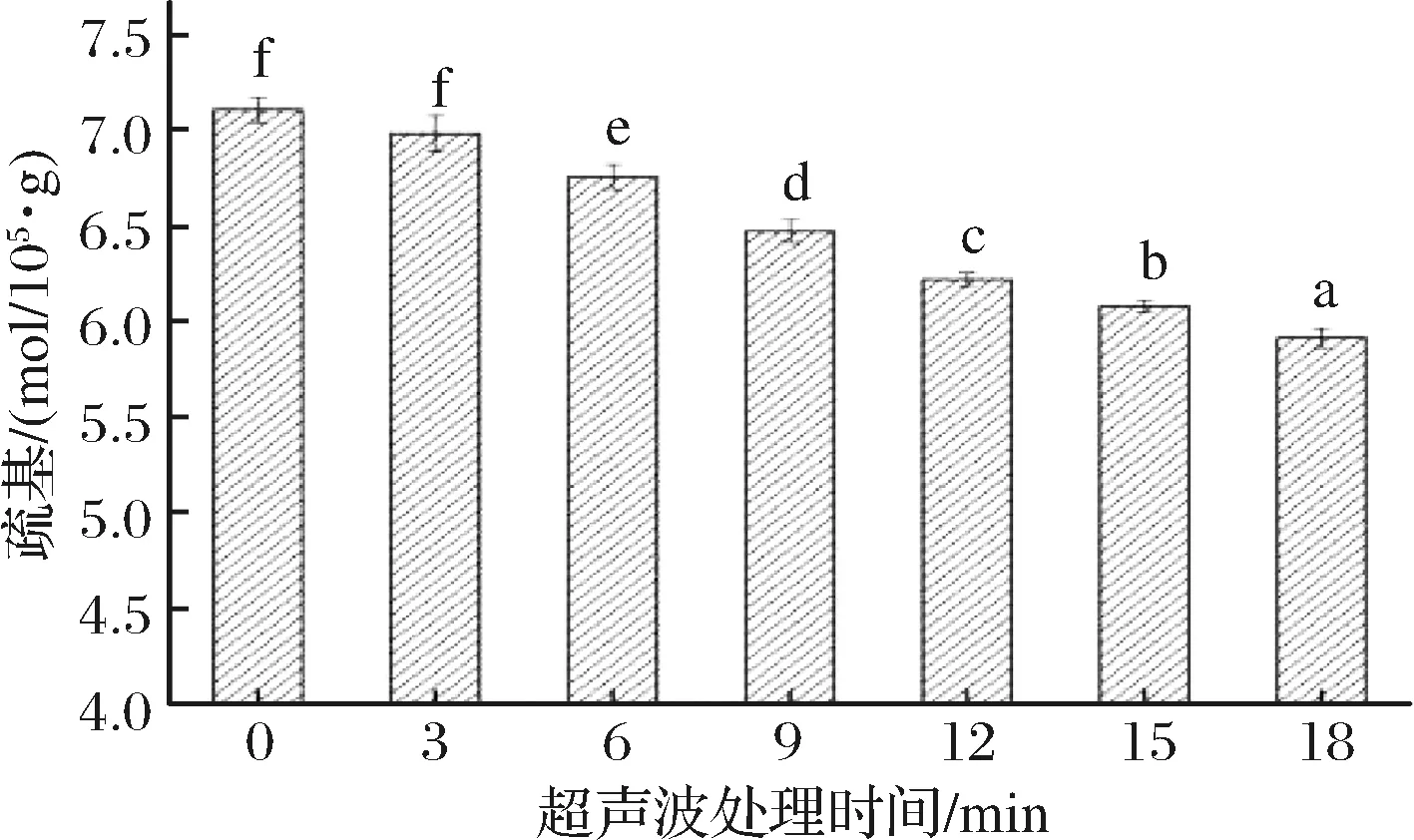
图4 超声波处理时间对肌原纤维蛋白凝胶巯基含量的影响
Fig.4 Effects of ultrasonic time on sulfhydryl content of gelatin from myofibrillar protein
2.6 超声波对MP紫外光谱的影响
如图5所示,随着超声时间的增加,MP的紫外吸光度呈先增加后降低的趋势,处理时间为12 min时紫外吸光度达到最大值。随着处理时间进一步增加,紫外吸光度略有降低,2个吸收峰分别位于250和270 nm左右。MP产生紫外光谱的原因主要是因为其分子内部某些残基的侧链基团可以吸收紫外光,如色氨酸和组氨酸等,其次肽键也可以吸收紫外光[22]。而当样品经超声波处理后,MP分子构象改变,其中的生色基团被更多地暴露到了表面,相对含量提高,且这些生色基团由原来所处的非极性环境转换为极性环境,从而使体系紫外吸光度增加[18]。而超声波处理时间过长时(>12 min),蛋白质分子可能又会发生聚集,生色基团相对减少,蛋白质紫外吸光度降低。紫外光谱的变化进一步说明超声波使MP分子结构发生了变化,从而引起其功能特性相应的改变。

图5 超声波处理时间对肌原纤维蛋白紫外光谱的影响
Fig.5 Effects of ultrasonic time on the UV spectra of myofibrillar protein
2.7 超声波对MP红外光谱的影响
不同超声波处理时间对MP红外光谱及二级结构含量变化的影响如图6所示。通常蛋白质的α-螺旋和β-折叠被包埋在多肽链的内部,其中α-螺旋结构紧密且无空腔,是非常稳定的二级结构[23]。随着处理时间的增加,MP中α-螺旋结构的含量显著降低(P<0.05),说明其对超声波处理比较敏感。β-折叠含量呈先增加后降低的趋势,而β-转角、无规则卷曲含量有所增加。MP二级结构组成中有序单元(α-螺旋结构和β-折叠结构)的总含量也呈下降趋势,表明超声波处理时间越长,MP二级结构改变的越多。β-折叠结构易优先转化为β-转角,本研究中β-转角含量明显增加,说明随着超声波处理的进行,蛋白质结构变得更加松散[24],MP分子中螺旋结构部分展开,刚性结构减少,柔性结构增加,促使蛋白质柔顺性增强,这也可能是促使MP某些功能性质(如溶解性、乳化性、起泡性等)改善的内在因素。蛋白质中无规则卷曲结构含量增加,可能是由于α-螺旋逐渐解旋转化,MP的构象紧密性与稳定性也因此大大降低。包埋于分子内部的疏水性残基暴露出来,增强了肌球蛋白分子间的疏水相互作用,引起蛋白质的聚合[25]。

图6 超声波处理时间对肌原纤维蛋白二级结构含量的影响
Fig.6 Effects of ultrasonic time on secondary structure content of myofibrillar protein
3 结论
经适当超声波处理后的反复冻融鸡肉肌原纤维蛋白,其溶解性、乳化性、起泡性及凝胶特性均得到显著改善(P<0.05)。通过对MP粒径的测定发现,超声波的机械效应和空穴效应产生的强烈的振荡作用及剪切力,使蛋白质分子打开,颗粒分散和破碎,粒径减小;与此同时,MP的结构发生变化,巯基含量减少,被氧化为二硫键;通过对紫外光谱的测定也发现原本埋藏在分子内部的生色基团暴露,蛋白质三级结构改变;进一步测定红外光谱表明,分子中α-螺旋和β-折叠都有所减少,蛋白质结构变得更加松散。而随着超声波处理时间的延长,约超过12~15 min时,蛋白质可能会发生变性,造成其再次聚集,颗粒变大,影响蛋白质形成的致密均匀的凝胶网络结构。而通过凝胶电泳的测定,发现处理前后变化不明显,说明超声波对MP的修复作用与分子量的影响不大。
