三种添加剂对猪粪厌氧干发酵的影响
2019-08-26李丹妮张克强梁军锋高文萱孔德望杜连柱
李丹妮,张克强,梁军锋,高文萱,孔德望,杜连柱*
(1.农业农村部环境保护科研监测所,天津 300191;2.杭州能源环境工程有限公司,杭州 310020)
近年来,我国畜牧业发展迅速,伴随着规模化养殖场数量和比例不断增加,畜禽养殖粪污污染逐渐成为焦点问题。据2017年统计,我国畜禽养殖粪污年产生量约38亿t,而且资源化利用率低、污染严重,对生态安全和畜牧业健康绿色发展造成严重威胁[1]。厌氧发酵具有能源化作用,沼液和沼渣作为肥料还田利用,是畜禽养殖粪污处理和利用的主要技术之一。
与传统的湿式厌氧发酵相比,厌氧干发酵具有能耗低、投资小、操作简单和无沼液后续处理压力等优点,逐渐成为研究的热点[2-3]。但厌氧干发酵有机负荷高、传质效率低、搅拌困难、易产生酸积累,导致启动慢、周期长和产气效率低等问题。为解决此类问题,国内外学者开展了广泛研究,其中渗透液/沼液回流和接种比例是研究重点。如杜静等[4]的研究表明,通过渗透液回流,试验组总固体产气量达到155 m3·t-1,较不回流高出29.17%。Sponza等[5]发现回流的反应器在pH值、有机酸浓度变化和甲烷含量等方面具有良好的稳定性,且产气量高。井良霄等[6]研究接种物对秸秆猪粪混合干式厌氧发酵产沼气的影响发现,加入40%接种物的试验组总产气量比接种量为30%的试验组高19.1%。除此之外,郑盼等[7]研究发现,添加生物炭对提高猪粪厌氧干发酵产气率具有促进作用。上述研究通过改进工艺措施在一定程度上提高了厌氧干发酵产气效率,但是,如何解决厌氧干发酵高有机负荷带来的问题仍有待开展深入研究。
本试验以猪粪为发酵底物,通过中温序批式试验研究不同添加剂(蛭石、海泡石和生物炭)及添加量(添加比例分别为5%、10%、15%和20%)对猪粪厌氧干发酵过程有机酸积累和产气效果的影响,并采用修正的Gompertz动力学模型模拟产气过程,为优化猪粪厌氧干发酵提供技术支持。
1 材料与方法
1.1 试验材料
试验用猪粪为天津市西青区某规模化养殖场日产鲜猪粪,取回后储存于(4±1)℃的冰箱。蛭石、海泡石、生物炭均为市购,用前105℃烘箱烘干至恒质量。接种物取自试验室正常运行的序批式厌氧干反应器(Sequencing Batch Reactor,SBR)。底物与接种物的理化指标见表1。
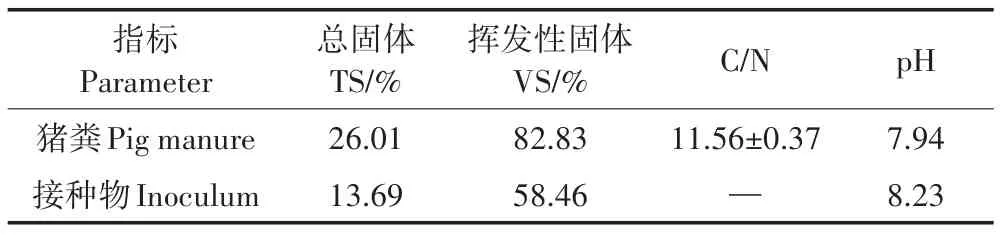
表1 原料和接种物特性Table 1 Characteristics of materials and inoculum
1.2 试验装置
试验装置为自制立式厌氧反应器,有机玻璃材质,内径90 mm,高170 mm,有效容积1.1 L。反应器顶部设有沼气排放口和取气阀门各1个,其中沼气排放口连接3 L集气袋,侧面中下部设有2个取样口。
1.3 试验设计
以猪粪为发酵底物,设置添加蛭石、海泡石和生物炭3种添加剂,按发酵底物TS比,设5%、10%、15%和20%共4种添加比例,以猪粪单独发酵为对照,共4组13种处理,每种处理3个重复。具体见表2。
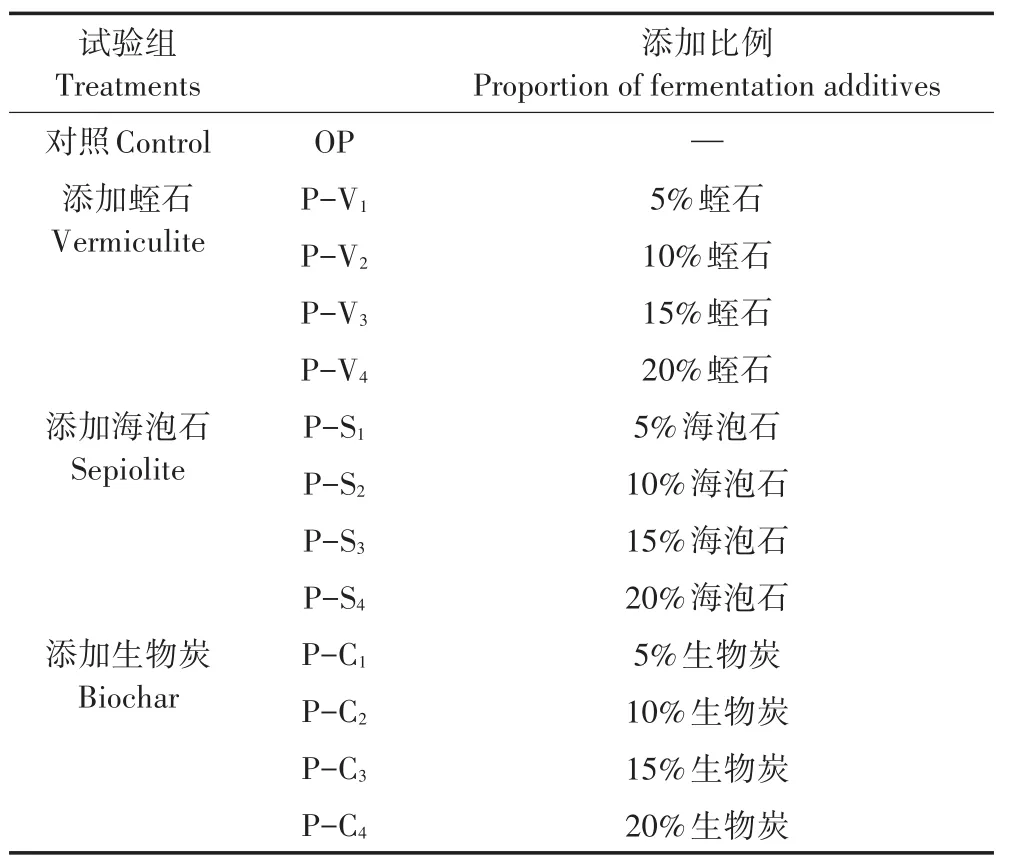
表2 试验设计Table 2 Experiment design
在厌氧反应器内添加新鲜猪粪和接种物共610±5 g(VS比为3∶1),按猪粪TS的5%、10%、15%和20%加入对应添加剂,混合均匀后将反应器加盖密封,将3 L气体收集袋与反应器排气口连接,反应器置于(37±1)℃的恒温水浴锅内进行发酵。发酵过程中,根据实际产气情况,每1~3 d测量1次沼气产量,并取气样进行组分分析。每3 d从发酵罐侧面下部取样口采集1次发酵样品,测量pH值、挥发性有机酸(VFAs)和氨氮等质量浓度。取样时,用取样勺快速抽取发酵罐内的样品,避免空气进入罐内影响发酵进行。取样结束后,将取样阀门紧闭,放入恒温水浴锅继续发酵。
1.4 分析方法
TS和VS采用重量法测定;氨氮采用纳氏试剂分光光度法测量(HACH,DR 6000)[8];pH值:用超纯水将发酵样品稀释10倍(质量)后pH计测量;总有机酸(TVFAs):样品稀释10倍后的溶液用质量百分数为3%的稀硫酸调节pH<3.0,10 000 r·min-1离心10 min,0.45m纤维素滤膜过滤,滤液经丙酮稀释后采用Thermo-trace-1300气相色谱仪测定VFAs(乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸)质量浓度,气相色谱配M12毛细管柱(30 m×0.53 mm×1m),载气为He(恒流:7.00 mL·min-1),进样口温度200℃,FID温度220℃。根据胡荣笃[9]的计算方法,将发酵液中各种脂肪酸的浓度换算成乙酸的浓度来计算分析,TVFAs浓度(以乙酸计)为各种VFA浓度(以乙酸计)之和。
沼气体积用湿式气体流量计测量,沼气中甲烷体积分数采用气相色谱仪(Thermo-trace-1300,TCD)测定,PP-Q色谱柱(2m×φ2 mm),He为载气(75 kPa恒压),炉温40℃,进样口和检测器温度均为200℃。
1.5 动力学模型
采用修正的Gompertz模型模拟试验过程中的累积VS产甲烷量[10]。模型方程:
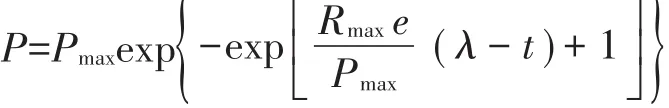
式中:P为累积VS产甲烷量,mL·g-1;Pmax为最大产气潜能,mL·g-1;Rmax为最大产甲烷率,mL·g-1·d-1;λ为迟滞期,d;t为时间,d;e为exp(1)=2.718 3。根据模拟结果推算发酵过程中甲烷日产气率。
2 结果与讨论
2.1 厌氧干发酵过程VFAs变化
图1为各处理发酵过程中TVFAs、乙酸和丙酸的质量浓度变化曲线。图1a至图1c中显示,在前7 d各处理组的TVFAs质量浓度不断上升,这是由于在反应前期,有机物被水解产酸细菌分解成VFAs,由于水解产酸细菌的生长速度超过产甲烷菌,使得产生的VFAs不能被及时分解,各组的TVFAs浓度不断上升[11]。OP组在发酵过程中TVFAs质量浓度始终高于其他处理组,对产甲烷作用产生强烈抑制,这与孔德望的研究结果一致[12]。Zhu等[13]在秸秆厌氧干发酵中发现,当VFAs浓度达到16.7~20.1 mg·g-1时,对产甲烷菌具有明显抑制作用,但在猪粪发酵中不一定会抑制,这可能与猪粪发酵体系具有较好的缓冲能力有关。发酵前40 d TVFAs质量浓度高于7.9 mg·g-1,发酵后期(第45 d后)在1.3~15.6 mg·g-1范围内波动。发酵周期内,添加剂组TVFAs质量浓度均低于OP组,且在第25 d后迅速降低。由此可见,添加蛭石、海泡石和生物炭均能促进体系产生的VFAs分解,降低发酵体系中TVFAs的质量浓度。P-V和P-C组中,随着添加剂添加比例的增加,TVFAs质量浓度呈降低趋势。P-S组不同添加比例间的差异不明显,两个TVFAs浓度峰值分别是 27.5 mg·g-1和24.0 mg·g-1,与PV、P-C组添加量20%时相近。蛭石的作用主要是因为其具有良好的阳离子交换性和吸附性,可以加快并提高底物的水解、酸化进程[14]。生物炭具有多孔结构,比表面积大且碱度较高,能够降低干发酵体系TVFAs质量浓度,有效缓解酸抑制现象,与湿式发酵中添加生物炭具有类似效果[15-17]。海泡石在厌氧发酵领域未见应用,但其良好的吸附性、流变性和催化性,可能是缓解厌氧干发酵酸积累的主要原因。
图1d至图1f显示,不同处理组乙酸的质量浓度变化趋势与TVFAs相似。OP组在第7 d和第30 d有两个峰值(9.6 mg·g-1和8.0 mg·g-1),这主要是由猪粪不同有机质成分的降解难易程度决定的[18]。在添加剂比例最低的P-V1和P-S1处理中,乙酸在第7~10 d和第25 d表现出两个明显的峰值(P-V1:9.2、8.6 mg·g-1,P-S1:8.0、6.0 mg·g-1),与OP相比高峰时间提前,当添加剂比例高于10%时第二个峰值消失;P-C组中各添加比例的乙酸浓度只有一个峰值。表明生物炭、蛭石和海泡石能够促进发酵过程中不易降解组分的生物转化,且生物炭作用最明显。TVFAs中乙酸浓度占比显示,在发酵前17 d,是否加入添加剂及添加比例对乙酸质量百分比均没有明显影响,在第20 d以后,随着添加剂添加比例的增加,乙酸百分含量逐渐降低,表明发酵过程中乙酸被产甲烷菌转化为甲烷。
丙酸质量浓度变化(图1g至图1i)与乙酸完全不同。首先,与OP组相比,添加剂的种类和添加比例对丙酸质量浓度无明显差异,在发酵的前46 d,除P-C2、P-C3和P-C4外的处理组丙酸质量浓度在1.56~5.34 mg·g-1之间波动,总体呈缓慢上升趋势,说明不易降解的丙酸在发酵体系中逐渐累积。除P-C4外,丙酸在TVFAs中的比例随发酵时间的延长和添加剂加入比例的增加逐渐由10%~20%升高到30%~76%,这主要是因为发酵过程的产甲烷过程恢复,发酵体系中以乙酸为主的TVFAs质量浓度逐渐降低,转化速率较慢的丙酸在TVFAs中占主导[19]。有文献报道,当TVFAs和丙酸质量浓度达到10.0 g·L-1和2.9 g·L-1时,产甲烷菌活性受到明显抑制,但是当TVFAs质量浓度降低至6.2~8.5 g·L-1时,抑制作用减弱,而在本试验中各处理组的丙酸质量浓度在第17 d前后升高到2.9 mg·g-1,并在一段时间内缓慢升高,但抑制作用并不明显,这可能与猪粪发酵体系中添加剂有较好的缓冲能力有关[20-21]。厌氧发酵体系中添加生物炭能够强化微生物代谢,降低高负荷厌氧消化过程VFAs含量,而且能够强化原料向丙酸转化[22]。Watanabe等[23]以粗甘油为底物,添加生物炭进行厌氧消化的研究也证明生物炭具有强化丙酸生成作用,这可能是本研究中第 14~25 d,P-C2、P-C3和P-C4组丙酸质量浓度随生物炭添加比例增加明显升高、之后迅速降低的原因。综合乙酸和丙酸浓度与其质量百分比,蛭石和生物炭的添加比例以10%为宜,海泡石的添加比例以5%为佳。
2.2 厌氧干发酵pH值变化
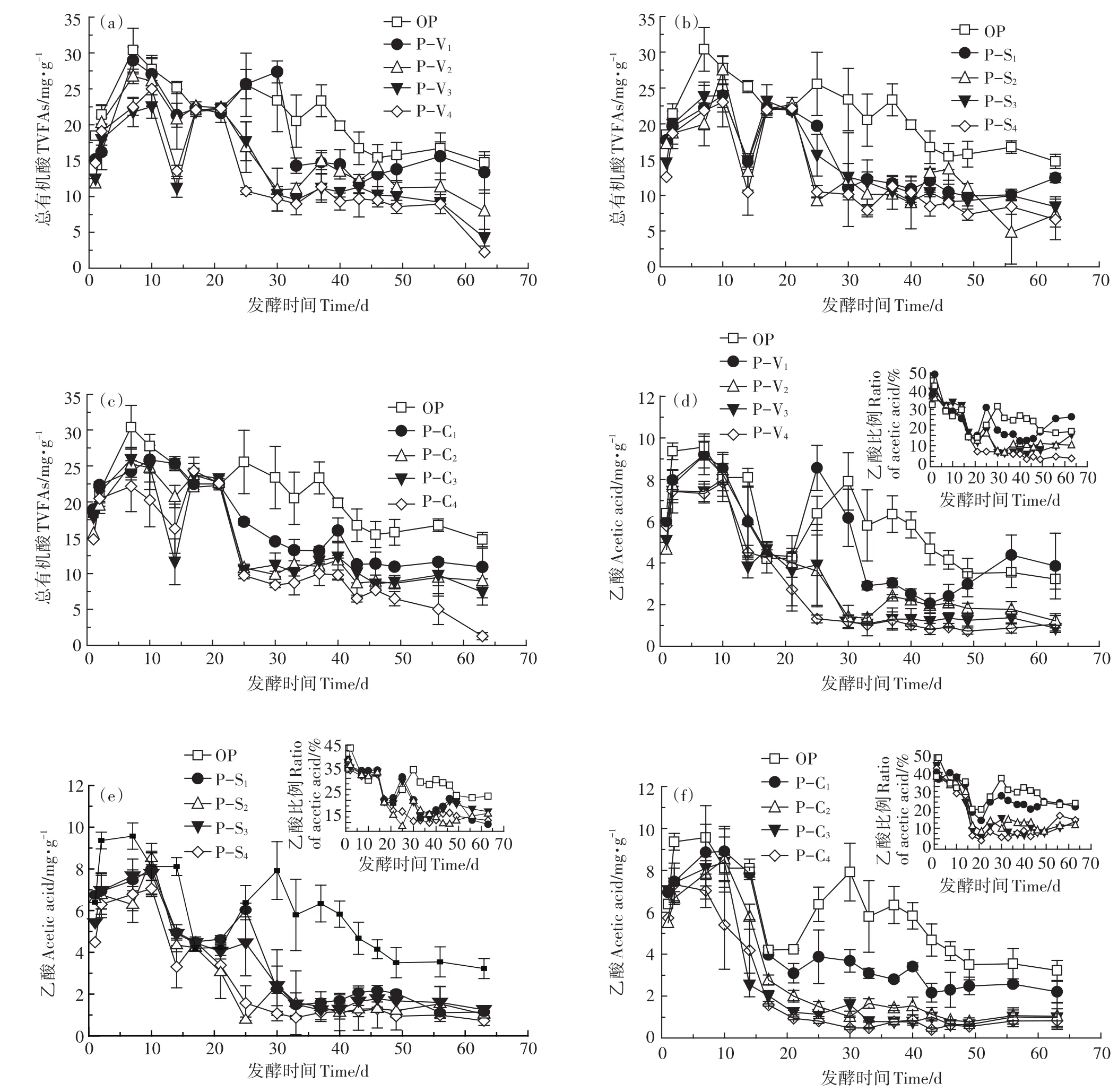
图1 总有机酸(a,b,c)、乙酸(d,e,f)和丙酸(g,h,i)的质量浓度变化Figure 1 Variations of concentrations of total volatile fatty acids(a,b,c),acetic acids(d,e,f)and propionic acids(g,h,i)during the experiment
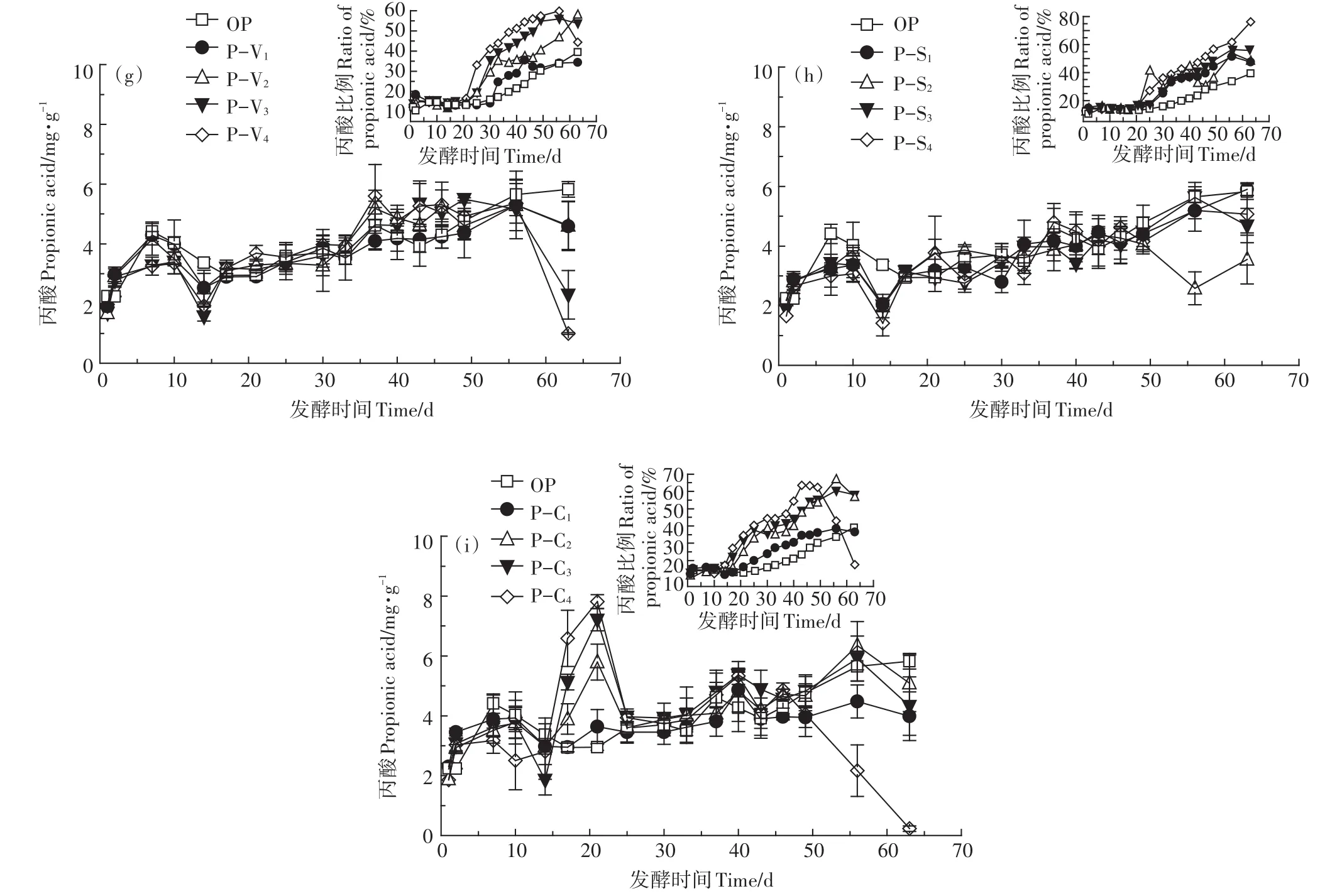
续图1 总有机酸(a,b,c)、乙酸(d,e,f)和丙酸(g,h,i)的质量浓度变化Continued figure 1 Variations of concentrations of total volatile fatty acids(a,b,c),acetic acids(d,e,f)and propionic acids(g,h,i)during the experiment
从图2可以看出,加入添加剂的3组处理pH值变化基本相似,呈先升高后降低再升高最后趋于稳定的总体变化趋势。主要是因为发酵前期水解酸化作用占主导,有机物降解为VFAs,但产甲烷菌消耗VFAs的速率低于水解酸化速率,使pH值降低,随着发酵的进行,产甲烷菌活性渐强,pH值缓慢升高,最后产酸和产甲烷趋于平衡,pH值逐渐稳定。发酵前39 d,PV、P-S和P-C组pH值明显高于OP组,P-V和P-S组pH值在第16 d后升高,而P-C组除5%添加比例以外,其他添加量的试验组在第9 d后缓慢升高,到第39 d前后趋于稳定。发酵中pH值的差异说明3种添加剂对避免有机酸积累具有一定作用,生物炭效果好于蛭石和海泡石。有研究表明,厌氧发酵中添加生物炭能够提高发酵系统稳定性,加快VFAs分解,从而提高发酵体系pH值恢复速度,在高有机负荷下促进互营型甲烷代谢,与本研究结果一致[24-25]。需要注意的是,试验中各处理的pH值均大于7.6,这主要是因为固体样品在取样分析pH值时需进行一定比例的稀释,导致测量值高于实际值。但在整个发酵过程中,pH值与TVFAs变化相对应,说明pH值可以作为厌氧干发酵体系中TVFAs积累和利用的主要指示性指标之一。
2.3 厌氧干发酵产甲烷性能及动力学分析
累积甲烷百分含量(图3a)显示,整个发酵周期内,OP组累积甲烷百分含量为58.0%。当添加比为5%时,P-V和P-C组的累积甲烷百分含量分别为52.4%和48.8%,当添加比为10%时则分别提高到58.5%和58.8%,继续提高添加比时有小幅提升但差异不显著。P-S组不同添加处理的累计甲烷含量在56.2%~60.8%,差异不显著。总体上,添加蛭石、海泡石和生物炭对提高甲烷百分比没有明显促进作用。
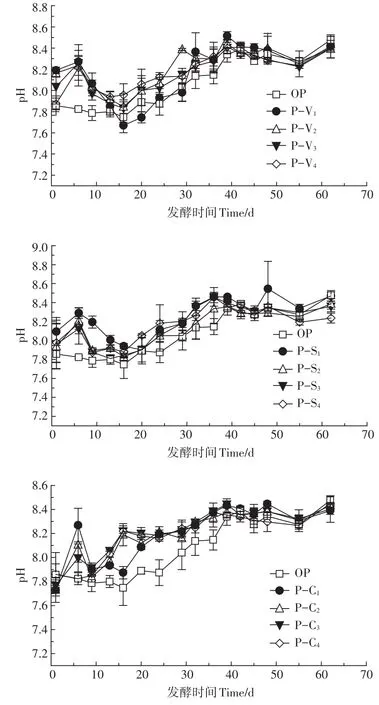
图2 厌氧干发酵pH值变化情况Figure 2 Variations of pH during SS-AD
累积VS甲烷产率柱状图(图3b)与甲烷含量图相对应。由图可知,OP组累积VS甲烷产量为41.8 mL·g-1。P-V1和 P-C1组的累积 VS甲烷产率(31.6 mL·g-1和41.5 mL·g-1)与OP没有显著差异;添加比例为10%时较OP分别提高了99.0%和93.1%,达到83.11 mL·g-1和 80.65 mL·g-1;P-V4和 P-C4组的累积VS甲烷产率分别达到106.4 mL·g-1和126.2 mL·g-1。与P-C和P-V组不同,P-S1组甲烷产率较OP提高了93.8%,显著高于P-V1和P-C1,但当添加比例提高至10%~20%时效果不再明显。生物炭、蛭石和海泡石对甲烷产率的促进作用一方面对体系中pH值变化具有一定的缓冲能力,可以为产甲烷菌提供更加适宜的环境,这在高有机负荷的厌氧干发酵体系中非常重要[26-27]。同时,多孔结构和丰富的比表面积对发酵抑制物质如氨氮(游离氨)、H2S等具有很好的吸附性能。与蛭石和海泡石相比,生物炭具有更好的效果主要是因为生物炭表面富含的K、Ca等离子是微生物生长发育不可或缺的组成成分,提高发酵体系中K离子浓度水平,可促进富含蛋白类原料的生物降解,刺激脱氢酶活性从而提高厌氧发酵微生物的生存能力[28]。另外,生物炭具有导电性,被证明能够促进甲烷古菌和互营菌之间的种间电子直接传递(DIET),从而提高产甲烷效率[29-30],这可能是高有机负荷下添加生物炭具有更佳甲烷产率的重要原因。
用修正的Gompertz模型对干发酵累积VS产甲烷量进行拟合,结果表明(表3),不同处理的拟合曲线呈现较高的拟合度。OP组最大VS产甲烷速率为0.98 mL·g-1,迟滞期18.51 d。除P-V1组最大VS产甲烷速率(0.88 mL·g-1)略低于OP外,其他处理均高于OP组,其中P-V4、P-C4组的最大VS产甲烷速率分别达到3.62 mL·g-1和3.15 mL·g-1。相同添加比例下,发酵迟滞期P-C<P-V<P-S。在湿式发酵体系中添加生物炭能够有效缩短迟滞期、提高甲烷产率已有报道[31-32],本研究结果表明厌氧干发酵中添加生物炭具有相似的作用。用修正的Gompertz模型模拟结果计算日VS甲烷产率见图3c至图3e。由图可以看出,各处理日VS产气率变化趋势为先上升后下降,不同添加剂能够使产气高峰提前,增加日VS甲烷产率,除P-V1外添加比例越大效果越明显。实际厌氧干发酵工程中,可以根据发酵产物利用方式、产气要求等实际情况,调整添加比例。
2.4 氨氮质量浓度变化
氨氮是厌氧发酵需要关注的重要指标之一,其质量浓度过高会抑制微生物的产甲烷作用。图4为厌氧干发酵过程中氨氮质量浓度变化曲线,图中显示,发酵周期内OP、P-V、P-S和P-C处理的氨氮质量浓度均呈缓慢升高趋势,总体随添加比例的增加而降低。有研究表明,在厌氧湿发酵中氨氮质量浓度高于4.2 g·L-1时产甲烷菌失去活性[33]。陈闯等[34]对猪粪的干发酵研究结果显示,当氨氮质量浓度从2.3 mg·g-1升高到3.8 mg·g-1时,产气速率降低74.1%。本研究中,发酵前期不同处理氨氮质量浓度基本高于3.0 mg·g-1,第20 d后高于3.6 mg·g-1。综合各处理产气情况,P-V、P-S和P-C组添加比例为20%时,分别在第23、31 d和第21 d达到组内日VS甲烷产率最大值,分别是 3.62、2.87 mL·g-1和 3.15 mL·g-1,与之对应的氨氮质量浓度为4.5、4.4 mg·g-1和4.3 mg·g-1,说明试验中较高的氨氮质量浓度没有对发酵产气产生明显抑制,原因可能是添加剂的加入增加了体系的缓冲能力,使氨氮主要以铵态氮形式存在,游离氨的毒性减弱,与Pan等[24]研究结果一致。蛭石主要通过阳离子交换作用吸附氨氮,而且阳离子交换速率快[35],当发酵体系中氨氮浓度较高时,具有一定的竞争吸附优势。另外,氨氮被吸附后,促使游离氨向铵态氮转化从而减轻对产甲烷微生物的抑制作用。海泡石表面有大量的酸性和碱性中心,具有较强的极性,能够优先吸附极性较强的物质,近年研究表明,海泡石的微孔体积及非微孔型表面积对NH3、SO2等具有很好的吸附性,从而减轻氨氮对产甲烷微生物活性的抑制[36]。
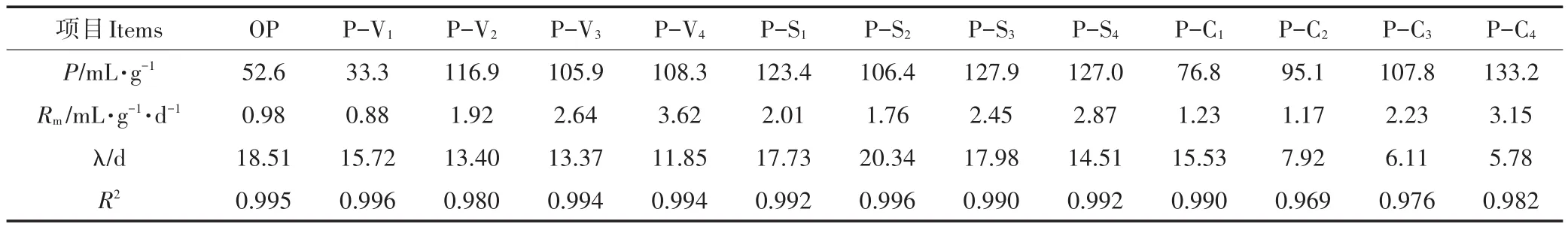
表3 修正的Gompertz方程参数Table 3 Parameters of modified Gompertz model
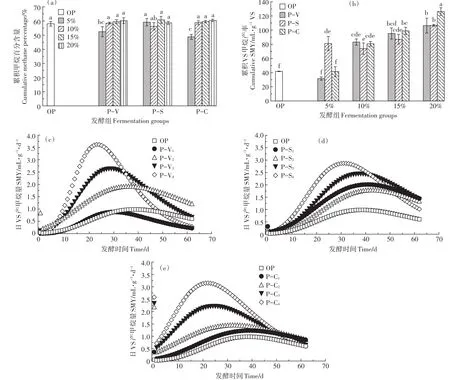
图3 累积甲烷百分含量(a)、累积VS甲烷产率(b)和日VS甲烷产量(c、d、e)变化情况Figure 3 Variations of cumulative methane percentage(a),cumulative special methane yield(b)and specific methane yield(c,d,e)during SS-AD experiment
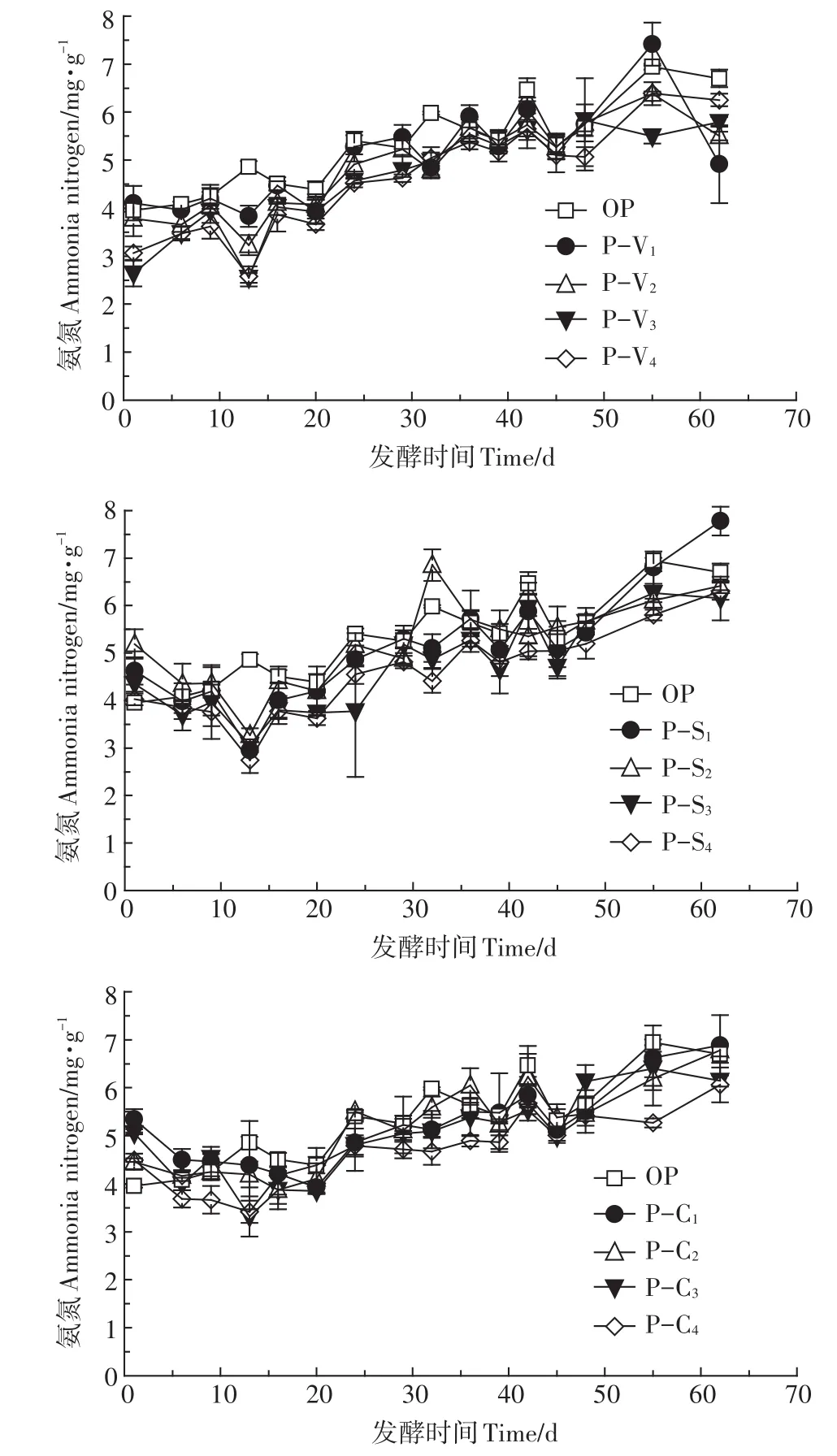
图4 厌氧干发酵过程中氨氮质量浓度变化Figure 4 Variation of ammonia nitrogen in SS-AD
3 结论
(1)蛭石、海泡石和生物炭3种添加剂能够缓解猪粪厌氧干发酵的酸抑制,提高甲烷产率,总体上生物炭效果优于蛭石和海泡石。
(2)相比蛭石和海泡石,生物炭能显著缩短迟滞期,对缩短发酵周期具有重要作用,当添加比例为20%时,累积VS甲烷产率达到126.2 mL·g-1,迟滞期缩短至5.78 d。
(3)综合考虑,生物炭、蛭石和海泡石添加比例分别选择为10%、10%和5%,实际应用中可以根据发酵产气及发酵后残余物的利用方式等实际情况,适当调整添加比例。
(4)添加剂的加入能促进厌氧发酵性能,主要体现在缓解有机酸积累、增加发酵体系缓冲能力及对发酵体系有毒有害物质的吸附等。
