通督醒神针法对血管性痴呆模型大鼠海马神经再生的影响*
2019-08-26沙丽丽吴咚咚侯志涛徐文源
田 玥,王 墨,李 岩,沙丽丽,吴咚咚,侯志涛,徐文源,邵 霜
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 1500040;3.黑龙江省中医研究院,黑龙江 哈尔滨 150036)
血管性痴呆(Vascular dementia,VD)是指由缺血性、出血性脑卒中和相应脑区低灌注损害记忆、认知与行为所致的严重认知功能障碍综合征[1],其临床表现为执行功能受损显著,如制订目标、计划性、主动性、组织性和抽象思维以及冲突的能力下降;常有近记忆力和计算力的减低。常伴焦虑、抑郁或欣快等异常精神症状。严重影响病人的工作和生活,并给患者家属和社会造成了很大的负担。本实验结合中医学优势,采用通督醒神针法针刺治疗血管性痴呆。针刺可加强经脉之间的联系,激发经气、疏通经气脉络、调整脏腑气血功能。本研究采用国际通认的大鼠双侧颈总动脉结扎法建立VD损伤模型[2],从整体水平研究通督醒神针法抗VD的有效性,并从细胞、分子水平等层面探讨通督醒神针法治疗VD损伤的作用机制,为其临床应用提供更为坚实的理论基础,为通督醒神针法对血管性痴呆模型大鼠海马神经再生的影响提供新的思路。
1 实验材料
1.1 实验动物
健康成年雄性SD大鼠,体质量(200±20)g,由黑龙江中医药大学动物实验中心供应,动物合格编号:SCXK(黑)2008-004。
1.2 主要仪器与试剂
安迪牌针灸针(0.25 mm×25 mm,贵州安迪药械有限公司);JJ3000型精密电子天平(常熟双杰测试仪器厂);Morris水迷宫(中国医学科学院药物所);奥林巴斯BX51显微镜(奥林巴斯BS-51显微镜);德国菜卡2135型切片机(美国moticam3000显微摄影成像系统);上海一恒电热恒温箱;医用微波炉;兔抗BDNF多克隆抗体(北京博奥森);DAB显色剂(北京中山);国产分析纯。
1.3 主要药品
水合氯醛(天津华津制药);盐酸多奈哌齐片[安理申,卫材(中国)药业有限公司,批准文号:国药准字H20160978]。
2 实验方法
2.1 动物分组及模型制作
将SD大鼠60只,适应性饲养3天后,采用双侧颈总动脉结扎法建立VD损伤模型。用水迷宫检测法筛选成模大鼠纳入实验。将造模成功大鼠36只,随机分为模型组、药物组、空白组、针刺1天组、针刺3天组、针刺7天组,每组6只。
2.2 干预方法
药物组按体重1 mg/(kg·d)盐酸多奈哌齐溶于2 mL生理盐水中灌胃,以后每日早晨灌胃,连续给药14天。
针刺1天组用通督醒神针法取百会、神庭、人中针刺(参照林文注等编著的《实验针灸学》选穴)针刺方向为斜刺,深度0.2~0.3 mm,针后捻转,200~220 r/min,捻转1 min,留针30 min,每日1次,连续治疗1天。针刺3天组治法同上,连续治疗3天。针刺7天组治法同上,连续治疗7天。
空白组和模型组大鼠不针刺,但捕捉和束缚同针刺组。
2.3 观察指标与检测
2.3.1 实验动物标本采集 药物组、针刺1天组、针刺3天组、针刺7天组分别治疗结束后,大鼠灌注取脑,用10%水合氯醛(35 mg/kg)腹腔注射进行麻醉,断头取脑,沿枕骨下剪断鼠头,剪开鼠枕骨,用止血钳撬开鼠头骨,充分暴露脑组织,操作谨慎,勿伤及脑组织,后用止血钳经过颅底分离脑组织。分别用4%多聚甲醛溶液固定。
2.3.2 检测指标 大鼠行为学观察:在大鼠造模前、造模后、药物治疗后、针刺治疗相应时间后,均运用Morris水迷宫观察各组大鼠学习记忆能力。
Morris水迷宫实验分为定位航行实验和空间探索实验:①定位航行实验:将大鼠面向池壁放入水中,放入位置随机取第Ⅱ、Ⅲ、Ⅳ象限的起始位置之一,平台位置为第Ⅰ象限,记录大鼠120 s内从入水到爬上平台所需时间,超过120 s记为120 s,即逃避潜伏期;②空间探索实验:大鼠学会寻找平台后撤除水下平台,开始90 s的探索训练。将大鼠由原平台的对侧,即第Ⅲ象限固定位置面向池壁放入水中,记录大鼠在90 s内穿越原平台相应位置的次数。
大鼠经灌注取脑后,4%多聚甲醛固定,常规石蜡包埋、切片,组织修块后,采用免疫组化PV二步法检测海马组织CA1区脑源性神经生长因子(Brain-derived neurotrophic factor,BDNF)、酪氨酸蛋白激酶受体B(TrkB)表达,PV二步法免疫组化,显微镜下观察。
2.3.3 显微镜观察 Motic3000显微摄影系统于400倍下摄片,采用Image-pro plus6.0病理图像分析系统对阳性表达进行分析,以阳性细胞数目代表蛋白表达量,每组随机分析6个高倍镜视野。染色结果细胞核呈蓝色,蛋白表达位于神经细胞胞质中,阳性表达为棕褐色。
2.4 统计学分析
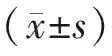
3 结果
3.1 各组Morris水迷宫测定结果
各组Morris水迷宫测定结果:与空白组比较,模型组大鼠测定有统计学意义(P<0.05),模型组大鼠潜伏时间增长,穿越次数减少;与模型组比较,药物组、针刺组大鼠测定有统计学意义(P<0.05),药物组、针刺组大鼠潜伏时间缩短,穿越次数增加;与药物组比较,针刺组大鼠测定有统计学意义(P<0.05),针刺组大鼠潜伏时间缩短,穿越平台次数增加。见表1。
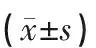
表1 各组大鼠平台逃避潜伏期和穿越次数测定
注:与空白组比较,*P<0.05;与模型组比较,△P<0.05;与药物组比较,#P<0.05。
3.2 各组大鼠海马组织CA1区BDNF表达结果比较
大鼠BDNF表达结果:与空白组相比,模型组具有明显的统计学意义(P<0.01),模型组大鼠海马组织CA1区BDNF具有神经元损伤的保护作用;与模型组比较,药物组、针刺组具有统计学意义(P<0.05),药物组、针刺组大鼠海马组织CA1区神经元受BDNF促进神经细胞保护作用;与药物组比较,针刺组无统计学差异(P>0.05)。见表2。
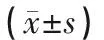
表2 各组大鼠海马组织CA1区BDNF表达结果比较
注:与空白组比较,*P<0.01;与模型组比较,△P<0.05;与药物组比较,▲P>0.05。
3.3 各组大鼠海马组织CA1区TrkB表达结果比较
大鼠TrkB表达结果:与空白组相比,模型组具有明显的统计学意义(P<0.01),模型组大鼠海马组织CA1区神经元存活;与模型组比,药物组、针刺组具有统计学意义(P<0.05),药物组、针刺组大鼠海马组织CA1区神经再生通路被激活;与药物组比,针刺组无统计学差异(P>0.05)。见表3。
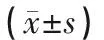
表3 各组大鼠海马组织CA1区TrkB表达结果比较
注:与空白组比较,*P<0.01;与模型组比较,△P<0.05;与药物组比较,▲P>0.05。
3.4 各组大鼠海马组织CA1区免疫组化检测结果
由图1可见,各组大鼠海马组织CA1区内均可见BDNF蛋白表达,与空白组相比,模型组大鼠BDNF蛋白表达水平明显上调;与模型组对比,针刺组、药物组大鼠BDNF蛋白表达水平明显上调;与药物组比较,针刺组的BDNF蛋白表达水平未见明显上调。
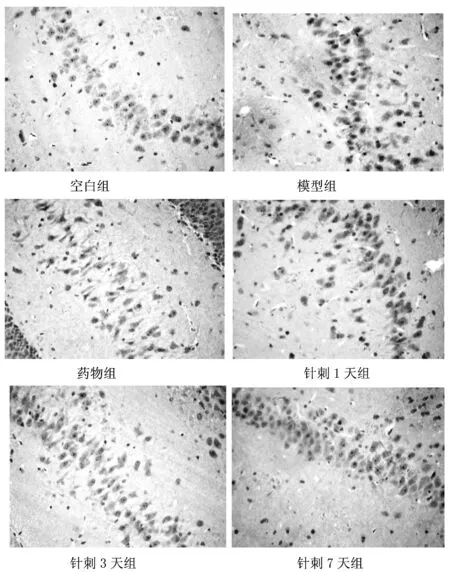
图1 各组大鼠海马组织中BDNF蛋白表达(400×)
4 讨论
血管性痴呆(VD)是脑血管病导致认知功能障碍的重要临床类型[3]。缺血导致脑部血流中止,引起脑能量缺失和离子动态平衡的紊乱,启动脑内大规模的级联损伤反应[4],其病理机制复杂[5],目前国际通认的主要机制有能量代谢障碍、兴奋性氨基酸毒性、炎症介质、细胞凋亡、氧自由基堆积等;在VD脑组织中,氧和葡萄糖代谢障碍、Ca2+大量内流等原因,是导致组织细胞死亡的根本原因。脑源性神经生长因子(BDNF),对运动神经和其他中枢和外周神经是一个有效的生长因子,主要分布于脑,在心、肺和脊髓运动神经元的外周靶组织中也有一定分布。BDNF主要在中枢神经系统合成,对促进神经元的存活至关重要。脑源性神经生长因子BDNF可以作为信号传导通路的配体与其受体酪氨酸蛋白激酶(TrkB)特异性结合,结合后可激活细胞内信号传导通路参与促进神经元细胞发育、分化、再生[6]。BDNF最初是从猪脑中纯化出来的碱性蛋白,生理状态下以二聚体形式存在。实验研究证实逆向转运新生小鼠的BDNF能够阻止受损伤诱导的面部神经运动神经元死亡。同时还改善组织学变化,促进神经生长[7]。
BDNF促进受损神经元的再生及分化,在中枢神经系统损伤修复中具有重要的作用。BDNF是通过与其特异性受体TrkB结合而实现对缺血区域神经再生、损伤修复等效应。研究表明,脑缺血后BDNF/TrkB水平增高能够提高神经元的抗损伤能力[8]。另有学者认为,针刺可促进上调脑缺血损伤大鼠的BDNF表达水平保护和修复受损神经元[9]。另有研究表明,头穴丛刺法可能通过上调缺血区脑组织中的BDNF蛋白表达水平,从而起到对脑组织神经保护作用[10]。本研究发现,针刺和盐酸多奈哌齐片(安理申)治疗均可以提高血管性痴呆模型大鼠海马组织内BDNF与TrkB蛋白的表达水平,通督醒神针法能明显改善VD大鼠的学习记忆能力[11]。通督醒神针法通过针刺督脉神庭、百会、人中穴,刺激脑部,影响缺血海马组织神经元,使其缺血CA1区BDNF与TrkB蛋白表达水平提高。相关研究表明,BNDF基因能有效抑制细胞凋亡,与细胞增殖密切相关,激活非增殖细胞,延长细胞存活时间。因此这可能是针刺抑制细胞凋亡、促进细胞再生的主要因素。综上,血管性痴呆模型大鼠海马内细胞凋亡明显增加,海马细胞凋亡可能是血管性痴呆的病理生理机制之一,针刺干预时海马组织BDNF与TrkB蛋白的表达水平增高,可以促进神经细胞再生,具有防治血管性痴呆的能力。
