胶质母细胞瘤中HOXD10基因启动子的甲基化检测及与预后的关系*
2019-08-23李明轩方琪星任虹宇司昊天马建功王晓彬张小广方树民
李明轩,方琪星,任虹宇,司昊天,马建功,王晓彬,张小广,方树民,何 承
河南大学第一附属医院 神经外科(开封 475000)
胶质瘤是中枢神经系统最常见的恶性肿瘤,包括胶质母细胞瘤(glioblastoma,GBM)、星形细胞瘤、室管膜瘤等类型,其中GBM的恶性程度最高[1]。GBM以手术切除为主,辅助放、化疗等综合治疗。目前,GBM患者的生存率和生存质量依然较低[2],探索治疗GBM的新思路或新方法一直是研究的难点和重点。DNA甲基化是最常见的表观遗传变化,可影响DNA与其他分子的相互作用,与基因沉默、细胞正常功能的维持、肿瘤的发生和发展等关系密切。研究[3]发现,DNA异常甲基化还可用于预测肿瘤复发、转移以及作为分子标记物评估肿瘤患者预后。同源盒(homeobox,HOX)基因是一类同源异性基因,除能够调控正常细胞发育、分化外,在组织细胞增殖和侵袭中也发挥关键调节作用[4]。HOX D10基因是HOX家族成员之一,其表达水平与结直肠癌、胃癌、胆管癌等多种恶性肿瘤的恶性程度关系密切,参与肿瘤的发生和发展过程[5-7]。目前,GBM中HOXD10基因启动子甲基化的状态研究还未有报道。本研究通过检测GBM患者HOXD10基因启动子的甲基化状态,分析其与患者预后的相关性,以期为GBM的预后评估提供一定的理论依据,现报道如下。
1 资料与方法
1.1 临床资料
收集河南大学第一附属医院2015年8月至2017年9月经确诊并行手术治疗的49例GBM标本,其中男25例,女24例,年龄26~81(58.63±8.49)岁。术前均未行放、化疗等治疗,患者临床资料完整,病理诊断明确。肿瘤组织按《WHO中枢神经系统肿瘤分类(2007)》病理分级,Ⅰ级10例,Ⅱ级9例,Ⅲ级13例,Ⅳ级17例。另选取30例正常脑组织标本(脑外伤组织、内减压脑组织等)作为对照,其中男15例,女15例,年龄28~80(60.27±9.51)岁。两组在性别、年龄等方面比较差异无统计学意义(P>0.05),具有可比性。本研究经河南大学第一附属医院伦理委员会批准同意。受试者知情并自愿签署知情同意书。
1.2 主要试剂和实验仪器
DNeasy Tissue Kit试剂盒,美国Sigma公司;DNA聚合酶,日本TaKaRa公司;CpGenome TM DNA Modification Kit试剂盒,美国Merck Millipore公司;Wizard Clean up DNA纯化试剂盒,美国Promega公司;HOXD10基因启动子甲基化PCR引物由生工生物工程(上海)股份有限公司合成。鼠抗人HOXD10单克隆抗体,英国Abcam公司;生物素标记的羊抗鼠IgG,北京中杉金桥生物技术有限公司。超微量分光光度计,美谷分子仪器(上海)有限公司;显微镜,日本Nikon公司。
1.3 特异性PCR检测HOXD10基因启动子甲基化
取组织标本,按照D Neasy Tissue Kit试剂盒操作说明提取DNA。超微量分光光度计检测提取的DNA纯度和浓度。DNA样本在260 nm和280 nm处的吸光度的比值>1.8时可用于后续实验。然后按照CpGenomeTMDNA Modification Kit试剂盒操作说明对提取的DNA 进行修饰。DNA修饰后对其进行纯化,具体操作参照Wizard Clean up DNA纯化试剂盒操作说明。纯化后的DNA重悬于超纯水中,-20 ℃保存备用。采用PCR技术对纯化后的DNA进行扩增。HOXD10甲基化上游引物5'-TTATTTATGGGGATTCGGGTTC-3',下游引物5'-AAAAAAACCGAATCCAAAAC AAACG-3';非甲基化上游引物5'-ATTTAT TTATGGGG-ATTTGGGTTT-3',非甲基化下游引物5'-AAAAAAACCAAATCCAAACAAACA-3'。反应条件:95 ℃预变性3 min,95 ℃30 s,60 ℃30 s,72 ℃30 s,经40个循环后72 ℃延伸10 min。取10 μL PCR扩增产物进行琼脂糖凝胶电泳,EB染色后于凝胶成像系统观察结果。以无菌超纯水代替DNA作为空白对照。甲基化结果判断:M有特异产物,而U无产物,为完全甲基化阳性;M和U两者都有特异产物,为部分甲基化阳性;如果U有特异产物,而M无产物,为甲基化阴性。完全甲基化阳性和部分甲基化阳性均记为甲基化阳性。
1.4 免疫组织化学法检测HOXD10蛋白表达
组织标本经常规脱蜡处理、梯度乙醇水化、抗原修复后,置于pH 6.0的枸橼酸钠缓冲液中,微波加热至沸腾,冷却,PBS清洗。封闭10 min,滴加HOXD10抗体(稀释比1∶800),4 ℃孵育12 h。PBS代替HOXD10抗体作用阴性对照。孵育后洗涤,滴加生物素标记的IgG抗体(稀释比1∶100),4 ℃孵育20 min。之后再滴加辣根酶标记链酶卵白素,4 ℃孵育20 min。孵育后PBS洗涤,滴加DAB显色液,染色5 min。经冲洗、苏木精复染、脱水、封片后显微镜下观察。HOXD10蛋白表达阳性细胞呈棕黄色颗粒,主要定位于细胞核。从每张切片中随机挑选5个高倍视野,统计阳性染色细胞数量。1)按阳性细胞占百分比计分,<5%记为0分,5%~25%记为1分,26%~50%记为2分,51%~75%记为3分,>76%记为4分;2)按染色强度计分为,无色记为0分,淡黄色记为1分,棕黄色记为2分,棕褐色记为3分。取上述两项结果的乘积:≤3分为阴性表达,>3分为阳性表达。
1.5 随访
对患者进行随访,时间1年,记录患者手术之日起至肿瘤复发、转移或死亡时间。末次随访时间截至2018年9月。无进展生存期(progression free survival,PFS)即患者手术之日起至肿瘤复发、转移或残留肿瘤复发生长为止。总生存期(overall survival,OS),即手术之日起至患者死亡为止。对于无复发、转移或死亡的患者,PFS和OS以末次随访时间计算。
1.6 统计学方法

2 结果
2.1 两组HOXD10启动子甲基化状态比较
GBM和正常脑组织HOXD10启动子甲基化阳性率分别为65.31%(32/49)、23.33%(7/30)。与正常脑组织相比,GBM中HOXD10启动子甲基化阳性率升高(P<0.05)(图1)。
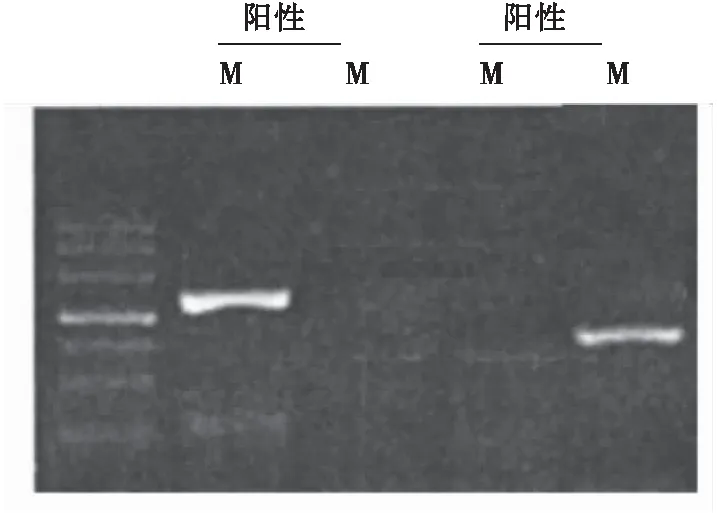
图1 GBM中HOXD10启动子甲基化状态
2.2 HOXD10启动子甲基化状态与患者临床病理特征关系
HOXD10启动子甲基化状态与患者性别、年龄、Karnofsky功能状态评分标准(KPS评分)无关(P>0.05)。肿瘤直径>5 cm患者的HOXD10启动子甲基化阳性率高于肿瘤直径≤5 cm患者(P<0.05),病理分级为高级别(Ⅲ~Ⅳ级)患者HOXD10启动子甲基化阳性率高于病理分级为低级别患者(P<0.05)(表1)。
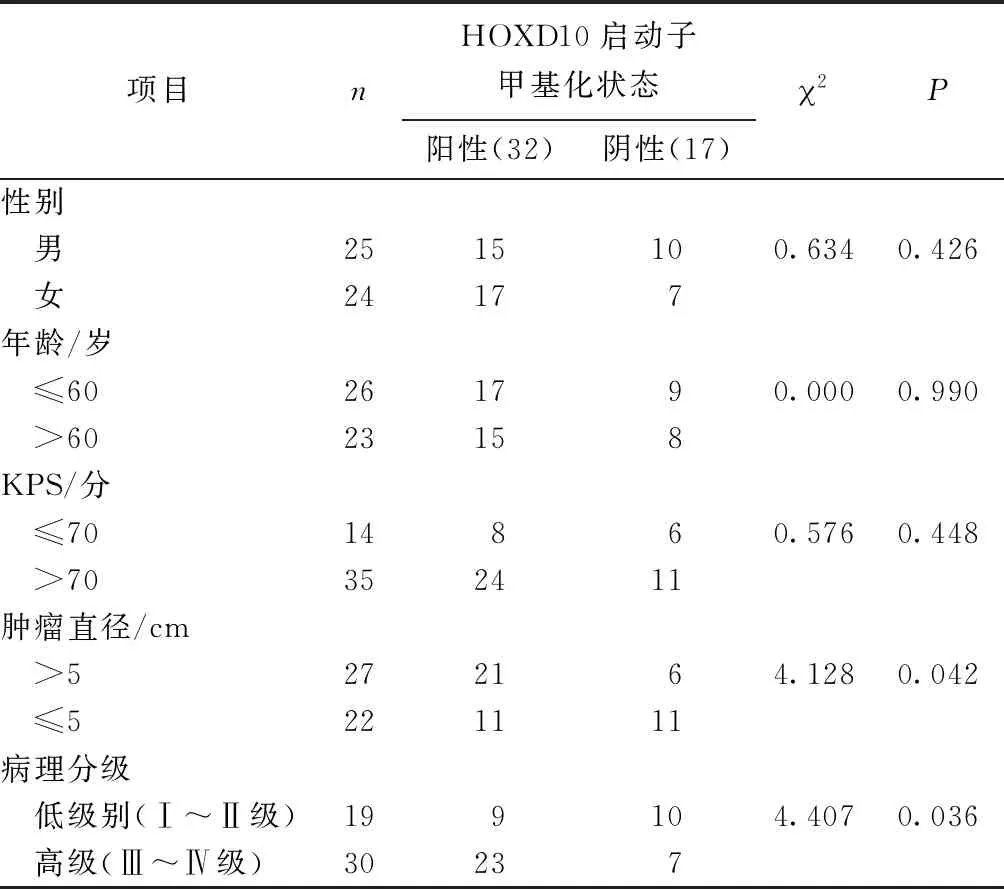
表1 HOXD10启动子甲基化状态与患者临床病理特征关系
2.3 HOXD10启动子甲基化状态与患者预后关系
Kaplan-Meier法分析HOXD10启动子甲基化状态与GBM患者预后(PFS、OS)的关系。结果显示,GBM中HOXD10启动子甲基化阳性患者PFS(21.88%)、OS(9.38%)均低于阴性患者PFS(70.59%)、OS(47.06%)(P<0.05)(图2)。
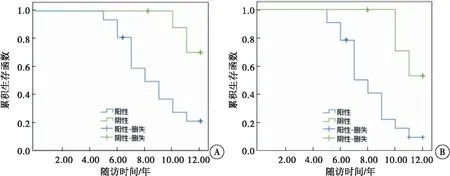
图2 HOXD10启动子甲基化状态与患者预后关系注:A:PFS曲线;B:OS曲线
2.4 Cox比例风险模型分析影响患者预后因素
病理分级和HOXD10基因启动子甲基化状态是影响患者预后的独立危险因素(P<0.05)(表2)。
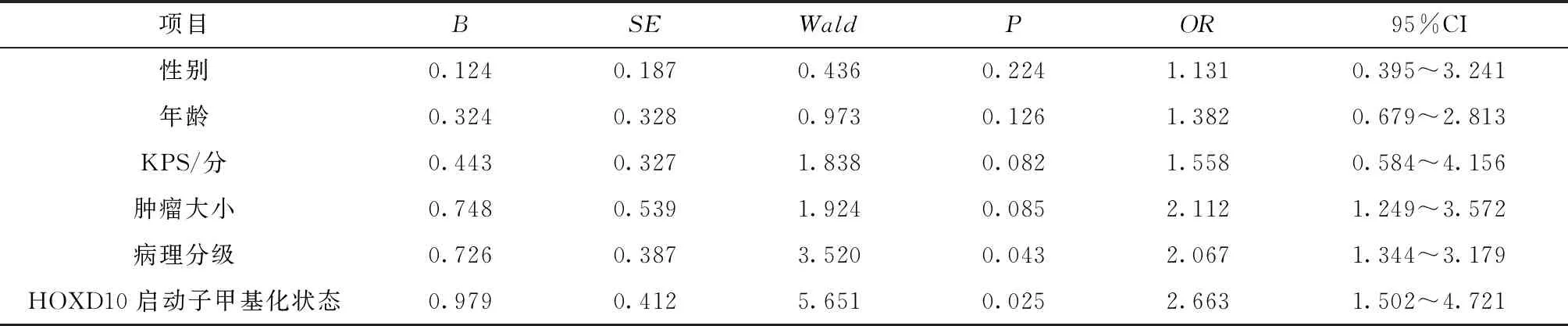
表2 Cox分析影响患者预后因素
2.5 HOXD10蛋白表达比较
免疫组化染色结果显示,正常脑组织和GBM中HOXD10蛋白阳性率分别为76.67%(23/30)、36.73%(18/49),两者差异有统计学意义(P<0.05)。GBM中HOXD10基因启动子甲基化阳性患者HOXD10蛋白阳性率为12.50%(4/32),甲基化阴性患者HOXD10蛋白阳性率82.35%(14/17),两者差异有统计学意义(P<0.05)。Spearman相关性分析结果显示,GBM中HOXD10基因启动子甲基化与其蛋白表达呈负相关(r=-0.731,P<0.05)(图3)。
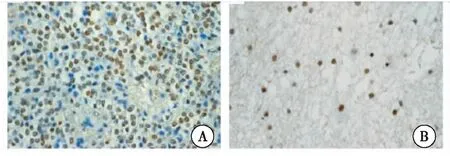
图3 HOXD10蛋白在GBM中表达(×200)
注:A:GBM中HOXD10蛋白阳性;B:GBM中HOXD10蛋白阴性
3 讨论
胶质瘤约占颅内原发性恶性肿瘤的70%,是最常见的原发性中枢神经系统恶性肿瘤。GBM患者人数在胶质瘤中占比约50%,危害性极强,严重威胁患者生命健康[8]。随着医疗水平的不断提高,胶质瘤的治疗手段有了很大的改善,但目前患者的中位生存期依然较短[9],预后不佳,对该疾病病因及预后影响因素的探索具有重要意义。
HOXD10基因位于2号染色体p31位点,可调控细胞生长、发育,抑制细胞外基质重塑和迁移相关基因的表达,在多种肿瘤中表达异常。Sekar等[10]研究发现,乳腺癌组织中 HOXD10基因表达下调,与肿瘤组织学分级相关,肿瘤等级越高,其表达水平越低,提示HOXD10基因在乳腺癌中发挥重要的肿瘤抑制作用,其丧失会促进导致乳腺癌的发展。李民等[11]研究发现,人脑胶质瘤中HOXD10 mRNA和蛋白均较正常脑组织表达降低,与胶质瘤恶性程度呈负相关。本研究结果显示,胶质母细胞瘤中HOXD10 mRNA和蛋白较正常脑组织降低,与相关报道结果一致。而头颈部鳞状细胞癌(HNSCC)中HOXD10表达水平升高,HOXD10敲低可抑制HNSCC细胞中增殖和侵袭减少,可作为HNSCC预后评估的参考指标,这可能与肿瘤细胞类型不同有关。
DNA甲基化在调节机体生物学过程中发挥重要作用。DNA甲基化可抑制基因转录,造成基因沉默[12]。DNA甲基化造成的抑癌基因活性丧失也是肿瘤发生、发展的重要作用机制之一[13]。研究发现,HOXD10基因启动子在多种肿瘤中甲基化状态异常。杨海霞等[14]研究发现,胆管癌组织中HOXD 10基因启动子甲基化率较癌旁组织明显升高,且癌组织中HOXD10基因启动子甲基化与HOXD10蛋白表达呈负相关,HOXD10基因启动子区存在CpG位点甲基化个数≥7时可用作胆管癌患者预后不良的参考指标。Lin等[15]研究发现,胃癌患者血液中HOXD10甲基化率明显增加,且HOXD10甲基化与幽门螺杆菌状态,血清CA19-9和CEA水平及肿瘤浸润深度有关,HOXD10启动子高甲基化可能是胃癌早期诊断和病情监测的生物标记物。但是GBM中HOXD10基因启动子是否甲基化尚未有报道。本研究结果显示,GBM中HOXD10基因启动子甲基化阳性率高于正常脑组织,且患者病理分级越高,肿瘤直径越大,HOXD10基因启动子甲基化阳性率越高,提示HOXD10基因启动子甲基化参与GBM的发生、发展,与该疾病恶性程度密切相关。HOXD10基因启动子甲基化阳性患者PFS和OS低于阴性表达患者,是影响GBM患者预后的独立危险因素,提示患者HOXD10基因启动子甲基化阳性与患者预后不良相关,可作为患者预后评估的重要生物分子指标。同时,HOXD10基因启动子甲基化趋势与免疫组织化学法检测的HOXD10蛋白表达相反,相关性分析结果显示二者表达呈明显负相关,说明HOXD10基因启动子甲基化造成其蛋白表达沉默。
综上所述,GBM中HOXD10基因启动子甲基化阳性率上调,其阳性表达患者PFS和OS低于阴性表达患者,检测HOXD10基因启动子甲基化状态有助于评估患者预后。
