UPF2介导八肋游仆虫NMD途径SURF和EJC的耦联
2019-08-22柴杨丽吕佳周宝春梁爱华柴宝峰
柴杨丽,吕佳,周宝春,梁爱华,柴宝峰
(山西大学 生物技术研究所 化学生物学与分子工程教育部重点实验室,山西 太原 030006)
0 引言
基因的准确表达对于机体细胞正常的生理活动至关重要,它受到细胞中多种不同分子机制的调控[1-2]。其中无义介导的mRNA降解(nonsense-mediated mRNA decay, NMD)途径能够识别并降解异常的mRNA,如含有提前终止密码子(premature termination codons, PTCs)的无义mRNA(nonsense mRNA),避免这种异常mRNA翻译成潜在截短有毒蛋白质,对机体产生毒害效应[1,3-4]。
NMD途径广泛存在于真核生物。原生动物是一组最早分支的单细胞真核生物,研究这类生物的NMD途径,可以帮助我们理解NMD的起源和进化机制[5]。这种特殊的单细胞真核生物可以利用简单的细胞元件来完成一些较为复杂的代谢和调控过程[6],如在蓝氏贾第虫(Giardialamblia)细胞的NMD途径中,只有UPF1一种核心蛋白质参与无义介导的mRNA降解激活途径[6-7]。几乎在所有的真核生物中,都存在3种UPF蛋白,即UPF1,UPF2和UPF3,但在原生动物中却有一些例外,一般会缺少UPF2或UPF3[6-10]。八肋游仆虫(Euplotesoctocarinatus)是一种单细胞真核生物,在进化上处于特殊地位。基因组分析结果显示该生物仅有UPF1和UPF2,而缺失UPF3[11]。
在NMD途径中,UPF(UPF1、UPF2、UPF3)因子在无义mRNA识别和降解过程中都发挥着重要的作用[1,9,12-14]。UPF1最早在酿酒酵母中发现,是NMD途径中最核心的因子,它的N端有一个富含半胱氨酸和组氨酸的CH(Cys-His)结构域,C端部分具有ATP依赖的RNA解旋酶活性[12-16]。UPF2存在于细胞核和细胞质中[17-18],含有三个保守的MIF4G(middle domain of translation initiation factor 4G)结构域,通过第三个MIF4G结构与UPF3的RRM(RNA recognition motif)相互作用,并通过它的C末端与UPF1的CH结构域结合[9,19-21]。UPF3在细胞核mRNA的加工过程中,与外显子连接复合体(exon-exon junction complex, EJC) 中的Y14相互作用。NMD途径中的SMG1-UPF1-肽链释放因子(SURF)复合体和EJC复合体通过UPF2和UPF3耦联,启动NMD途径,识别无义mRNA[1,3,12,18]。但在八肋游仆虫中,并没有鉴定到UPF3蛋白质。在研究人类NMD途径中UPF2 的功能和结构时,发现它的第二个MIF4G结构在位置上与EJC的核心因子Y14很接近[9,22]。在八肋游仆虫中,UPF2包含三个串联的MIF4G结构和一个C末端UPF1的结合区域。那么,在不存在UPF3的情况下,UPF2是否可以直接将SURF复合体和EJC复合体联系起来呢?
为此,本研究从八肋游仆虫细胞中克隆了UPF1、UPF2和EJC核心因子基因的关键功能域,并对它们的关系进行了分析,以证实UPF2因子在八肋游仆虫细胞NMD途径启动过程中所发挥的作用,为进一步阐明NMD途径的进化和分子机制提供数据支持。
1 材料与方法
1.1 实验材料,菌株和质粒
所用实验材料为八肋游仆虫;菌株有E.coliDH5α,E.coliBL21和酵母菌株AH109;质粒有大肠杆菌蛋白表达质粒pGEX-6p-1和pET-28a,酵母双杂交载体pGADT7和pGBKT7,均为实验室所保存。
1.2 主要试剂
反转录试剂盒(EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix)和胶回收试剂盒(EasyPure Quick Gel Extraction Kit),Anti-GST和Anti-His抗体均购于北京全式金生物技术有限公司;质粒提取试剂盒(Plasmid Mini Kit I)购于OMEGA公司;各种酶制剂(BamH I,EcoR I,XhoI,SalI 等)均购于TaKaRa公司;寡聚核苷酸引物由华大基因合成。
1.3 序列检索和分析
在NCBI Homologene数据库(https:∥www.ncbi.nlm.nih.gov/homologene)中鉴定到UPF2因子同系物,使用MEGA7(MEGA 7.0.14)软件对EoUPF2及其他UPF2的24个同系物构建了系统进化树;用DNASTAR.Lasergene.v7.1软件比对核酸和蛋白序列,设计基因扩增引物。
1.4 八肋游仆虫cDNA的获得
采用离心法大量富集八肋游仆虫,TRIZOL试剂快速提取法提取其总RNA并检测浓度和纯度;利用反转录试剂盒将得到的RNA反转录成cDNA。
1.5 重组质粒的构建
以八肋游仆虫cDNA为模板,利用表1的特异性引物,扩增目的基因片段。对目的基因片段与对应载体pGADT7和pGBKT7进行酶切,T4 DNA连接酶16℃过夜连接,得到酵母双杂交的重组质粒pGADT7-EoUPF2-MIF4G-2、pGADT7-EoUPF2-MIF4G-3、pGBKT7-EoY14a-RRM和pGBKT7-EoY14b-RRM。 基于pET-28a和pGEX-6p-1构建Pull-down实验的重组质粒pET-28a-EoUPF2-MIF4G-2、pET-28a-EoUPF2-MIF4G-3、pGEX-6p-1-EoY14a-RRM和pGEX-6p-1-EoY14b-RRM。各重组质粒测序正确后用于下一步实验。
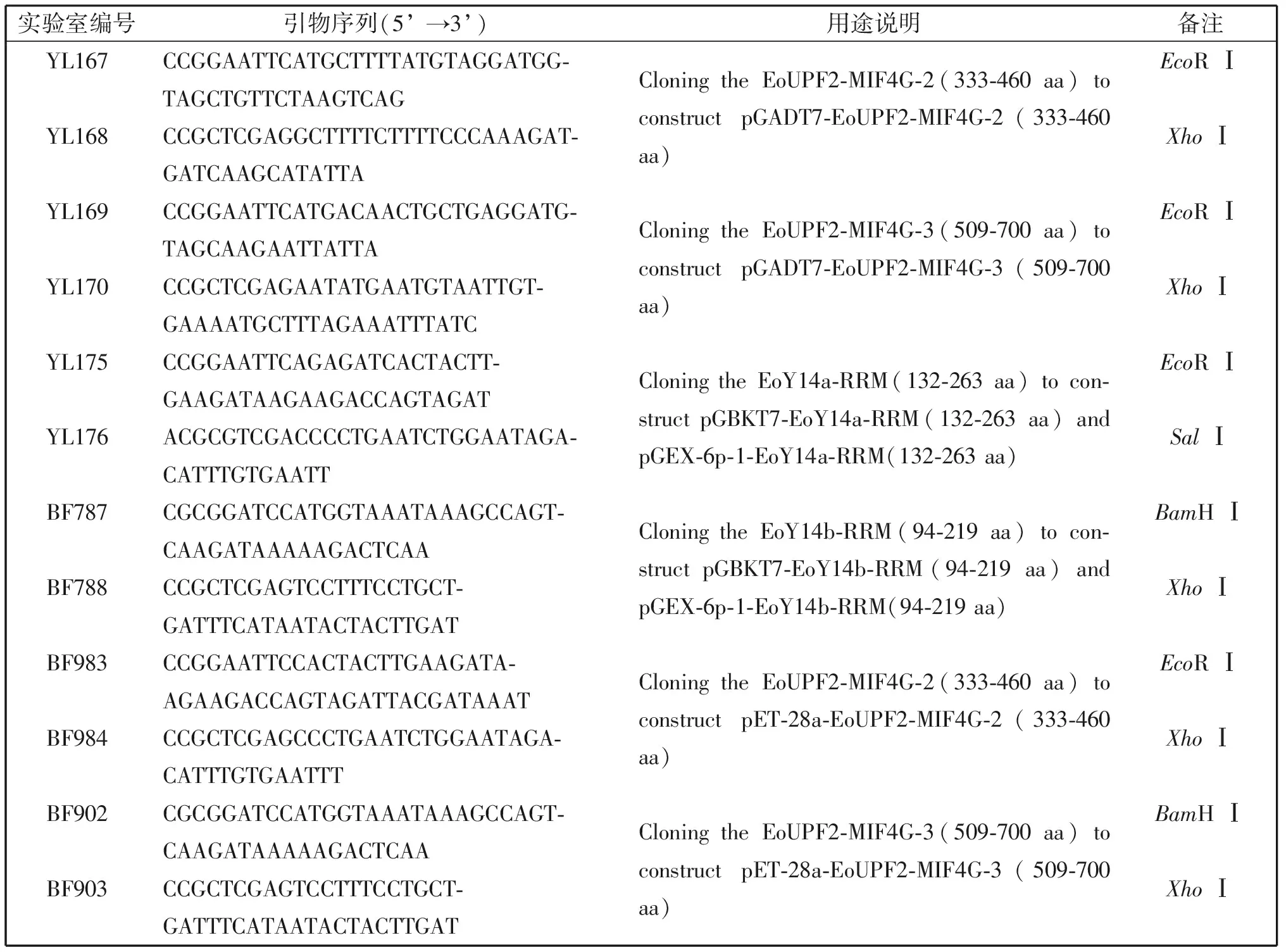
表1 本文用到的寡核苷酸引物
1.6 酵母双杂交
YPD固体培养基平板上活化AH109菌株,用YPD液体培养基获得大量活性较好的AH109,进行酵母共转化实验。以重组质粒pGADT7-eRF1/pGBKT7-eRF3共转化结果作为阳性对照,pGADT7/pGBKT7作为阴性对照,其他对照组以及实验组pGADT7-EoUPF2-MIF4G-2/pGBKT7-EoY14a-RRM、pGADT7-EoUPF2-MIF4G-2/pGBKT7-EoY14b-RRM、pGADT7-EoUPF2-MIF4G-3/pGBKT7-EoY14a-RRM、pGAD
T7-EoUPF2-MIF4G-3/pGBKT7-EoY14b-RRM。SD-Leu-Trp和SD-Leu-Trp-His-Ade固体培养基进行初筛和严谨筛选之后,进行显色反应。
1.7 体外Pull-down和Western blot分析
将重组质粒pET-28a-EoUPF2-MIF4G-2、pET-28a-EoUPF2-MIF4G-3、pGEX-6p-1-EoY14a-RRM和pGEX-6p-1-EoY14b-RRM (pET-28a/pGEX-6p-1分别带有His/GST标签) 分别转到大肠杆菌表达菌株BL21中进行诱导表达,确保目的蛋白大部分在上清中。将带有His标签的pET-28a-EoUPF2-MIF4G-2大量表达,纯化后结合到镍柱中,再将大量表达的pGEX-6p-1-EoY14a-RRM上清灌到结合了pET-28a-EoUPF2-MIF4G-2的镍柱中进行孵育,用洗涤液(His-binding buffer)洗涤后,用洗脱液(His-elution buffer)洗脱目的蛋白质。将500 mmol/L的镍柱洗脱溶液,使用浓缩柱4 000 rpm,离心20 min浓缩。制备样品,12%SDS-PAGE分离样品,Western blot进行分析。其他三对pET-28a-EoUPF2-MIF4G-2与pGEX-6p-1-EoY14b-RRM、pET-28a-EoUPF2-MIF4G-3与pGEX-6p-1-EoY14a-RRM、pET-28a-EoUPF2-MIF4G-3与pGEX-6p-1-EoY14b-RRM同理。
1.8 定量PCR分析Y14a和Y14b拷贝数

2 实验结果
2.1 UPF2结构的初步分析
UPF2作为关键的NMD因子,进化上非常保守。为了研究EoUPF2的进化关系,基于24个物种的UPF2氨基酸序列比对,运用最大似然法(ML)和邻接法(NJ)构建了UPF2的系统进化树,所得结果基本相似(图1)。从图1可以看出,这24个的UPF2的系统进化树有较多分支,而原生动物四膜虫(Tetrahymena),小瓜虫(Ichthyophthiriusmultifiliis),尖毛虫(Oxytrichatrifallax),八肋游仆虫处在一大分支上,进化地位较低。另外,与之最接近的一个分支是酿酒酵母(S.cerevisiae)和裂殖酵母(Schizosaccharomycespombe)。
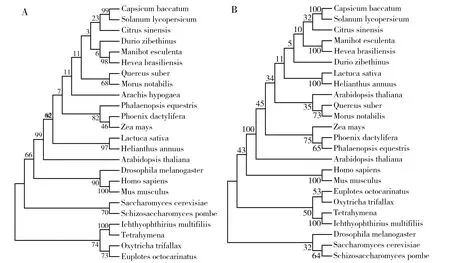
A:ML trees; B:NJ treesFig.1 Phylogenetic trees based on UPF2 protein sequencesA:ML树;B:NJ树图1 基于UPF2蛋白序列的系统发育树
在图1的系统进化树中,酿酒酵母NMD途径的研究较为深入。这里使用InterPro database分析了酿酒酵母与八肋游仆虫NMD核心蛋白UPF1和UPF2的保守结构域(图2)。从图2可以看出,二者的UPF蛋白结构非常相似。其中UPF1都包含1个N端与UPF2相互作用结构域,这部分包含3个锌离子结合模体(motifs);而C端部分都含有核苷三磷酸水解酶的P-loop结构,主要发挥DNA解旋酶和ATP酶的作用。UPF2包含串联的MIF4G结构域,它们分别起到与RNA和蛋白结合的作用。值得注意的是,EoUPF2的结构分析中,没有与ScUPF2相似的C末端结构域,但是在实验中截短的C末端部分与EoUPF1确实有相互作用(图3),所以认为EoUPF2存在C末端结构域。

The structure of UPF1 and UPF2 in S.cerevisiae and E.octocarinatus. The CH domain in N-terminal of UPF1 is indicated in grey, and the ATPase domain and helicase activity domain in C-terminal are indicated in black. The MIF4G of UPF2 is shown in black, and the interaction part between C-terminal and the CH domain of UPF1 is indicated in light grey.Fig.2 Structure of UPF2 protein in S.cerevisiae and E.octocarinatusInterPro database分析的酿酒酵母和八肋游仆虫的UPF1和UPF2的结构。 UPF1中N端的灰色部分代表的是CH结构域,黑色为C端的ATPase和解旋酶活性结构域; UPF2中的灰色部分代表MIF4G结构,浅灰色部分是C端与UPF1的CH结构域相互作用部分图2 酿酒酵母与八肋游仆虫UPF蛋白的结构
2.2 UPF2直接介导SURF与EJC复合体的耦联
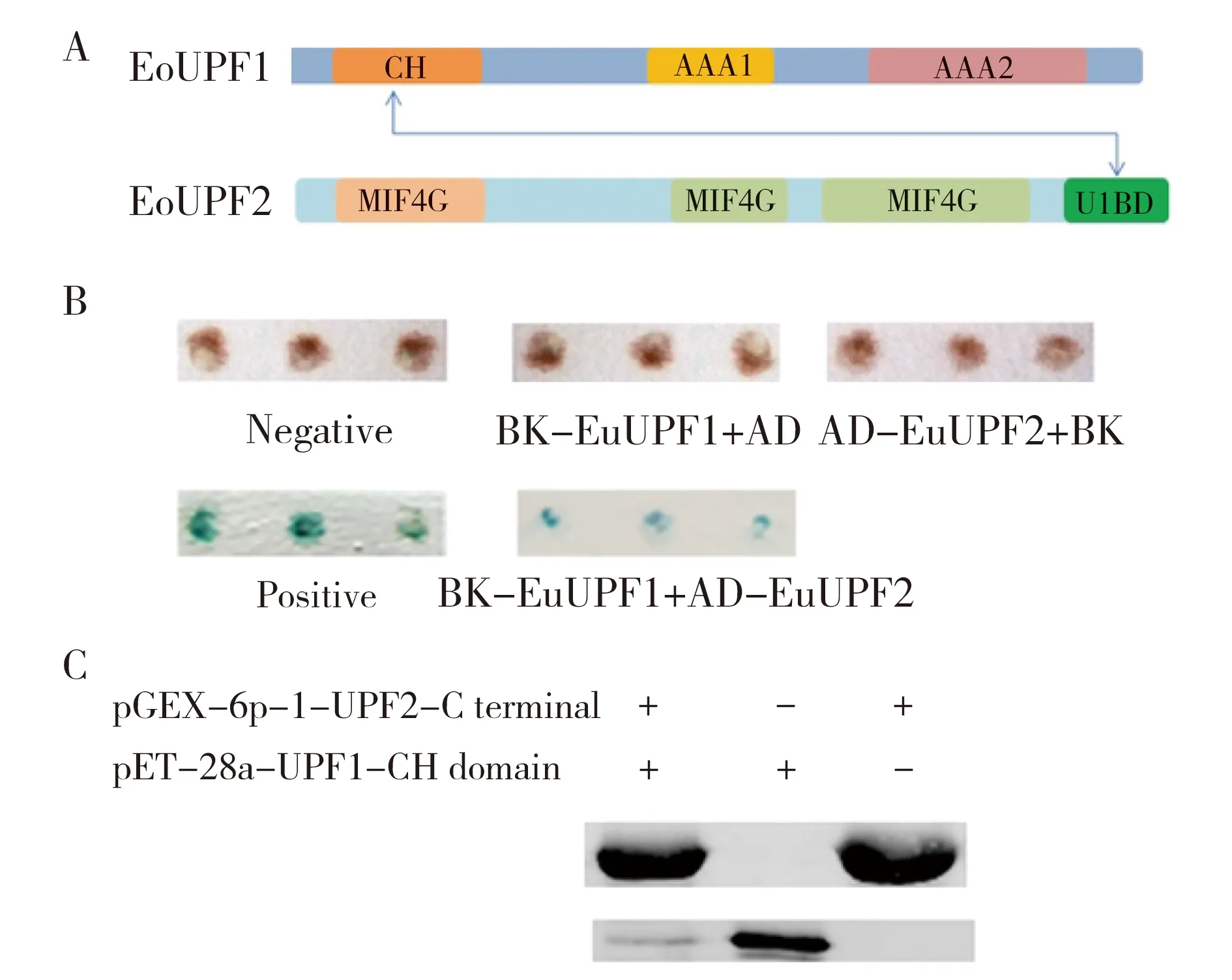
A:Interaction between CH domain of EoUPF1 and EoUPF2 C-terminal;B:Yeast two hybrids experiment analysis of interactions between EoUPF1-CH and EoUPF2-Ct, including positive and negative controls. The blue colour means the interaction between two factors. “+” represents co-transformation of two genes; C:the Pull down products were analyzed by Western blot, showing that the fusion protein His-EoUPF1-CH was pulled down by the GST-EoUPF2-Ct.Fig.3 Interaction between UPF2 and UPF1A:EoUPF1的CH结构域与EoUPF2的C末端具有相互作用;B:酵母双杂交实验分析EoUPF1-CH和EoUPF2-Ct的相互作用(包括阳性对照和阴性对照), 阳性对照中的蓝色代表两种因子之间相互作用, “+”代表共转化;C:Western blot分析Pull down产物,显示了His-EoUPF1-CH与GST-EoUPF2-Ct共纯化。图3 UPF2与UPF1相互作用
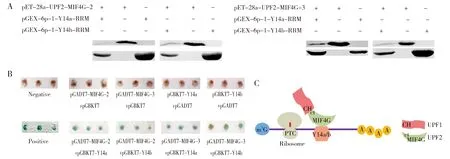
A:The pull down products were analyzed by Western blot,showing that the fusion protein GST-Yeast EoY14a/b-RRM were pulled down by both His-EoUPF2-MIF4G-2 and His-EoUPF2-MIF4G-3;B:yeast two-hybrids experiment analysis of interactions between pGADT7-EoUPF2-MIF4G-2 and pGBKT7-EoY14a/b-RRM,interactions between pGADT7-EoUPF2-MIF4G-3 and pGBKT7-EoY14a/b-RRM. “+” represents cotransformation of two genes;C:The model showed that the MIF4G domain of EoUPF2 mediates the connection between EoUPF1 and EoY14a/b.Fig.4 Interaction between UPF2 and Y14a or Y14bA:Western blot分析pull down产物,显示了His EoUPF2-MIF4G-2与GST EoY14a/b-RRM, His EoUPF2-MIF4G-3与GST EoY14a/b-RRM共纯化;B:酵母双杂交分析了pGADT7-EoUPF2-MIF4G-2与pGBKT7-EoY14a/b-RRM,pGADT7-EoUPF2-MIF4G-3与 pGBKT7-EoY14a/b-RRM共转化后的相互作用;C:模型显示EoUPF2通过其MIF4G结构域将EoUPF1与EoY14a/b连接图4 UPF2与Y14a或Y14b相互作用
UPF1与UPF2相互作用(图3A),再通过UPF3与EJC复合体联系,而八肋游仆虫细胞中没有UPF3,那么是否UPF2直接与EJC复合体连接,从而启动NMD途径的发生呢?首先,通过酵母双杂交实验(图3B)和Pull-down实验(图3C),证实了EoUPF2通过其C末端部分与上游EoUPF1的CH结构域相互作用,EoUPF1是SURF复合体的核心组分,说明UPF2通过EoUPF1与八肋游仆虫NMD的SURF复合体相互作用。其次,Pull-down实验(图4A)和酵母双杂交实验(图4B)证实UPF2通过它的两个MIF4G结构可以与EJC复合体的主要组分Y14a和Y14b的RRM结构域相互作用(图4C)。以上结果表明,UPF2通过EoUPF1与Y14将SURF复合体与EJC复合体耦联,启动八肋游仆虫NMD途径,进而识别无义mRNA,再利用EoUPF1招募mRNA降解相关的蛋白因子。
2.3 八肋游仆虫EJC核心因子Y14a和Y14b的表达水平
在八肋游仆虫细胞中鉴定到两个Y14a和Y14b因子,而且证实两者均与EoUPF2相互作用,但二者到底有何不同尚不明确。首先利用β-半乳糖苷酶实验分析了二者与EoUPF2的相互作用强度,结果显示UPF2与Y14a的作用更强一些(图5A)。进一步利用定量PCR方法分析了Y14a和Y14b在八肋游仆虫细胞中的表达水平,发现Y14b的拷贝数几乎是Y14a的两倍。这些结果表明,EoUPF2与Y14a和Y14b的相互作用强度与Y14a和Y14b本身的拷贝数无关。

A:β-galactosidase activity determination of interacting intensity between pGADT7-EoUPF2-MIF4G-2 and pGBKT7-EoY14a/b-RRM, pGADT7-EoUPF2-MIF4G-3 and pGBKT7-EoY14a/b-RRM;B:qPCR analyzed the difference of copy number Y14a and Y14b in the macronuclear genome in E. octocarinatus.Fig.5 Intensity of interaction between UPF2 and Y14a or Y14b and their copy number in macronucleusA:β-半乳糖苷酶活性实验分析pGADT7-EoUPF2-MIF4G-2与pGBKT7-EoY14a/b-RRM, pGADT7-EoUPF2-MIF4G-3与pGBKT7-EoY14a/b-RRM的相互作用强度;B:通过qPCR分析了Y14a与Y14b在八肋游仆虫大核基因组中的拷贝数差异图5 Y14a与Y14b与UPF2的作用强度及其在大核中的拷贝数
3 讨论
人和酵母NMD途径的启动和无义mRNA的降解机制的研究取得了一些进展,但关于NMD途径的进化机制及其一些具体的细节仍存在很多问题[9,19-20]。八肋游仆虫是进化程度比较低的单细胞真核生物,之前的许多研究表明,参与这些生物的细胞代谢过程的元件在种类和结构上相对较为简单[6,7,11]。UPF蛋白作为NMD途径的核心因子,参与NMD途径的启动、无义mRNA的识别和降解过程[1,3,12,18]。基因组分析结果显示,在八肋游仆虫细胞中仅有UPF1和UPF2两种UPF蛋白因子,没有UPF3。之前的研究发现在蓝氏贾第虫中也只有UPF1一种UPF蛋白[7],说明UPF蛋白因子与生物的进化水平有一定的联系(图1)。尽管在这些真核生物中UPF蛋白因子各不相同,但都具有能完成NMD途径的功能。因此,这些生物的NMD途径必然有其自身的特点。就八肋游仆虫UPF蛋白因子的结构而言,EoUPF1与EoUPF2与酵母相应的UPF因子的结构基本一致(图2),说明这些因子具备完成原生生物NMD途径的基本结构和功能。但是如何弥补元件(如UPF3)的缺失呢?在高等生物细胞NMD途径中,通过UPF2和UPF3介导SURF复合体和EJC复合体耦联,启动NMD途径[1,3,12],即EJC模型。本研究证实UPF2通过SURF结构中的UPF1和EJC结构中的Y14相互作用,介导了两个复合体的耦联,进而启动了NMD途径(图6)。

Fig.6 NMD pathway of the cell of the E.octocarinatus图6 八肋游仆虫细胞的NMD途径
Y14a和Y14b表达量不同,在基因表达过程中的作用可能不同:对于有内含子的基因,Y14作为剪接因子参与mRNA的加工过程,最终成为EJC复合体因子[23],与UPF2相互作用,介导NMD途径的启动和无义mRNA的识别和降解。对于没有内含子的基因,作为RNA结合蛋白,调控RNA的表达和稳定性。有研究表明,Y14可以与UPF1相互作用,引导无义mRNA被NMD途径识别[11]。
已有研究表明,第一类肽链释放因子eRF1可以结合在40S亚基A位点并识别所有3个终止密码子,与eRF3的C末端结合[24-25];而第二类肽链释放因子eRF3是1个核糖体依赖的GTPase,帮助eRF1释放完整的多肽,作为1个辅助因子发挥作用[12,24]。人与酵母形式的UPF1与eRF1和eRF3均有相互作用,只是eRF1主要靠离子键与UPF1结合[12,24]。在人类NMD研究中还发现了磷酸化激酶SMG1,可以被UPF1招募,与eRF1和eRF3一起形成SURF复合物[1,3,26]。几乎在所有NMD的研究中,UPF1都会被磷酸化来发挥作用,但是在八肋游仆虫的序列比对中,我们并没有发现SMG1,但是我们仍然认为EoUPF1会被某一种磷酸化酶磷酸化(图6中问号部分),并由EoUPF2架桥联系起EJC组分,从而形成八肋游仆虫NMD较为完整的启动机制(图6),而这个完整的启动机制还需要我们进一步实验研究证实。
4 结论
在八肋游仆虫NMD途径的研究中,首先对EoUPF2的进化关系和结构域进行了分析,发现它具备完成NMD途径的基本结构和功能。进一步对关键蛋白之间相互作用研究,发现UPF2既通过它的C末端与SURF复合体中的UPF1相互作用,又通过MIF4G结构域与EJC复合体中的Y14相互作用,进而介导了SURF复合体和EJC复合体的耦联,对于NMD途径的启动机制发挥着重要的作用。
