白藜芦醇对氧化应激环境中HUVECs细胞衰老、增殖、凋亡的影响及机制
2019-08-21陈昌喆宋晨曦李彬张冬张睿窦克非
陈昌喆 宋晨曦 李彬 张冬 张睿 窦克非
(1首都医科大学附属北京安贞医院,北京 100029;2中国医学科学院 北京协和医学院 国家心血管病中心 阜外医院;3寿光市人民医院)
细胞在生物氧化代谢过程中会产生活性氧(ROS),并可被体内的抗氧化剂如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等清除。但在病理状态下,累积的ROS会损伤细胞内的DNA、脂质及蛋白质等,从而破坏细胞结构并改变细胞功能。过氧化氢(H2O2)是ROS之一,为最常见的用来诱导细胞早期衰老的化合物,这与其能够诱导细胞氧化应激反应有很大的关系〔1,2〕。白黎芦醇(RSV)是一种具有强生物活性的天然多酚类物质,主要来源于葡萄(红葡萄酒)等植物〔3〕。研究表明,RSV具有抗炎、抗氧化、抗肿瘤〔4,5〕及心血管保护等多种生物学作用。目前有研究发现,RSV不仅可以抑制血小板聚集或黏附,降低血小板的氧化应激,还可以防止低密度脂蛋白氧化,抑制血管平滑肌细胞(SMC)增殖或肥大〔6,7〕。有实验证实,RSV可通过抑制SMC线粒体中ROS的产生而发挥其抗衰老及血管保护作用〔8,9〕。而在动物模型中,RSV可加快受损动脉的再内皮化速率、减少新生内膜过度增生〔10〕。在多种心血管疾病中,内皮细胞均可处于氧化应激状态,进而使细胞功能受损,而RSV是否能改善氧化应激环境下内皮细胞的功能尚无定论。本实验拟通过研究RSV对H2O2干预的人脐静脉血管内皮细胞(HUVECs)衰老、增殖,凋亡等相关生物学功能的影响,探讨RSV对内皮细胞的保护作用机制。
1 材料与方法
1.1 材料 HUVECs细胞购自国家实验细胞资源共享服务平台(中国医学科学院基础医学研究所)。胎牛血清、胰酶购自Gibco公司。RSV、H2O2及二甲基亚砜(DMSO)均购自Sigma公司。通用型组织/细胞β-半乳糖苷酶原位染色试剂盒(GMS10010.4)购自上海市杰美基因医药科技有限公司。细胞周期检测相关试剂:碘化丙啶/核糖核酸酶(PI/RNase)染色溶液(550825)购自美国BD公司。Annexin V-FITC/PI凋亡检测试剂盒(AD10)购自上海东仁化学科技有限公司。P53小鼠抗人单克隆抗体(sc-126)购自美国 Santa Cruz Biotechnology公司。P21小鼠抗人单克隆抗体(#2946)、p-Rb(Ser780)兔抗人单克隆抗体(#9307)、p-AKT兔抗人单克隆抗体(#4060)、AKT(pan)兔抗人单克隆抗体(#4691)、p-Erk1/2兔抗人单克隆抗体(#4370)、Erk1/2兔抗人单克隆抗体(#4695)、Survivin兔抗人单克隆抗体(#2808)均购自美国CST公司。P16兔抗人单克隆抗体(ab108349)购自英国Abcam公司。GAPDH小鼠抗人单克隆抗体(60004-1-Ig)购自美国Proteintech Group公司。
1.2 细胞培养 于37℃、5%CO2条件下,应用含10%胎牛血清的DMEM培养基培养HUVECs细胞株,根据生长状况每2~3 d换液一次,当细胞长至70%~80%时可传代,取处于对数生长期状态良好的细胞用于实验并分组:①对照组;②H2O2组(100 μmol/L H2O2预处理2 h);③H2O2+RSV组(100 μmol/L H2O2预处理2 h后加用50 μmol/L RSV共同孵育48 h)。
1.3 β-半乳糖苷酶染色 配置Genmed染色工作液:GENMED染色原液(-20℃保存)于冰上融化,在15 ml离心管中加入3.8 ml Genmed稀释液及200 μl Genmed染色液。混匀后置于37℃水浴预热并标记为Genmed工作液。将各组待测细胞均匀铺在24孔板中,待细胞贴壁后吸弃各孔培养基,并在每孔中加入500 μl Genmed清理液,清洗细胞表面后吸弃清理液。然后每孔加入500 μl Genmed固定液覆盖细胞表面,室温孵育5 min后弃固定液。每孔加入500 μl Genmed酸性液清洗后吸弃。每孔加入500 μl预先配制的Genmed染色工作液,覆盖培养皿中细胞表面,将培养皿置于37℃细胞培养箱中孵育16 h,待细胞呈现蓝色后取出,光学显微镜下观察细胞形态、颜色并计数,其中呈现蓝色即表达β-半乳糖苷酶的细胞为衰老细胞。统计并分析各组细胞,每组6个随机视野,每个视野细胞总数100个以上,计算呈现蓝色的衰老细胞比率。
1.4 长时程动态活细胞成像及分析系统检测细胞增殖能力 胰酶消化培养皿中处于对数期生长的各组细胞,吸取细胞培养基悬浮细胞,制成细胞悬液,调整浓度为104个/ml。96孔板每孔加入100 μl细胞悬液,每组设置6个平行孔,待细胞贴壁后将96孔板放置于IncuCyte Zoom培养箱中,设置增殖检测程序,每6 h对培养过程中的细胞进行拍照并记录。待细胞融合度达到90%时,按照比例传代,继续使用增殖检测程序对部分传代后的细胞进行拍照并记录,进入下一周期动态检测。实验结束后对选定区域的照片进行整理分析,绘制细胞增殖曲线。
1.5 细胞周期检测 胰酶消化处于对数期生长的各组细胞,以制备单细胞悬浮液;取1×106个细胞置于15 ml离心管中,1 500 r/min离心5 min后弃掉上清。将细胞重悬于500 μl磷酸盐缓冲液(PBS)中,加入预冷的无水乙醇,边加边震荡,加至2 ml即为固定细胞的乙醇终浓度(75%),4℃保存过夜。第2天将固定的细胞1 500 r/min离心5 min,弃上清,加入1 ml PBS悬浮细胞后再次离心并弃上清。加入PI/RNase染色液300 μl,混匀后避光室温染色15 min。过滤后流式细胞仪上机检测,Modifit软件模拟检测各组细胞周期情况。
1.6 细胞凋亡检测 胰酶消化处于对数期生长的各组细胞,弃上清后加入5 ml 1×PBS,将细胞移至15 ml管中,1 500 r/min 离心5 min,弃上清。加入2 ml 1倍上样缓冲液重悬细胞,在FITC单染管中,各实验组分别加入5 μl Annexin V-FITC,轻轻混匀后于4℃避光条件下孵育15 min。在PI单染管中,各实验组分别加入10 μl PI,轻轻混匀后于4℃避光条件下孵育5 min,过滤后流式细胞仪上机检测并分析各组细胞凋亡情况。
1.7 Western印迹检测与衰老、增殖及凋亡等相关蛋白的表达 取经过处理的细胞,应用RIPA蛋白裂解液提取总蛋白,加入蛋白酶抑制剂置于冰上进行裂解。用BCA法测定蛋白浓度,然后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转膜,室温封闭1 h,滴加一抗4℃ 孵育过夜。电化学发光法发光、显影、定影、拍照。Western印迹检测细胞衰老相关蛋白(p53,p21,p16和p-Rb)、与细胞增殖相关的p-AKT和p-ERK蛋白及凋亡抑制蛋白Survivin的表达情况。
1.8 统计分析 采用SPSS17.0软件进行t检验。
2 结 果
2.1 RSV对H2O2预处理后的HUVECs衰老的影响 和对照组〔(25.17±2.76)%〕相比,加入100 μmol/L的H2O2后,H2O2组中衰老细胞所占的比例明显增多〔(75.02±4.23)%〕,差异有统计学意义(P<0.05)。当用50 μmol/L RSV处理细胞后,H2O2+RSV组中衰老细胞所占比例明显减少〔(36.25±3.18)%〕,见图1,提示RSV能够逆转H2O2诱导的细胞衰老。
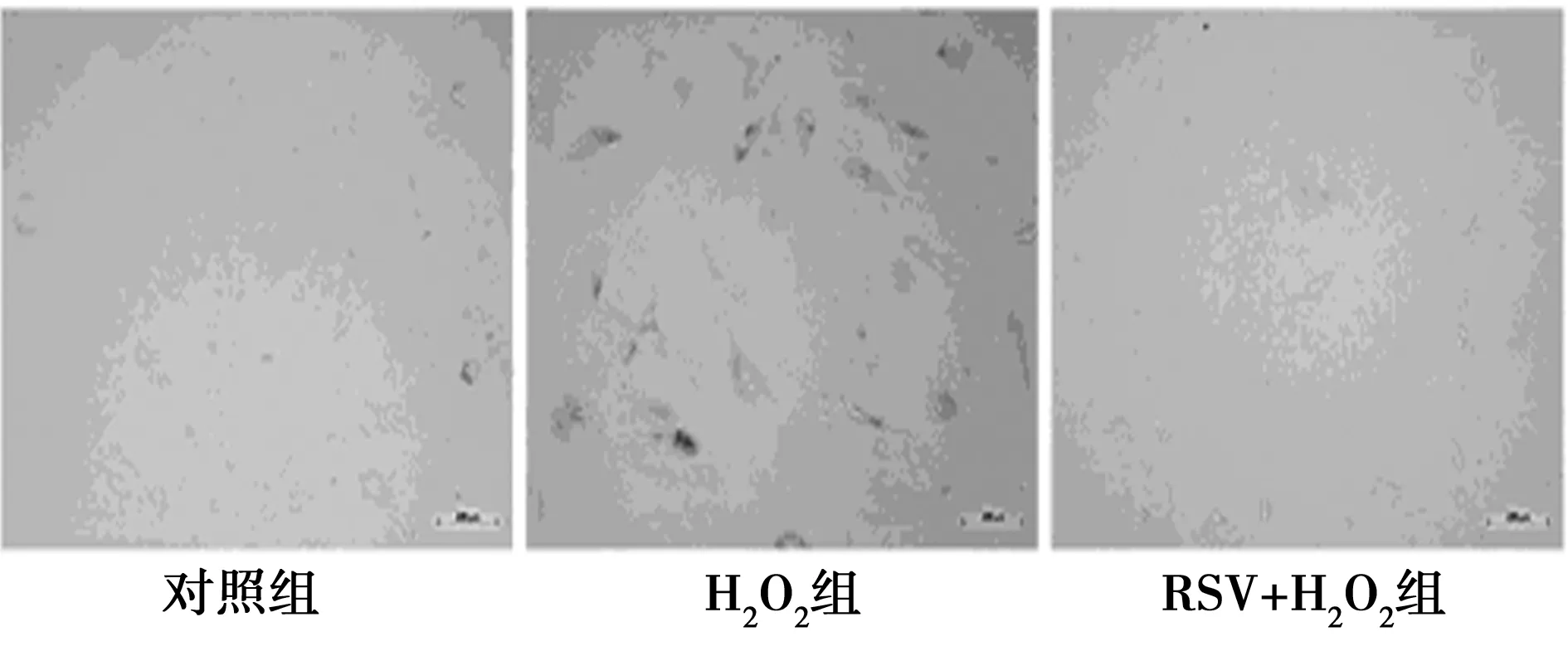
图1 RSV对H2O2预处理HUVECs衰老的影响(β-半乳糖苷酶染色)
2.2 RSV对H2O2预处理后的HUVECs增殖及细胞周期的影响 和对照组相比,加入100 μmol/L的H2O2后,HUVECs细胞增殖明显被抑制。当加入50 μmol/L RSV后,H2O2+RSV组细胞增殖趋于正常状态,相比于H2O2组,加入RSV后36 h后HUVECs细胞增殖能力明显增高(P<0.05),提示RSV能够逆转H2O2对 HUVECs细胞增殖的抑制作用。对细胞周期检测结果显示,与对照组相比,H2O2组G1期细胞所占比例明显增多,而S期及G2/M期细胞所占比例相对减少,说明H2O2通过将细胞阻滞在G1而延缓细胞周期的进展,当HUVECs用RSV和 H2O2同时处理时,G1期细胞所占比例又恢复到对照组水平,说明RSV能够逆转H2O2对细胞周期的阻滞作用,见表1。

表1 RSV对H2O2预处理的HUVECs凋亡及细胞周期的影响
与H2O2组比较:1)P<0.05
2.3 RSV对H2O2预处理后的HUVECs凋亡的影响 流式细胞技术检测,结果显示,H2O2组能够促进细胞的凋亡,而H2O2+RSV组中细胞凋亡程度降低,说明RSV能够逆转H2O2对细胞凋亡的促进作用,进而抑制细胞的凋亡(见表1)。
2.4 RSV对H2O2预处理后的HUVECs相关蛋白表达的影响 H2O2能够上调HUVECs细胞衰老相关蛋白(p53,p21,p16和p-Rb)的表达,促进细胞的衰老。同时H2O2能够抑制HUVECs细胞增殖相关蛋白(p-AKT和pERK)及凋亡抑制蛋白Survivin的表达,进而抑制细胞的增殖水平,并间接促进细胞的凋亡水平(见图2,3)。而加入RSV后可以逆转上述H2O2的这些作用,与H2O2组相比,H2O2+RSV组各衰老相关蛋白表达降低,细胞增殖相关蛋白及凋亡抑制蛋白表达升高。

1~3:对照组、H2O2组、RSV+H2O2组图2 各组蛋白Western印迹检测

1~9:p53,p21,p16,p-Rb,p-Akt,p-ERK,ERK,Survivin图3 H2O2及RSV对HUVECs细胞衰老、增殖及凋亡相关蛋白的影响
3 讨 论
ROS是常规有氧代谢的副产物。生理条件下ROS的生成与清除处于动态平衡,多个信号级联反应参与了这一平衡调节〔11〕。当失去上述平衡时,ROS水平急剧增加,并且建立氧化应激状态,导致细胞内部成分和结构受损并引起细胞功能变化〔12〕。此外,作为重要的信息分子,ROS通过对蛋白质的氧化修饰对细胞生长、凋亡和衰老等细胞功能进行调节〔13〕。 因此,ROS在细胞功能的激活过程中扮演着重要角色,在生理和病理生理过程中均起着关键作用〔14〕。
细胞生长是细胞尺寸或体积变大的过程,在增殖的细胞中,生长可以被细胞分裂所平衡。当细胞周期被阻断后,细胞生长不能被细胞分裂所补偿,结果是细胞体积不再变大,细胞从生长的过程转变成衰老状态。细胞衰老与细胞的静止状态不同,细胞衰老是一种复制性的细胞死亡,是一种不可逆的增殖状态的停滞〔15〕,而细胞静止是一种跟生长因素有关的细胞周期的静止,理论上认为有丝分裂的刺激能加强细胞衰老的过程〔16〕。
研究证实,细胞衰老与多个信号转导途径有关。其中,p53/p21及p16(INK4a)/pRb调控的信号通路起到了关键作用。细胞周期是一个复杂的过程,周期素通过活化周期素依赖性激酶(CDK)来调控细胞周期的蛋白家族,二者在细胞周期的调控中起到了核心作用。其中,G1/S期过渡受周期素D/CDK4/6的调控。本研究发现,H2O2可使细胞内源性β-半乳糖苷酶积聚,表明H2O2可诱导HUVECs细胞衰老。同时,H2O2还可使HUVECs中衰老相关蛋白p53、p21、p16、pRb的表达增多。其机制与H2O2所致的氧化应激环境中,细胞内的DNA损伤有关。当细胞内DNA损伤时会使p53活化,p53通过刺激p21、p16转录而使p21及 p16蛋白表达增多。p21为CDK抑制剂,可阻断cyclinE-CDK2和细胞周期蛋白CDK4/6复合物的活性,阻止细胞周期的G1期进展至S期。而p16为细胞周期的基本基因,为CDK抑制因子(CKI)INK4家族成员之一,直接参与细胞周期的调控。p16蛋白可通过抑制细胞周期依赖性激酶 CDK4/6 与细胞周期蛋白 D的结合,从而抑制pRb 蛋白的磷酸化,致使细胞周期阻滞在G1期,最终导致生长阻滞〔17,18〕。因此,H2O2的促衰老作用与p53/p21及p16(INK4a)/pRb信号通路激活有关。而RSV可抑制p53、p21、p16、pRb蛋白的表达,提示,RSV可通过抑制p53/p21及p16(INK4a)/pRb信号通路拮抗H2O2所致细胞衰老,对氧化应激环境中的HUVECs细胞具有保护作用。
本研究还发现,H2O2能够抑制HUVECs的增殖,而RSV可以拮抗H2O2对HUVECs细胞增殖的抑制作用,此过程可能与细胞增殖相关的p-AKT和p-ERK两种蛋白的激活有关。本研究结果还显示,H2O2可诱导HUVECs凋亡,其机制与抑制抗凋亡蛋白Survivin的表达有关,而RSV对H2O2诱导的细胞凋亡具有抑制作用。
