阻断VEGF/VEGFR-2信号传导促进乳腺癌TAM向M1表型极化
2019-08-20何少忠通信作者毛亚婷王群廖桂祥通信作者
何少忠(通信作者),毛亚婷,王群,廖桂祥(通信作者)
1 深圳市宝安区中心医院肿瘤科 (广东深圳 518102);2 桂林医学院附属医院肿瘤科 (广西桂林541004);3 深圳市人民医院放疗科 (广东深圳 518020)
乳腺癌是女性最常见的恶性肿瘤,其发病率居女性恶性肿瘤首位。肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)是外周血单核细胞迁移浸润到肿瘤组织的巨噬细胞,是乳腺癌免疫微环境中最丰富的免疫细胞,在促进乳腺癌进展与免疫逃逸中发挥关键的桥梁作用[1-5]。根据TAM活化类型及其在肿瘤微环境中作用不同,主要分为两种极化类型,即经典活化M1型和替代活化M2型,M1型主要诱导Th1型免疫应答,产生细胞毒作用杀伤肿瘤;M2型主要诱导Th2型免疫应答,抑制炎症促进肿瘤生长[6-9]。VEGF/VEGFR-2信号通路在肿瘤血管生成中起关键作用,有研究报道VEGF促进巨噬细胞迁移募集到肿瘤组织形成TAM,而VEGF/VEGFR-2信号通路是否参与TAM的极化表型调控[10-13]。本研究试想通过阻断VEGF/VEGFR-2信号传导,以促进乳腺癌TAM向M1表型极化,促进炎症反应。现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验细胞
小鼠乳腺癌4T1细胞及小鼠单核细胞-巨噬细胞RAW264.7(中科院上海细胞库),4T1细胞使用含10%灭活胎牛血清的PRMIl640培养基进行培养和传代,RAW264.7细胞使用含10%灭活胎牛血清的DMEM高糖培养基进行培养和传代。
1.1.2 主要试剂
细胞培养基RPMI 1640、细胞培养基DMEM、胰蛋白酶EDTA消化液、胎牛血清(FBS)及无血清Opti-MEMI培养基(美国Gibco公司),小鼠细胞因子(IL-10、IL-12、VEGF、ELISA、TGF-β)检测试剂盒(美国Invitrogen公司),Alexa Fluor® 488 anti-mouse CD206、PerCP anti-mouse F4/80、APC anti-mouse CD16/32抗体(美国Ebioscience公司),慢病毒(赛业生物),阿帕替尼(江苏恒瑞公司),贝伐单抗(上海罗氏公司)。
1.2 方法
1.2.1 诱导鉴定TAM细胞模型,检测VEGFR-2蛋白表达
将小鼠乳腺癌细胞4T1细胞接种于25 cm2培养瓶中,加入适量完全培养基,细胞培养24 h后,收集培养液并用0.22 μm过滤器过滤得到4T1细胞上清液。将RAW264.7细胞细胞接种于25 cm2培养瓶中,长到60%~70%底面积时,弃掉原来培养液,加入4T1细胞上清液继续培养48 h,诱导形成TAM细胞。流式细胞术检测诱导前后TAM表型,ELISA检测诱导前后细胞因子的变化和WB检测诱导前后VEGFR-2蛋白表达。
1.2.2 阻断VEGF/VEGFR-2 信号传导对TAM表型的干预实验
取处于对数生长期的RAW264.7细胞,加入4T1细胞上清液培养48h后,诱导形成TAM细胞。与未干预TAM组对比,设4个TAM干预组,分别为VEGFR-2基因siRNA组、VEGF抗体(贝伐单抗)阻断组、VEGFR-2受体抑制剂(阿帕替尼)阻断组、贝伐单抗+阿帕替尼联合阻断组。VEGFR-2基因siRNA组用慢病毒转染TAM细胞沉默VEGFR-2的表达,贝伐单抗组和阿帕替尼组分别用20 μg/ml贝伐单抗和8 nM阿帕替尼作用24 h,贝伐单抗+阿帕替尼药物联合干预组则联用20 μg/ml贝伐单抗+8 nM阿帕替尼处理24 h。收集细胞后流式细胞术检测TAM表型、ELISA检测细胞因子的变化和WB检测VEGFR-2表达,明确阻断VEGF/VEGFR-2 信号传导对TAM表型的影响。
1.2.3 TAM迁移实验
将1.2.2各组处理后细胞用胰酶消化细胞成单个细胞,加入transwell小室上室,下室加入培养液,放入37 ℃培养箱中培养48 h,取出上室用固定液固定20 min,将膜取下结晶紫染色,封片,镜下拍照。倒置显微镜下观察上室外表面细胞,各取5个视野。脱色处理后在550 nm处酶标仪测定吸光度(OD)值,与未干预TAM组对比,检测4个干预阻断组TAM侵袭能力的改变。
1.2.4 TAM吞噬实验
将1.2.2各组处理后细胞弃培养液培养,对照孔加0.5 ml 0.9%氯化钠注射液,其余每孔加0.5 ml 0.075%中性红,继续培养1 h,倾去上清液,用PBS洗涤,每孔加入细胞溶解液,室温下放置30 min。待细胞溶解后,即用分光光度计测定OD值,检测未干预TAM与4个干预阻断组TAM的吞噬能力的改变。
1.3 统计学处理
采用SPSS 16.0统计软件进行数据分析,所有实验重复3次,计量资料以±s表示,率的比较采用方差分析,采用bonfernoni分析总体及总体中两样本均数之间差异,P<0.05为差异有统计学意义。
2 结果
2.1 TAM细胞诱导模型呈M2型极化
2.1.1 TAM细胞呈M2型极化
流式细胞术检测小鼠乳腺癌细胞4T1培养液诱导培养RAW264.7小鼠单核细胞-巨噬细胞48 h后细胞表面分子标志的表达,M1型(表面分子标记 F4/80+CD16/32)细胞比例由诱导前12.95%降低至诱导后4.47%(P<0.05),M2型(表面分子标记F4/80+CD206)细胞由诱导前4.44%升高至诱导后18.51%(P<0.05)。见图1和表1。

图1 流式细胞术检测细胞诱导前后表面分子变化
表1 M1、M2型细胞诱导前后比较(%,±s)

表1 M1、M2型细胞诱导前后比较(%,±s)
注:与诱导前RAW264.7组比较,aP<0.001
组别 M1(CD16/32+) M2(CD206+)诱导前RAW264.7组 12.95±2.61 4.40±0.62诱导后TAM组 4.47±0.50a 18.51±3.14a
2.1.2 TAM细胞分泌Th1型细胞因子减少,Th2型细胞因子分泌水平增高
M1和M2型巨噬细胞分别通过分泌Th1型细胞因子(IL-12)和 Th2型细胞因子(IL-10、VEGF、TGF-β 及ARG-1)来发挥免疫调节的作用。ELISA检测结果显示,4T1细胞上清液诱导培养RAW264.7细胞后Th1型细胞因子(IL-12)分泌减少(P<0.05),Th2型细胞因子(IL-10、VEGF、TGF-β及ARG-1)分泌增多(P<0.05)。见图2。

图2 ELISA检测细胞诱导前后细胞因子变化
2.2 M2型TAM高表达VEGFR-2受体
2.2.1 TAM细胞高表达VEGFR-2蛋白
Western Blot检测经小鼠乳腺癌细胞4T1培养液诱导培养RAW264.7后VEGFR-2蛋白的表达,诱导后TAM细胞VEGFR-2蛋白含量增高(P<0.05),是诱导前细胞的2.5倍。见图3。

图3 WB检测VEGFR-2的蛋白表达
2.2.2 M2 型TAM高表达VEGFR-2蛋白受体
流式细胞术双染检测小鼠单核-巨噬细胞RAW264.7经小鼠乳腺癌细胞4T1上清液诱导48 h后M1与M2型TAM中VEGFR-2膜蛋白的表达,M2型细胞的比例由50.1%升高到83.1%(P<0.05),VEGFR-2蛋白在M2型细胞中的比例由33.7%上升至48.5%(P<0.05),而VEGFR-2蛋白在M1型细胞中比例改变不明显。见图4和表2。
2.3 阻断VEGF/VEGFR-2信号传导能够逆转M2-TAM表型,促进TAM向M1极化
RAW264.7小鼠单核-巨噬细胞加入4T1细胞上清液诱导培养48h后得到TAM细胞。将上述细胞分为5组,分别为TAM空白对照组、VEGFR-2沉默组、VEGF抗体(贝伐单抗)阻断组、VEGFR-2受体抑制剂(阿帕替尼)阻断组和贝伐单抗+阿帕替尼联合阻断组。通过siRNA技术干扰TAM细胞VEGFR-2表达、VEGF抗体(贝伐单抗)、VEGFR-2受体阻断剂(阿帕替尼)及贝伐单抗+阿帕替尼药物联合分别阻断VEGF/VEGFR-2信号传导对TAM极化表型的影响,结果提示阻断VEGF/VEGFR-2信号传导能够逆转 M2-TAM表型,促进TAM向M1极化。

图4 流式双染检测诱导前(RAW264.7)与诱导后(TAM)M1与M2型VEGFR-2受体表达
表2 M1、M2型VEGFR-2的诱导前后比较(%,±s)

表2 M1、M2型VEGFR-2的诱导前后比较(%,±s)
注:与诱导前RAW264.7组比较,aP<0.05
组别 M1(CD16/32+)VEGFR-2+M1(CD16/32+)M2(CD206+)VEGFR-2+M2(CD206+)诱导前RAW264.7组 97.9±3.0 94.3±3.1 50.1±12.7 33.7±5.6诱导后TAM组 99.2±1.2 85.4±5.2 83.1±13.6a 48.5±6.1a
2.3.1 Western Blot 检测VEGFR-2的表达
相比于空白对照组,siRNA沉默TAM细胞VEGFR-2蛋白或药物阻断VEGF/VEGFR-2信号传导导致了VEGFR-2蛋白表达水平的降低(P<0.05)。见图5。

图5 WB检测TAM干预前后VEGFR-2蛋白表达
2.3.2 阻断VEGF/VEGFR-2信号传导促进TAM表型向M1极化
相比于空白对照组,siRNA沉默TAM细胞VEGFR-2蛋白或药物阻断VEGF/VEGFR-2信号传导导致M1型TAM比例升高(P<0.05),M2型TAM比例下降(P<0.05)。见图6和表3。
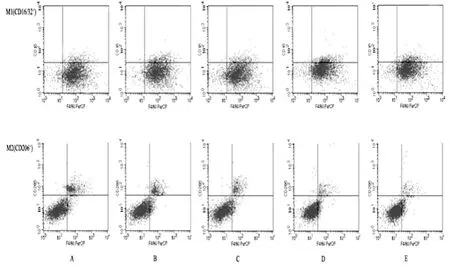
图6 流式细胞术检测细胞干预前后表面分子变化
表3 M1、M2型细胞干预前后比较(%,±s)

表3 M1、M2型细胞干预前后比较(%,±s)
注:与TAM空白对照组比较,aP<0.05
组别 M1(CD16/32+) M2(CD206+)TAM空白对照组 6.23±0.58 18.36±0.91 VEGFR-2沉默组 9.78±1.25a 10.52±0.61a贝伐单抗阻断组 9.37±0.61a 12.67±1.46a阿帕替尼阻断组 10.71±1.00a 8.23±0.30a贝伐单抗+阿帕替尼阻断组 10.88±0.89a 5.48±0.46a
2.3.3 阻断VEGF/VEGFR-2信号传导促进Th1型细胞因子分泌,减少Th2型细胞因子分泌
相比于TAM空白对照组,siRNA沉默TAM细胞VEGFR-2蛋白或药物阻断VEGF/VEGFR-2信号传导促进TAM表型向M1极化后,Th1型细胞因子(IL-12)分泌增多(P<0.05),Th2型细胞因子(IL-10、VEGF、TGF-β及ARG-1)分泌减少(P<0.05)。见图7。

图7 ELISA检测TAM细胞干预前后细胞因子变化
2.4 TAM迁移实验及吞噬实验
Transwell结果表明,相比于TAM空白对照组,siRNA 沉默TAM细胞VEGFR-2蛋白或药物阻断 VEGF/VEGFR-2信号传导促进TAM表型向M1型极化,TAM迁移能力增强(P<0.05)(图8a)。中性红吞噬实验结果提示阻断VEGF/VEGFR-2信号传导促进乳腺癌TAM向M1表型极化后,TAM细胞的吞噬能力增强(P<0.05)(图8b)。

图8 TAM表型向M1型极化后
3 讨论
TAM在乳腺癌浸润免疫细胞中的比例高达50%,促进乳腺癌的发生发展,导致乳腺癌复发及预后不良,越来越受到研究人员的重视[14-16]。TAM极化表型是影响肿瘤微环境免疫状态的重要因素[17]。肿瘤微环境中TAM主要被诱导极化为M2型,特征性表达 CD206、CD163,高表达抗炎细胞因子IL-10,低表达促炎细胞因子IL-12,分泌VEGF、TGF-β及CCL-22,产生精氨酸酶(Arg-1),诱导Th2型免疫应答,导致了免疫逃逸[18-20]。
本研究通过小鼠乳腺癌细胞4T1培养液诱导培养RAW264.7小鼠巨噬细胞,模拟肿瘤微环境,细胞实验进一步证实TAM细胞诱导模型呈M2型极化,同时TAM细胞分泌Th1型细胞因子减少,Th2型细胞因子及VEGF分泌水平增高。
VEGF是血管内皮生长因子,VEGFR-2是VEGF的跨膜受体,由胞外区、膜区及胞内酪氨酸激酶区组成,VEGFR-2受体和VEGF配体结合从而激活催化域内酪氨酸激酶,导致受体磷酸化而引起胞内酶联反应;介导肿瘤异常血管新生VEGF/VEGFR-2信号通路在肿瘤血管生成中起关键作用[21-22]。此外,有研究报道肿瘤缺氧微环境诱导VEGF表达后,将吸引巨噬细胞迁移浸润到肿瘤组织形成TAM,且TAM自身分泌VEGF形成正反馈,刺激局部血管形成募集更多的巨噬细胞浸润肿瘤组织[23-24]。如何打破TAM形成的免疫抑制微环境,是肿瘤免疫治疗面临的重要问题[25]。本研究通过阻断VEGF/VEGFR-2信号传导,以促进乳腺癌TAM向M1表型极化,促进炎症反应。
本研究通过siRNA沉默小鼠巨噬细胞VEGFR-2基因、VEGF抗体(贝伐单抗)、VEGFR-2受体阻断剂(阿帕替尼)及贝伐单抗+阿帕替尼药物联合阻断VEGF/VEGFR-2信号传导,研究对TAM极化表型功能的影响。结果显示,阻断VEGF/VEGFR-2信号传导导致VEGFR-2蛋白表达降低后,能够逆转M2-TAM表型促进TAM表型向M1型极化,同时促进Th1型细胞因子分泌,减少Th2型细胞因子分泌,增强TAM的迁移、吞噬,促进炎症反应,证实通过阻断VEGF/VEGFR-2信号传导从而促进TAM向M1型极化,对于调控肿瘤微环境中TAM表型功能具有重要意义。
综上所述,阻断VEGF/VEGFR-2信号传导能够逆转M2型TAM,促进TAM向M1型极化,增强TAM迁移吞噬能力,促进炎症反应。我们将进一步构造动物模型,开展体内研究证实阻断VEGF/VEGFR-2信号传导逆转M2型TAM与T细胞活化的作用与机制。
