IL-28B基因多态性对直接抗病毒药物治疗慢性丙型肝炎患者疗效的预测价值
2019-08-19谭文敏赖庭文韩锋
谭文敏 赖庭文 韩锋
目前,临床针对CHC患者可采用直接抗病毒(DAA)治疗,控制病情进展。然而,部分患者对治疗不应答,停药后复发问题尚未得到解决[1]。近年来,研究发现白细胞介素-28B(IL-28B)基因多态性可能与抗病毒治疗疗效存在关联,但有待进一步证实[2]。本研究主要分析了外周血IL-28B基因多态性对DAA治疗CHC患者疗效的预测价值,以为临床治疗提供依据,提高治疗效果,现报道如下。
资料与方法
一、一般资料
选取2014年1月—2017年1月海南医学院第一附属医院收治的CHC患者169例,男97例,女72例;年龄22~55岁,平均年龄为(31.29±8.64)岁。纳入标准:(1)参考《中国丙型病毒性肝炎医院感染防控指南》[3]诊断:伴有尿黄眼黄、食欲减退、恶心、乏力等表现;(2)血清HCV RNA呈阳性;(3)血清谷丙转氨酶(ALT)、谷草转氨酶(AST)增高;(4)经MRI、CT等检查提示无肝硬化表现。体质指数为18~26 kg/m2,平均为(22.64±2.18)kg/m2;血清HCV RNA为≤4×105拷贝/毫升者90例,>4×105拷贝/毫升79例;有饮酒史者31例,有吸烟史者27例,有脂肪肝者16例,有高血压病者43例;HCV基因型为Ib型者150例,非Ib型19例。纳入患者入院前未进行过抗病毒治疗。排除标准:(1)妊娠、哺乳期妇女;(2)恶性肿瘤;(3)自身免疫性疾病;(4)既往有吸毒史;(5)合并存在甲状腺机能亢进症。患者给出书面知情同意书,本研究方案经本院医学伦理委员会通过。
二、治疗方法
DAA方案:给予索非布韦(吉利德)400 mg口服,1次/d,达拉他韦(AstraZeneca Pharmaceuticals LP)60 mg口服,1次/d,共治疗24周。
三、疗效评定
在治疗24周后入院复查,评价疗效。参考《中国丙型病毒性肝炎医院感染防控指南》[3]评估:(1)快速病毒学应答(RVR):疗程满4周后,未测到HCV RNA;早期应答(EVR):疗程满12周后,HCV RNA下降≥2个对数级,或<最低检测限;持续应答(SVR):疗程满24周后,HCV RNA<最低检测限;无应答(NR):未满足上述标准。
四、IL-28B基因多态性测定
仪器包括PCR扩增仪(美国ABI PCR 9700)、荧光定量PCR仪(美国ABI 7000)、离心机(德国Sigma 3-18K)、凝胶图像分析系统(上海天能 GIS-2010)、电泳仪(北京六一 DYY-Ⅲ8)、分光光度计(Eppendorf BioPhotometer)。首先根据DNA提取试剂盒说明书进行操作提取DNA:具体如下:①捣碎凝血块,取100 μL放置在离心管内,取800 μL溶血试剂,离心5 min(8 000 rpm),分离血清;②取溶血试剂800 μL加入,离心5 min(8 000 rpm),分离血清,捣碎;③于60℃环境下水浴;④加饱和酚500 μL,离心5 min(12 000 rpm);⑤对上层水相进行吸取,置于离心管内,加氯仿300 μL,离心10 min(12 000 rpm);⑥分离上层清液,置于离心管内,再次加氯仿、离心;⑦分离血清,加NaAC,加异丙醇,沉淀20 min,温度为-20℃;⑧离心10 min(12 000 rpm),分离血清;⑨若溶解不充分,则水浴30 min,温度为55℃;⑩对DNA纯度进行测定,获得电泳结果。获得DNA后,经PCR扩增仪对其进行扩增,设空白对照(3个),反应条件为95℃ 5 min,(95℃ 30 s,64℃ 30 s,72℃ 1 min,35个循环),72℃ 10 min。经配套软件对荧光信号进行读取,分析等位基因类型。
五、统计学方法
经SPSS 20.0软件分析对临床资料进行分析,计数资料用(%)表示,采用χ2检验,利用logistic回归模型分析IL-28B基因多态性是否为CHC患者抗病毒疗效的影响因素。P<0.05为差异有统计学意义。
结 果
一、169例CHC患者预后与IL-28B基因多态性的关系
在169例CHC患者中,有135例存在病毒学应答,占79.88%,34例无应答,占20.12%。在有应答组中,rs8099917TT、rs12979860CC占比分别为89.63%、88.15%,显著高于无应答组的44.12%、47.06%(P<0.05),见表1。
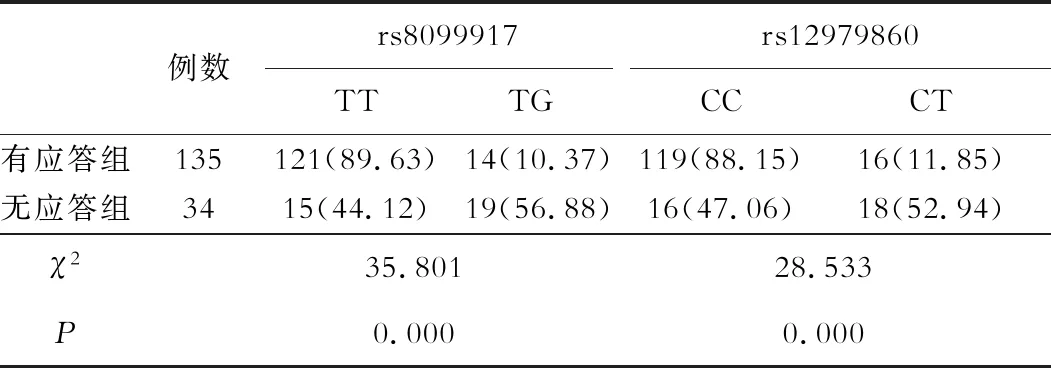
表1 CHC患者预后与IL-28B基因多态性的关系[n(%)]
二、CHC患者预后与临床特征的关系 有应答组无脂肪肝、Child肝功能A级、rs8099917 TT、rs12979860CC占比分别为94.81%、40.00%、89.63%、88.15%,显著高于无应答组的73.53%、26.47%、44.12%、47.06%(P<0.05),见表2。
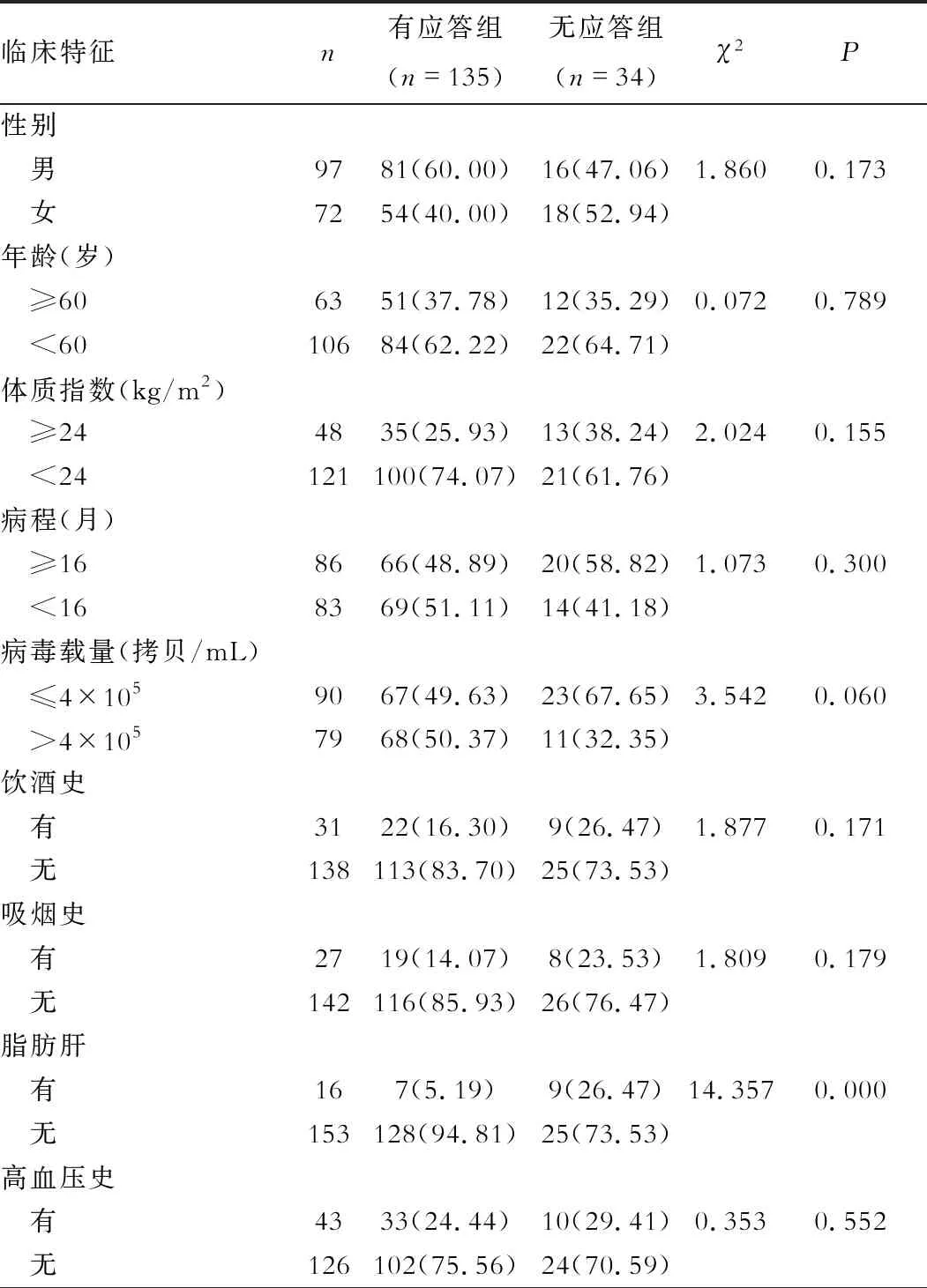
表2 CHC患者预后与临床特征的关系[n(%)]
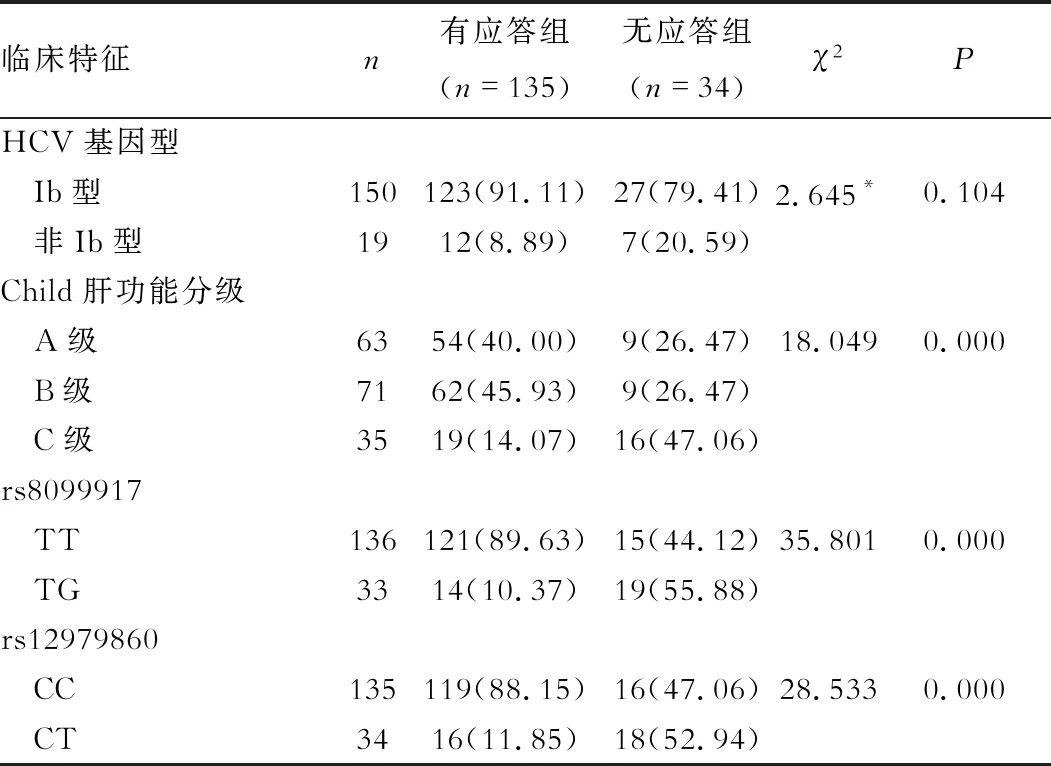
续表2
注:*采用连续性校正卡方检验
三、CHC患者预后的影响因素分析
利用logistic回归模型对各变量进行量化赋值,见表3,根据表2将脂肪肝、Child肝功能分级、rs8099917、rs12979860纳入模型,结果提示脂肪肝、Child肝功能C级、rs8099917TG、rs12979860CT是患者抗病毒治疗无病毒学应答的危险因素(P<0.05),见表4。

表3 量化赋值表
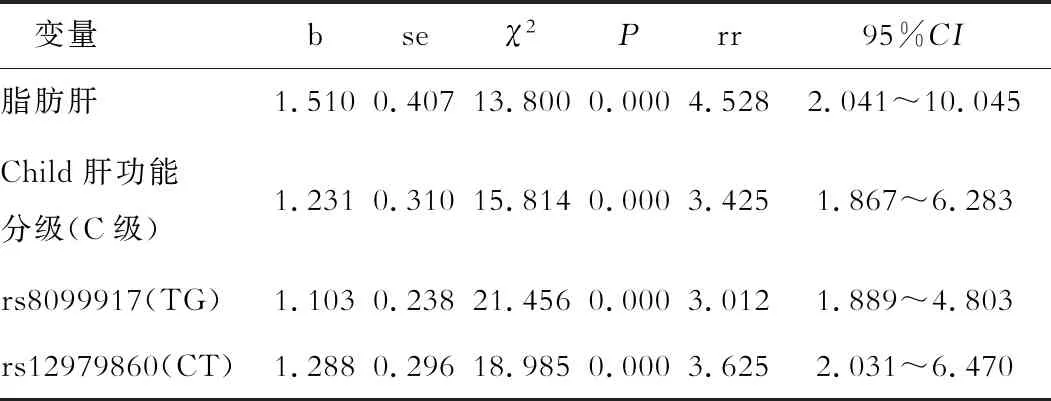
表4 CHC患者预后的影响因素分析
讨 论
CHC是临床常见的肝病,目前,临床针对病毒性肝炎患者主要采用抗病毒治疗,部分患者经治疗后能取得较理想的效果,然而,部分病例效果欠佳。研究表明约50%~80%的CHC病例经治疗后能获得病毒学应答[4]。本研究结果提示在169例患者中,有135例经DAA治疗后存在病毒学应答,应答率为79.88%,与上述研究结论基本符合。
本研究发现IL-28B的rs8099917TG、rs12979860CT位点基因对抗病毒疗效影响较大,其中rs8099917TT、rs12979860CC获得应答的几率更高,而rs8099917TG、rs12979860CT获得应答的几率相对较小。IL-28B基因在19号染色体上编码为IFN-λ3,即便含量较低,也能对病毒感染诱导进行表达。既往有研究发现IL-28B危险等位基因可下调IFN-λ水平,并导致细胞因子功能削弱,降低机体抗病毒应答能力,这提示IL-28B基因可能与病毒感染疾病进展存在关联[5]。另有研究指出要想明确IL-28B基因与丙型肝炎的关系,必须先明确IFN-λ与丙型肝炎的关系[6]。IFN-λ主要通过病毒诱导生成,它与受体相结合,能将Jak-Stat信号途径激活,并激活ISGF3转录复合物,达到抗病毒目的。肝细胞、上皮组织中均含IFN-λ受体,它有抗病毒作用。国外研究发现在IL-28B的rs8099917位点基因中,TT属于保护性基因,携带此基因的患者更易获得SVR,且IL-28B多态性对IFN-λ表达水平有明显影响[7]。本研究结果也提示携带rs8099917 TT基因的患者病毒学应答率更高,与上述研究结论基本符合。这可能的机制在于携带IL-28B优势基因的患者干扰素刺激基因(ISG)表达较低,其在外源性IFN-α影响下可增强IL-28B诱导作用,提高ISG表达水平,有利于获得SVR。
本研究还发现IL-28B的rs12979860 CC基因也是CHC患者抗病毒治疗疗效的保护性基因。有学者以HCV感染者为研究对象,发现rs12979860 CC基因占比高达93.4%,CT型占比仅6.6%,在CC型基因中,超过70%的患者经治疗后能获得SVR[9],与本研究结论基本符合。本研究经logistic回归模型证实CHC患者DAA疗效的影响因素包括脂肪肝、Child肝功能C级、rs8099917TG、rs12979860CT。其中脂肪肝、肝功能分级已被相关研究[10]证实为CHC患者DAA疗效的影响因素,本研究创新点在于证实rs8099917TG、rs12979860CT也对DAA疗效有影响,能为该病治疗提供依据。在CHC患者未来的治疗中,临床可根据IL-28B基因多态性进行干预,若患者具备优势基因型,则可给予常规抗病毒治疗,或缩短服药时间,降低不良反应风险。若患者无优势基因型,可根据情况选择小分子靶向抗病毒治疗,改善预后。
综上,CHC患者DAA疗效与IL-28B的rs8099917TG、rs12979860CT位点基因表达有关,临床可将其作为预测疗效的重要指标。本研究因受研究时间、研究经费的限制,仅纳入169例患者为研究对象,未来将扩大样本量对此进行大样本、多中心的研究。
