醇钙法和醇-水二元溶剂法制备亚稳态球霰石相CaCO3
2019-08-19陈传杰魏李庚吴月胡成沛胡元聪蒋久信
陈传杰, 魏李庚, 吴月, 胡成沛, 胡元聪, 蒋久信,2,3
醇钙法和醇-水二元溶剂法制备亚稳态球霰石相CaCO3
陈传杰1, 魏李庚1, 吴月1, 胡成沛1, 胡元聪1, 蒋久信1,2,3
(湖北工业大学1. 绿色轻工材料湖北省重点实验室; 2. 绿色轻质材料与加工湖北工业大学协同创新中心; 3. 材料与化学工程学院, 武汉 430068)
提出了醇钙法概念, 并采用该方法制备了亚稳态球霰石相CaCO3, 即利用CaCl2溶解于乙醇形成的络合物与Na2CO3水溶液之间的反应制备球霰石相CaCO3。主要研究了陈化时间和反应温度对产物晶相组成和颗粒形貌的影响, 并与相同条件下传统醇-水二元溶剂法制备CaCO3进行了对比。X射线衍射(XRD)表征结果表明, 两种制备方法得到的产物中球霰石相的含量均随反应时间的延长和反应温度的升高而降低, 但是醇钙法得到的球霰石的含量远大于醇-水二元溶剂法, 且醇钙法得到的球霰石的稳定性也远优于醇-水二元溶剂法。SEM观察结果表明, 两种制备方法得到的产物中的球霰石和方解石颗粒均为其典型形貌, 即球状和菱方状。
球霰石; CaCO3; 醇钙法; 陈化时间; 反应温度
球霰石是CaCO3三种无水晶型中热力学最不稳定的晶相, 但其具有比方解石和文石更广泛和特殊的用途, 如日用品、生物医学、制药和食品等[1-3]。
CaCO3的制备方法包括碳化法[4]、复分解法[5]、微乳液法[6]、水热法[7]、自组装单分子膜法[8]、生物矿化法[9]和热分解法[10-11]等, 而球霰石相的制备需要苛刻的条件[1]。近年来的研究表明, 在醇-水二元溶剂体系中可以得到球霰石相CaCO3[12-20]。该方法是指将CaCl2和Na2CO3分别溶于醇-水二元溶剂中制备CaCO3的方法。醇-水二元溶剂法制备CaCO3时, 溶液组成[12]、醇/水比[13-19]、[Ca2+]/[CO32–][18]、反应时间[18-19]和温度[13,20]是影响产物晶型的主要因素。但是利用醇钙法制备CaCO3的研究尚未见公开报导。本研究采用醇钙法制备亚稳态球霰石相CaCO3, 即利用CaCl2溶解于乙醇形成的络合物与Na2CO3水溶液之间的反应制备球霰石相CaCO3。主要研究了反应时间和反应温度对产物晶相组成和颗粒形貌的影响, 并与相同条件下醇-水二元溶剂法制备的CaCO3进行了对比。最后讨论了醇钙法制备CaCO3的反应过程。
1 实验方法
1.1 原料
实验用原料包括CaCl2、Na2CO3、无水乙醇和去离子水。其中CaCl2、Na2CO3和无水乙醇购于中国国药集团化学试剂有限公司, 为分析纯; 去离子水为实验室自制。
1.2 实验过程
醇钙法: 在一定温度下将1.11 g CaCl2(0.01 mol)溶于25 mL无水乙醇中, 搅拌30 min得到澄清透明的CaCl2乙醇溶液; 将1.06 g Na2CO3(0.01 mol)溶于10 mL去离子水中, 搅拌得到澄清透明的Na2CO3水溶液; 然后在相同温度下将Na2CO3水溶液倒入CaCl2乙醇溶液中并快速搅拌1 min; 将反应体系在相同温度下静置不同时间。
醇-水二元溶剂法: 在一定温度下将1.11 g CaCl2和1.06 g Na2CO3分别溶于5 mL去离子水中, 搅拌得到澄清透明的水溶液; 然后在相同温度下将Na2CO3水溶液和CaCl2水溶液倒入25 mL无水乙醇中, 并快速搅拌1 min; 将反应体系在相同温度下静置不同时间。
将两种方法不同反应时间和温度下得到的悬浊液以10000 r/min的转速离心5 min, 倒出上层清液, 重新加入无水乙醇, 超声波中分散, 重复两次完成醇洗。将无水乙醇换成去离子水, 重复上述步骤完成两次水洗。最后将沉淀产物在80 ℃下干燥24 h。
1.3 样品表征
在X射线衍射仪(XRD, 锐影Empyrean, 荷兰帕纳科公司)上对产物进行晶相分析。工作条件为: Cu Kα靶(= 0.15406 nm), 电压是40 kV, 电流为30 mA, 在2为20~60°内以4 (°)/min的速率进行扫描, 步宽为0.05°。基于XRD结果, 根据球霰石(110)面的衍射强度(110V)和方解石(104)面(104C)的衍射强度, 利用公式(1)[21]对相组成进行半定量分析。

在扫描电子显微镜(SEM, JSM-6390, 日本JEOL公司)上对经过超声分散和喷金处理的样品进行形貌观察, 工作电压为30 kV。
2 结果与讨论
2.1 陈化时间对产物晶相组成和颗粒形貌的影响
图1为醇钙法和醇-水二元溶剂法经不同陈化时间得到的产物的XRD图谱。可以看出, 采用醇钙法得到的产物的XRD图谱中出现了球霰石和方解石的衍射峰, 且球霰石相衍射峰的强度随着陈化时间的延长有所减弱, 如图1(a)~(e)所示。而采用醇-水二元溶剂法得到的产物中球霰石的衍射峰很弱, 并在陈化时间延长至22 h时完全消失, 如图1(f)~(j)。
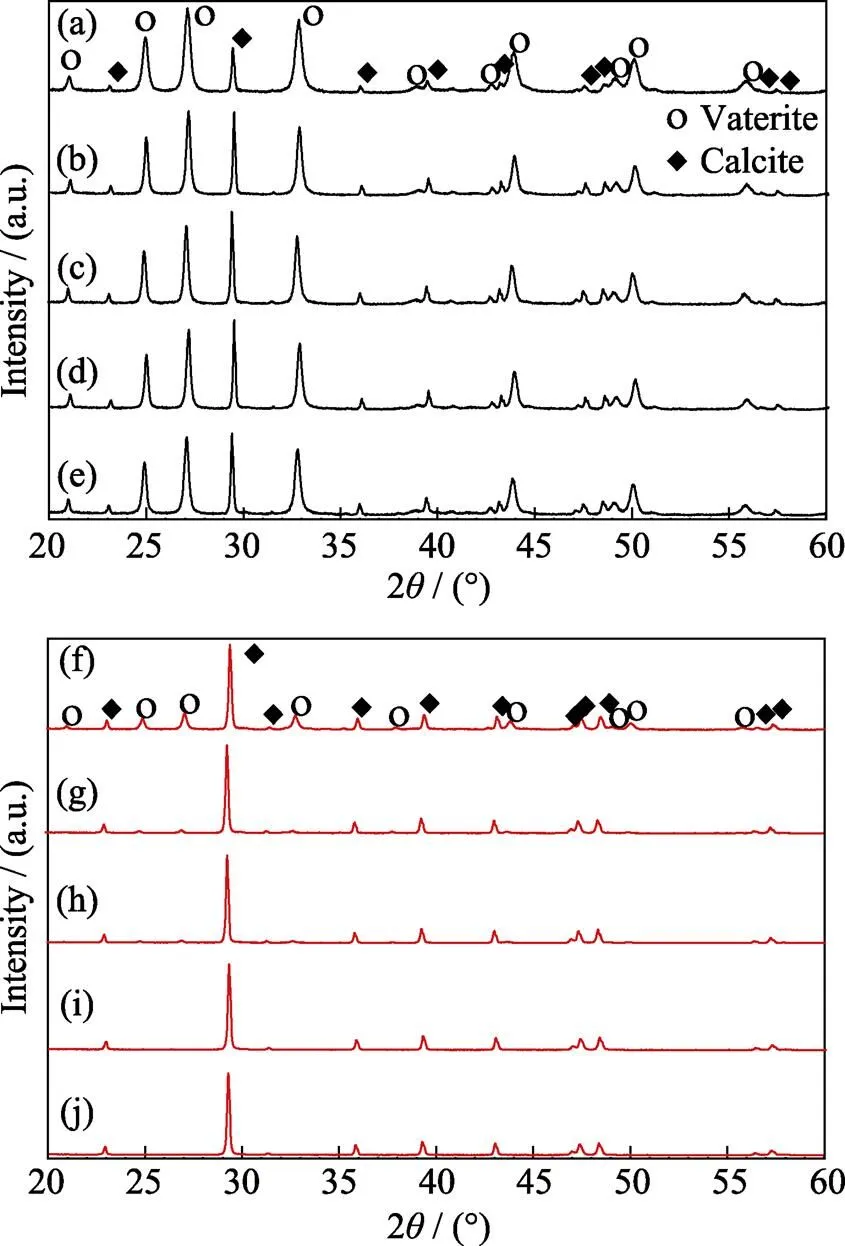
图1 醇钙法(a)~(e)和醇-水二元溶剂法(f)~(j)经不同陈化时间得到产物的XRD图谱
(a, f) 0 min; (b, g) 20 min; (c, h) 90 min; (d, i) 22 h; (e, j) 42 h
由公式(1)计算的物相组成列于表1中。通过横向比较, 相同的陈化时间醇钙法得到的CaCO3中球霰石的含量远高于醇-水二元溶剂法, 这说明醇钙法更有利于亚稳态球霰石的形成。通过纵向比较, 虽然两种方法中球霰石的含量随着陈化时间的延长均降低, 但是醇钙法中球霰石由最初的90.4%降低到42 h的81.4%, 仅有9%的球霰石转变成方解石, 而醇-水二元溶剂法中最初46.5%的球霰石在22 h时就完全转变成方解石, 说明醇钙体系中球霰石向方解石的转变程度远远小于醇-水二元溶剂体系。公开的研究表明[21], 在水介质中, 最初形成的球霰石在很短的时间内会转变成热力学更稳定的文石或方解石。上述结果表明, 虽然乙醇的存在提高了球霰石相的稳定性, 但醇钙法更利于球霰石的形成和稳定。
图2为醇钙法和醇-水二元溶剂法在不同陈化时间产物的SEM微观形貌。醇钙法得到的CaCO3的颗粒形貌受陈化时间影响较小, 以球形的球霰石颗粒为主, 菱方状方解石颗粒随着陈化时间的延长稍有增加, 如图2(a)~(d), 这与XRD的分析结果一致。而陈化时间对醇-水二元溶剂法产物的颗粒形貌有显著的影响。未陈化时, 产物中由大小不同的菱方状颗粒和不规则小颗粒组成团聚体, 如图2(e)及其插图所示。结合XRD分析结果, 菱方状颗粒和不规则的小颗粒分别为方解石和球霰石。由于醇-水二元溶剂体系中的球霰石向方解石转变较快, 故其不再表现为类似于醇钙法中规则的球体。陈化时间延长至20 min时, 出现较多的菱方状小颗粒, 如图2(f), 这说明这些小颗粒是由球霰石转变而来的。随着陈化时间的进一步延长, 菱方状颗粒的尺寸逐渐变得均匀, 说明方解石小颗粒逐渐长大, 如图2(g)~(h)。
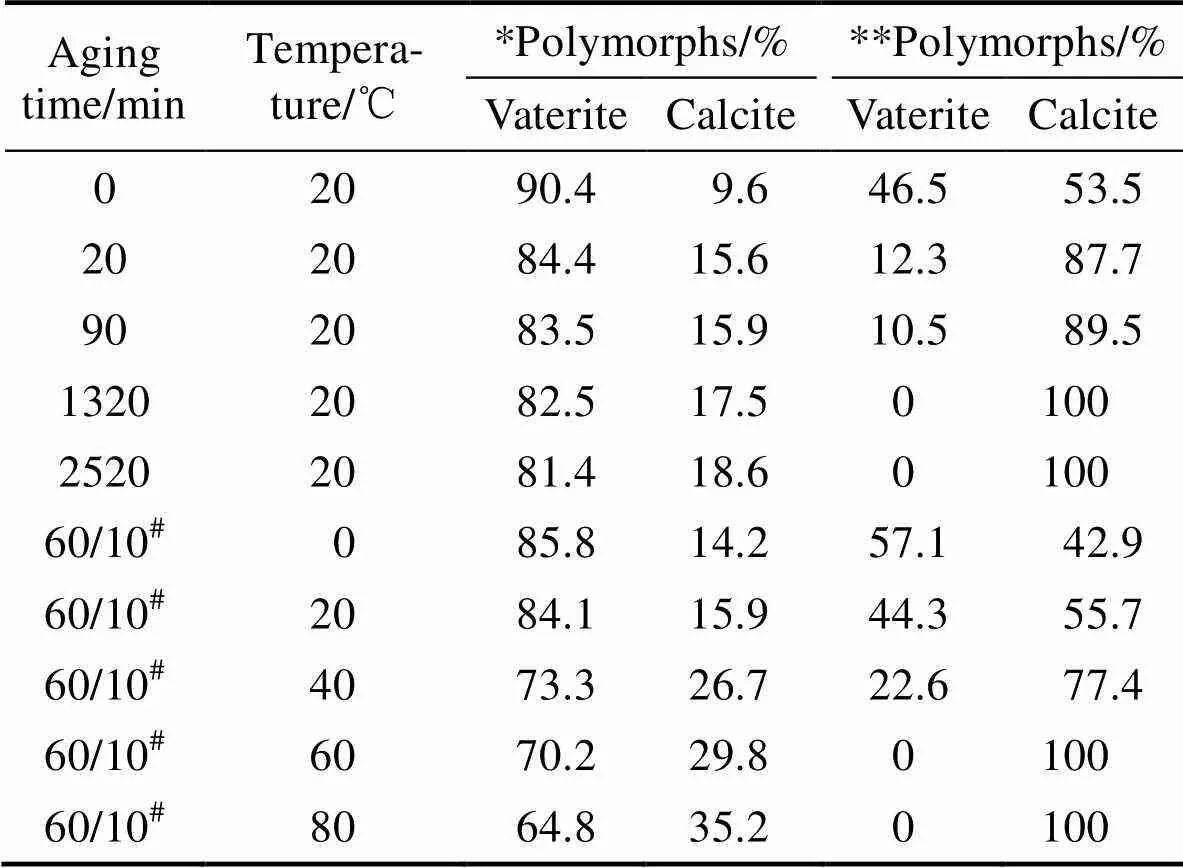
表1 不同条件下得到的产物的物相组成
* CaCO3prepared from ethanol-calcium method; ** CaCO3obtained from ethanol-water binary solvent system.#The aging times are 1 h and 10 min for ethanol-calcium method and EWBS system.

图2 醇钙法(a)~(d)和醇-水二元溶剂法(e)~(h)经不同陈化时间得到产物的SEM照片
(a, e) 0 min; (b, f) 20 min; (c, g) 90 min; (d, h) 42 h
2.2 反应温度对产物晶相组成和颗粒形貌的影响
图3为醇钙法和醇-水二元溶剂法在不同反应温度下产物的XRD图谱, 由公式(1)计算的物相组成列于表1。可以看出, 反应温度对两种方法中球霰石含量的影响均类似于陈化时间, 即随着反应温度的升高, 球霰石相的含量逐渐降低。对于醇钙法, 即使经过较长时间(60 min)的陈化, 球霰石依然为主晶相。而对于醇-水二元溶剂法, 即使较短时间(10 min)的陈化, 当反应温度超过60 ℃时, 球霰石就完全转变成方解石。该结果同样说明醇钙法有利于亚稳态球霰石相的生成和稳定。

图3 醇钙法(a)~(e)和醇-水二元溶剂法(f)~(j)经不同反应温度得到的产物的XRD图谱
(a, f) 0 ℃; (b, g) 20 ℃; (c, h) 40 ℃; (d, i) 60 ℃; (e, j) 80 ℃
温度升高, 粒子的运动加快, 因此通过溶解-扩散-结晶机制的相转变[22]也会有所加快, 这导致了较高温度下球霰石含量的降低。另外, 由于文石在较高温度下比其他相具有更快的生长速率, 因此在较高温度下容易生成文石相[23-24]。但是, 本研究中两种方法在80 ℃均未得到文石, 这是由于体系的共溶剂特性(羟基数目、体系粘度和溶剂的不同极性等)导致球霰石直接转变成方解石[20,25-26]。
两种方法在不同反应温度下产物的SEM微观形貌如图4所示。虽然醇钙法的产物中球霰石和方解石颗粒显示为球形和菱方状, 但随着温度升高至80 ℃, 球形颗粒变得不规则, 菱方状颗粒表面变粗糙甚至出现台阶结构, 如图4(e)所示。对于醇-水二元溶剂法, 反应温度为0 ℃时, 产物中的方解石颗粒或以单个菱方状颗粒存在、或以表面粗糙的不规则块状存在; 而球霰石则以不规则的小颗粒团聚体存在, 如图4 (f)及其插图。当反应温度升高时, 一方面菱方状方解石颗粒逐渐长大并且变得均匀, 这是由于温度升高, 粒子的扩散速度加快, 有利于小颗粒的长大; 另一方面, 产物中依然存在一些形状不规则的小颗粒, 类似于图2(f), 这些颗粒是由球霰石小颗粒转变而来的。
2.3 反应过程
根据公开的报导, 醇-水二元溶剂法制备CaCO3时, 乙醇在浓度低时起助表面活性剂作用, 在浓度高时起共溶剂作用[27]。对于前者, 由‒OH形成的电场对晶核中的离子产生作用, 这会改变球霰石晶核的表面能, 从而使其热力学稳定性优于文石和方解石[7]; 而对于后者, 大量的乙醇分子造成溶剂化Ca2+的去溶剂化, 从而有利于亚稳态球霰石相的结晶[12]。在醇-水二元溶剂法制备CaCO3时, 虽然本工作的醇/水比值(2.5 : 1.0, 与醇钙法完全一致)与公开的文献有所差异, 但产物中球霰石相含量随陈化时间和反应温度的变化趋势大致相同[13,18]。因此醇-水二元溶剂法的反应过程类似于复分解反应, 即CaCl2和Na2CO3的醇水溶液混合, 无定形态CaCO3(ACC)、球霰石和方解石首先成核和结晶, 然后ACC和亚稳态球霰石向稳定的方解石相转变。

图4 醇钙法(a)~(e)和醇-水二元溶剂法(f)~(j)经不同反应温度下得到产物的SEM照片
(a, f) 0 ℃; (b, g) 20 ℃; (c, h) 40 ℃; (d, i) 60 ℃; (e, j) 80 ℃
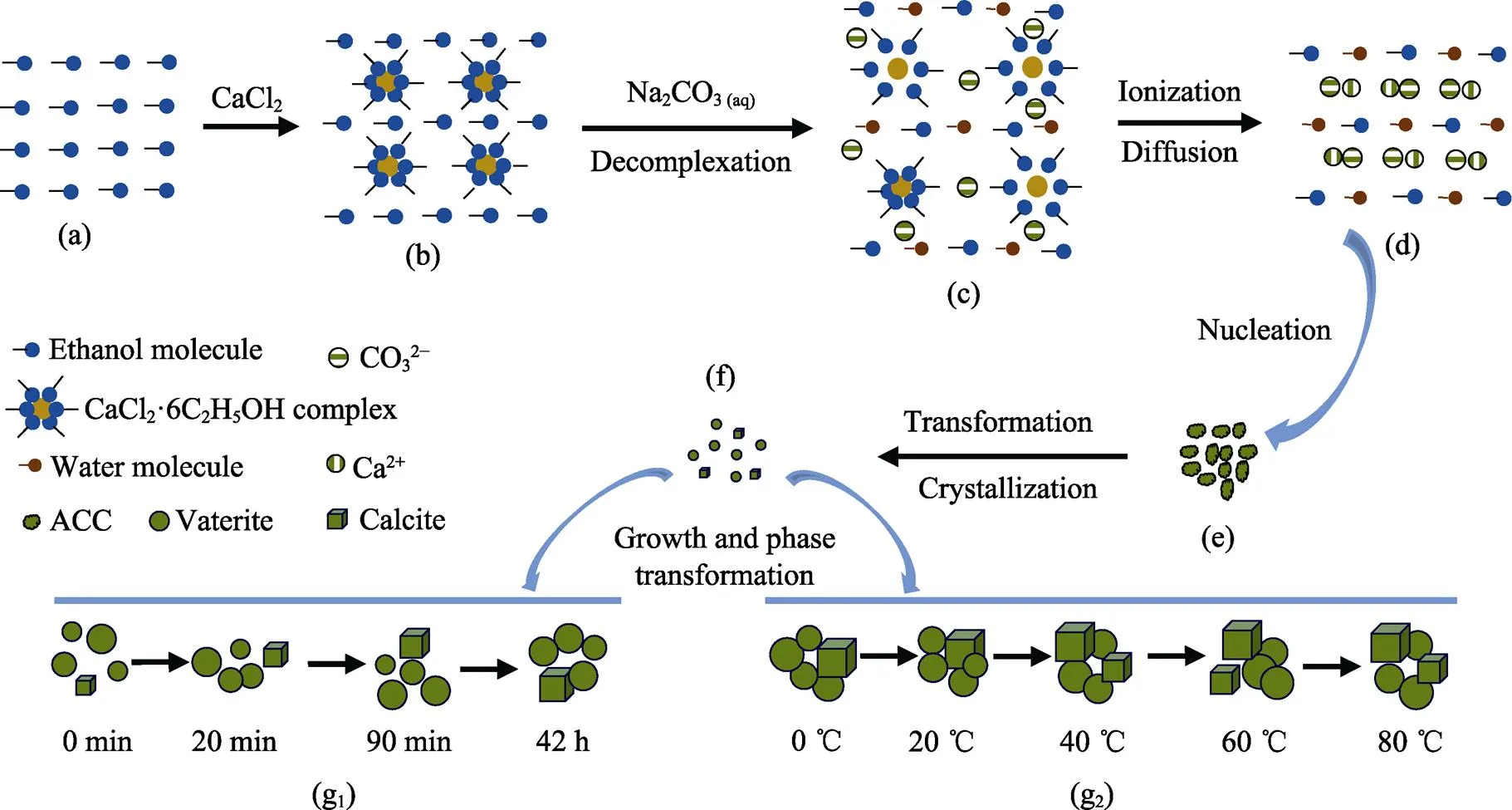
图5 醇钙法反应过程示意图
(a) Homogeneous anhydrous ethanol; (b) Formation of CaCl2·6C2H5OH complex and complex solution; (c) Decomplexation of CaCl2·6C2H5OH complex after the addition of Na2CO3aqueous solution; (d) Ionization of CaCl2in ethanol-aqueous solution and combination of Ca2+and CO32–; (e) Formation of ACC; (f) Transformation of ACC to vaterite and calcite; (g) Growth of vaterite and calcite and phase transformation of vaterite to calcite at different aging time (g1) and different temperatures (g2)
与传统的醇-水二元溶剂法有所不同, 醇钙法采用了CaCl2的乙醇溶液作为反应溶液, 而根据前述结果, 醇钙法对亚稳态球霰石相的合成具有特殊的优势, 因此其反应过程与醇-水二元溶剂法有很大区别。图5为醇钙法制备CaCO3的反应过程示意图。当CaCl2固体粉末加入到无水乙醇中时, 两者发生络合作用形成络合物(CaCl2×(C2H5OH),=4或6), 如图5(b)所示。众所周知, CaCO3形成是Ca2+和CO32–离子结合的结果(图5(d))。根据实验中加入Na2CO3水溶液立即有沉淀生成的现象可以推断, Na2CO3水溶液的加入造成了络合物的解络以及随后CaCl2在水中的解离, 如图5(c)所示。因此, 可以认为醇钙法制备CaCO3包括以下三个主要反应:
C2H5OH+CaCl2→CaCl2×(C2H5OH) (2)
CaCl2×(C2H5OH)+H2O→
C2H5OH+H2O+Ca2++2Cl–(3)
Ca2++CO32–→CaCO3(4)
CaCl2固体粉末与无水乙醇的络合(反应方程(2))发生于两种溶液的混合之前, 因此, 在CaCl2完全溶解的前提下, 络合反应对后续的沉淀生成没有直接的影响。反应方程(4)是CaCO3沉淀生成的关键步骤, 其中Ca2+和CO32–浓度是影响产物性质的主要因素。反应方程(3)不仅为反应方程(4)提供Ca2+, 而且还为反应提供介质, 因此该步骤是醇钙法与传统醇-水二元溶剂法最本质的区别。更确切地说, 当Na2CO3水溶液加入到CaCl2醇溶液时, 络合物的水解并不是瞬时完成的, 如图5(c)所示, 这造成了CaCl2在水中溶解和解离的延迟, 导致反应体系中Ca2+浓度的降低(相对于复分解反应或者传统醇-水二元溶剂体系)。另外, Ca2+由于较小的半径和较大的电荷密度容易被乙醇和水溶剂化, 而半径较大的CO32–不易被乙醇溶剂化[12,28], 这些都造成了反应体系中CO32–浓度远高于Ca2+浓度, 而这有利于亚稳相球霰石的形成[29]。根据Wei等[22]的研究, 在CaCO3沉淀形成过程中, ACC首先成核, 随后以不同的结构结晶, 或者先结晶成稳定性最差的无水晶型(球霰石), 然后再转变成更加稳定的文石或方解石。本工作中, 随着陈化时间的延长和反应温度的升高, 生成的球霰石在乙醇的存在下部分转变成方解石, 如图5(g)所示。
3 结论
采用醇钙法制备了亚稳态球霰石相CaCO3, 并与相同条件下采用传统醇-水二元溶剂法制备的CaCO3进行了对比。虽然两种方法制备的CaCO3中球霰石相的含量均随陈化时间的延长和反应温度的升高而降低, 但是醇钙法产物中以球霰石为主晶相, 其含量可达90%以上, 而采用醇-水二元溶剂法制备的产物中球霰石相的含量较醇钙法低得多, 并于20 ℃时陈化22 h以及60 ℃时陈化10 min就完全转变成方解石。一方面, 醇钙法中络合物的解络造成了反应体系中Ca2+与CO32–浓度比值的降低, 从而有利于亚稳态球霰石的形成, 这也是醇钙法与传统醇-水二元溶剂法最显著的区别; 另一方面, 羟基的存在降低了球霰石的表面能, 增强了稳定性。
[1] TRUSHINA D B, BUKREEVA T V, KOVALCHUK M V,. CaCO3vaterite microparticles for biomedical and personal care applications., 2014, 45(1): 644-658.
[2] NAKAMURA J, POOLOGASUNDARAMPILLAI G, JONES J R,. Tracking the formation of vaterite particles containing aminopropyl-functionalized silsesquioxane and their structure for bone regenerative medicine., 2013, 1(35): 4446-4454.
[3] QIU N, YIN H, JI B,. Calcium carbonate microspheres as carriers for the anticancer drug camptothecin., 2012, 32(8): 2634-2640.
[4] SHA F, ZHU N, BAI Y J,. Controllable synthesis of various CaCO3morphologies based on a CCUS idea., 2016, 4(6): 3032-3044.
[5] ZOU J P, YANG H Z, XIAO P,. Controllable fabrication of calcium carbonate hollow microspheres with micro-nano hierarchical structure., 2016, 31(7): 711-718.
[6] JIANG J Z, MA YX, ZHANG T,. Morphology and size control of calcium carbonate crystallized in a reverse micelle system with switchable surfactants., 2015, 5(98): 80216-80219.
[7] LI Q, DING Y, LI F Q,. Solvothermal growth of vaterite in the presence of ethylene glycol, 1,2-propanediol and glycerin., 2002, 236(1/2/3): 357-362.
[8] BEUVIER T, CALVIGNAC B, DELCROIX G J R,. Synthesis of hollow vaterite CaCO3microspheres in supercritical carbon dioxide medium., 2011, 21(26): 9757-9761.
[9] GUO Y M, WANG F F, ZHANG J,. Biomimetic synthesis of calcium carbonate with different morphologies under the direction of different amino acids., 2013, 39(6): 2407-2415.
[10] JIANG J X, CHEN C J, XIAO B W,. Hierarchical CaCO3particles self-assembled from metastable vaterite and stable calcite during the decomposition of Ca(HCO3)2., 2017, 19(48): 7332-7338.
[11] LI Y S, LIU H R, XIA L L,. Fabrication and characterization of porous carbonate ceramic scaffolds., 2014, 42(7): 851-856.
[12] ZHANG L, YUE L H, WANG F,. Divisive effect of alcohol- water mixed solvents on growth morphology of calcium carbonate crystals., 2008, 112(34): 10668-10674.
[13] LIU L, JIANG J, YU S H. Polymorph selection and structure evolution of CaCO3mesocrystals under control of poly (sodium 4-styrenesulfonate): synergetic effect of temperature and mixed solvent., 2014, 14(11): 6048-6056.
[14] HU Y, ZHOU Y, XU X,. Phase-controlled crystallization of amorphous calcium carbonate in ethanol-water binary solvents., 2015, 50(4): 312-318.
[15] WANG A X, CHU D Q, WANG L M,. Preparation and characterization of novel spica-like hierarchical vaterite calcium carbonate and a hydrophilic poly (vinylidene fluoride)/calcium carbonate composite membrane., 2014, 16(24): 5198-5205.
[16] MAO B G, CHU D Q, WANG A X,. Fabrication of flowerlike vaterite calcium carbonate crystal aggregates by self-assembly in water/ethanol mixtures., 2013(35): 5958-5963.
[17] KOGA N, YAMANE Y, KIMURA T. Thermally induced transformations of calcium carbonate polymorphs precipitated selectively in ethanol/water solutions., 2011, 512(1): 13-21.
[18] SAND K K, RODRIGUEZ-BLANCO J D, MAKOVICKY E,. Crystallization of CaCO3in water-alcohol mixtures: spherulitic growth, polymorph stabilization, and morphology change., 2011, 12(2): 842-853.
[19] JIN D, WANG F, YUE L. Phase and morphology evolution of vaterite crystals in water/ethanol binary solvent., 2011, 46(2): 140-144.
[20] CHEN S F, YU S H, JIANG J,. Polymorph discrimination of CaCO3mineral in an ethanol/water solution: formation of complex vaterite superstructures and aragonite rods., 2006, 18(1): 115-122.
[21] KONTOYANNIS C G, VAGENAS N V. Calcium carbonate phase analysis using XRD and FT-Raman spectroscopy., 2000, 125(2): 251-255.
[22] WEI H, SHEN Q, ZHAO Y,. Influence of polyvinylpyrrolidone on the precipitation of calcium carbonate and on the transformation of vaterite to calcite., 2003, 250(3): 516-524.
[23] FLATEN E M, SEIERSTEN M, ANDREASSEN J P,. Polymorphism and morphology of calcium carbonate precipitated in mixed solvents of ethylene glycol and water., 2009, 311(13): 3533-3538.
[24] CHEN J, XIANG L. Controllable synthesis of calcium carbonate polymorphs at different temperatures., 2009, 189(1): 64-69.
[25] JIANG J, CHEN S F, LIU L,. Template-free polymorph discrimination and synthesis of calcium carbonate minerals., 2009(39): 5853-5855.
[26] XIE A J, SHEN Y H, ZHANG C Y,. Crystal growth of calcium carbonate with various morphologies in different amino acid systems., 2005, 285(3): 436-443.
[27] GENG X, LIU L, JIANG J,. Crystallization of CaCO3mesocrystals and complex aggregates in a mixed solvent media using polystyrene sulfonate as a crystal growth modifier., 2010, 10(8): 3448-3453.
[28] HAWLICKA E, SWIATLA-WOJCIK D. MD simulation studies of selective solvation in methanol-water mixtures: an effect of the charge density of a solute., 2002, 106(7): 1336-1345.
[29] HAN Y S, HADIKO G, FUJI M,. Factors affecting the phase and morphology of CaCO3prepared by a bubbling method., 2006, 26(4): 843-847.
Synthesis of Metastable Vaterite Phase of CaCO3Ethanol-calcium Method and Ethanol-water Binary Solvent Method
CHEN Chuan-Jie1, WEI Li-Geng1, WU Yue1, HU Cheng-Pei1, HU Yuan-Cong1, JIANG Jiu-Xin1,2,3
(1. Hubei Provincial Key Laboratory of Green Materials for Light Industry, Hubei University of Technology, Wuhan 430068, China; 2. Collaborative Innovation Center of Green Light-weight Materials and Processing, Hubei University of Technology, Wuhan 430068, China; 3. School of Material and Chemistry Engineering, Hubei University of Technology, Wuhan 430068, China)
Ethanol-calcium method was proposed, and the metastable vaterite phase of CaCO3was synthesized by this method,. the complex compound between CaCl2and ethanol reacted with Na2CO3aqueous solution. Effects of aging time and reaction temperature on the polymorphs and morphologies of CaCO3were investigated, and the comparative study on the synthesis of CaCO3ethanol-water binary solvent (EWBS) method at the same conditions was carried out. XRD results indicate that the fraction of vaterite in the product decreases with the aging time prolonging and reaction temperature increasing in both systems. However, the fraction of vaterite in the product prepared by ethanol-calcium method is much higher than that in the product prepared by EWBS method, and the stability of vaterite prepared by ethanol-calcium method is also much better. SEM observation shows that the morphologies of vaterite and calcite are their typical sphere and rhombohedra, respectively.
vaterite; calcium carbonate; ethanol-calcium; aging time; reaction temperature
TQ174
A
1000-324X(2019)07-0755-06
10.15541/jim20180472
2018-10-10;
2018-12-03
国家自然科学基金(51402097); 绿色轻质材料与加工湖北工业大学协同创新中心开放基金(201806B06); 湖北省大学生创新创业训练计划项目(201810500098) National Natural Science Foundation of China (51402097); Open Foundation of Collaborative Innovation Center of Green Light-weight Materials and Processing, Hubei Provincial Key Laboratory of Green Materials for Light Industry (201806B06); Training Program of Innovation and Entrepreneurship for Undergraduates (201810500098)
陈传杰(1994‒), 男, 硕士研究生. E-mail: chenchuanjie0808@hotmail.com
蒋久信, 副教授. E-mail: jiuxinjiang@hotmail.com