硒处理对薄壳山核桃幼苗生长的影响
2019-08-17胡旭雅李财运倪钟涛舒李露王正加
胡旭雅 李财运 倪钟涛 曾 皓 李 阳 舒李露 王正加
(浙江农林大学亚热带森林培育国家重点实验室培育基地,浙江杭州 311300)
薄壳山核桃(Carya illinoensis) 为胡桃科(Juglandaceae)山核桃属(Carya Nutt.),是重要的木本油料和珍贵的干果树种[1],也是重要的用材树种和绿化树种[2],引入我国已有百年的历史[3],主要分布在湖南、江西、浙江、云南和秦淮以南、长江以北部分地区[4]。
硒(Se)作为微量元素,是人体的食物抗氧化剂[5-6],对维持身体健康有重要作用[7]。同时,硒是植物生长发育的有益元素[8],适当浓度下硒对植物的生理过程具有重要作用[9],不仅能够影响植物的生长发育,参与调控光合和呼吸作用,抵御植物体内的自由基伤害,还可以提高植物抗逆能力[10-13]。研究表明,农作物施硒肥,可防治牛、羊白肌病,但高浓度硒对人畜和一般植物有毒害作用[14]。天然有机硒的生物活性较无机硒高,毒性较无机硒小[15],且硒对某些重金属具有拮抗作用,在一定程度上能够缓解重金属对植物的毒害[16]。薛泰麟等[17]以禾本科的小麦和玉米、豆科的大豆和十字花科的油菜为研究对象,发现硒在高等植物中具有抗氧化作用;刘树梅等[18]研究表明,叶面喷施亚硒酸钠能提高梨、杏、桃和苹果果实的可溶性固形物含量。但施硒对薄壳山核桃幼苗生长影响的研究尚鲜见报道。为此,本试验采用不同硒浓度处理薄壳山核桃幼苗,研究硒对薄壳山核桃幼苗生长的影响,以期为硒对薄壳山核桃生长发育方面的研究,以及硒在食品生产等领域的应用提供理论依据。
1 材料与方法
1.1 试验地概况及试验材料
试验于浙江省杭州市临安区浙江农林大学森林培育学科温室(30°15′14″N,119°43′39″E) 进行。
试验材料为一年生长势相似、健康的薄壳山核桃实生苗,选自浙江农林大学山核桃苗圃。
1.2 植物培养与试验处理
采用营养液水培育苗方法,试验前缓苗15 d。霍格兰营养液配置方法见表1。试验容器中用气泵保持24 h 通气,营养液每7 d 更换一次。设置7 个硒处理浓度,即0(对照,记作CK)、0.5(记作Se1)、5(记作Se2)、10(记作Se3)、20(记作Se4)、40(记作Se5)和80 μmol·L-1(记作Se6),每个处理3 次重复,每个重复3 株幼苗。不同Na2SeO3处理中,仅改变Na2SeO3浓度调配,其他各种营养元素浓度完全相同。连续处理35 d 后收获。

表1 霍格兰营养液配方Table 1 Hoagland nutrient solution formula
1.3 测定指标与方法
1.3.1 质量指标的测定 将实生幼苗按照根、茎和叶3 个部位分离,采用分析天平依次准确称量根重(g)、茎重(g)和叶重(g)。按照公式计算根冠比:
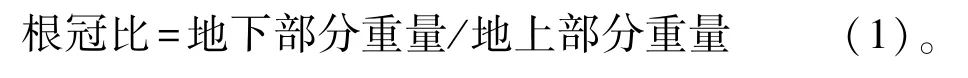
1.3.2 金属元素的测定 将植物样品在105℃下杀青20 min,80℃烘干,称量其干重,用研钵研碎后过60目筛。准确称取0.200 g 植物样品于消煮管中,加入5 mL HNO3摇匀并放置12 h 后,放入AIM600 微波消解仪(吉林和龙公司)缓慢消煮,再进行赶酸。赶酸结束后将消煮液放入50 mL 容量瓶中定容摇匀,吸取3 ~5 mL 消煮液,利用IEC3300 原子吸收光谱仪(美国热电公司)测定金属元素Zn、Mn、K、Mg 浓度[19-20]。
1.3.3 生理生化指标的测定 丙二醛(malondialdehyde, MDA)含量的测定采用双组分光光度法[21], 以nmol·g-1FW 表示;超氧化物歧化酶(superoxide dismutase,SOD)活性测定采用硝基四氮唑蓝(nitroblue tetrazolium,NBT)光还原法[17];过氧化物酶(peroxidase,POD)活性测定采用愈创木酚显色法[18]。
叶片光合参数的测定:选取长势一致的完全展开叶,于2017年7月天气晴朗的上午,利用LI-6400 便携式光合作用测定系统(美国LI-COR 公司) 测定光合参数[净光合速率(net photosynthetic rate,Pn)、气孔导度(stomatal conductance, Gs)、胞间 CO2浓度( intercellular CO2concentration, Ci)、蒸腾速率(transpiration rate,Tr)]。采用红蓝光源叶室进行测定,每次测定重复3 次,所有测定气体流量均为500 μmol·s-1,光响应曲线于2 000、1 500、1 000、600、300、200、100、80、50、20、0 μmol·m-2s-111 个光照强度下进行活体测定。
叶绿素荧光参数测定,参照L′hirondelle 等[22]的方法:于2017年7月13日天气晴朗的上午,采用PAM-2100 便携式调制叶绿素荧光仪(德国Walz 公司) 对薄壳山核桃幼苗叶片进行活体测定。叶片经30 min 暗适应后测得初始荧光(original fluorescence,Fo)和最大荧光(maximal fluorescence,Fm),在光适应状态下测得实际荧光产量(actual fluorescence intensity yield, F′o)、稳态荧光产量(fluorescence in stable state,Fs)和最大荧光产量(maximal fluorescence yield, F′m)等荧光参数。根据所测定参数按照公式分别计算原初光能转换效率(efficiency of primary conversion of light energy,Fv/Fo)、实际光化学效率(actual photochemical efficiency, ΦPS Ⅱ)、非光化学猝灭系数( nonphotochemical quenching coefficient,NPQ):
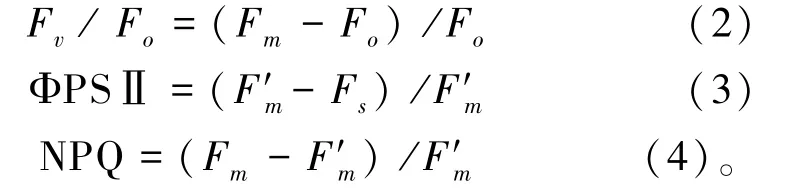
测量时,尽量使叶片均匀夹于叶夹内,并保持探头方向、角度一致,以保证均无遮荫且叶片受光方向相同。相对叶绿素含量采用PAM2100 便携式叶绿素荧光仪(德国COUNTRYOFOPIGINWALZ 公司) 进行测定(测量时要避开叶脉)[23-25]。
1.4 数据处理
采用Microsoft Excel 2016 统计、分析试验数据;GraphPad Prism 7 软件制图;SPSS 25 软件分析数据方差、显著性和相关性,其中显著性差异运用Duncan′s新复极差法进行多重比较(P<0.05)。所有试验数据均以均值±标准误差(M±SE)表示。
2 结果与分析
2.1 幼苗生长效应
由图1 可知,硒处理对薄壳山核桃幼苗生长有较大的影响。CK~Se3 处理下,幼苗根系发育较好,主根较为发达,须根较多,叶子较多且有活力。Se5 ~Se6 处理下,幼苗受硒胁迫,根系发育受阻,主根小而短,须根较少,叶子较少且出现干枯。
由表2 可知,随着硒浓度的增加,地上部分(茎、叶)重量和生物量均呈先增加后下降再增加再下降的波动变化,而地下部分(根系)重量无显著差异。Se1处理的生物量最高,较CK 增加11.03%,而Se6 处理下生物量最低,较CK 显著下降23.85%。硒处理对根长有显著影响,其中Se4 处理下根长最长(53.67 cm),较CK 显著增加25.49%,而Se6 处理最小,较CK 显著下降59.48%。与CK 相比,各处理地上部分长度均无显著差异。随着硒浓度的增加,根冠比无明显的变化规律,其中以Se4 处理下的根冠比最大,为0.94。

图1 硒处理对薄壳山核桃幼苗生长情况Fig.1 Growth of pecan seedlings treated with selenium
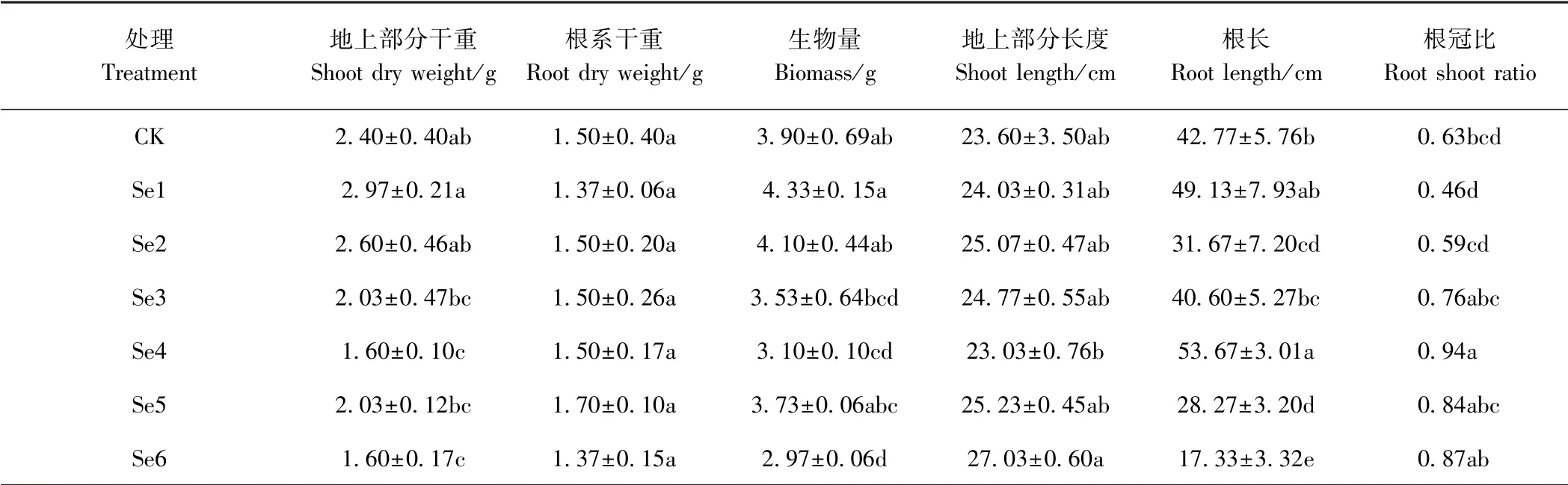
表2 硒处理对薄壳山核桃地上和地下部分生长的影响Table 2 Effect of selenium treatments on the growth of ground and underground parts of pecan
2.2 硒处理对幼苗各器官元素含量的影响
由图2 可知,根、叶中硒含量随着硒浓度的增加均呈先增加后减少的趋势。当硒浓度大于0.5 μmol·L-1时,根、叶中硒含量与CK 差异显著。Se5 处理下,根、叶中硒含量均达到最大,分别为547、157 mg·kg-1,且与CK 间差异显著。
由表3 可知,不同硒浓度处理下,根、茎、叶中各元素含量均受到不同程度的影响。其中,根中Mn2+含量随着硒浓度的增加呈先增加后减少的趋势,叶中Mn2+含量在Se6 处理时最低,而茎中Mn2+含量则在Se6 处理时最高,是CK 的9.29 倍。Zn2+含量在根中呈先减少后增加再减少的趋势,其中在Se3 处理时达到最高,较CK 显著提高了71.76%,叶中Zn2+含量变化趋势与根中相反,呈先增加后减少再增加的趋势,茎中的Zn2+含量除Se1 处理外,其他处理均显著高于CK。根中Mg2+含量随着硒浓度的增加呈先增加后减少的趋势,茎中Mg2+含量则无明显变化规律,但各硒处理与CK间均差异显著,叶中Mg2+含量呈下降趋势。根中K+含量随着硒浓度的增加呈先减少后增加再减少的趋势,茎中硒处理下的K+含量与CK 间均无显著差异。结果表明,低硒浓度(≤10 μmol·L-1)处理可以提高根中Mn2+、Mg2+含量和叶中Zn2+含量;高硒浓度会促进根中Zn2+含量和茎中Mn2+含量的积累。
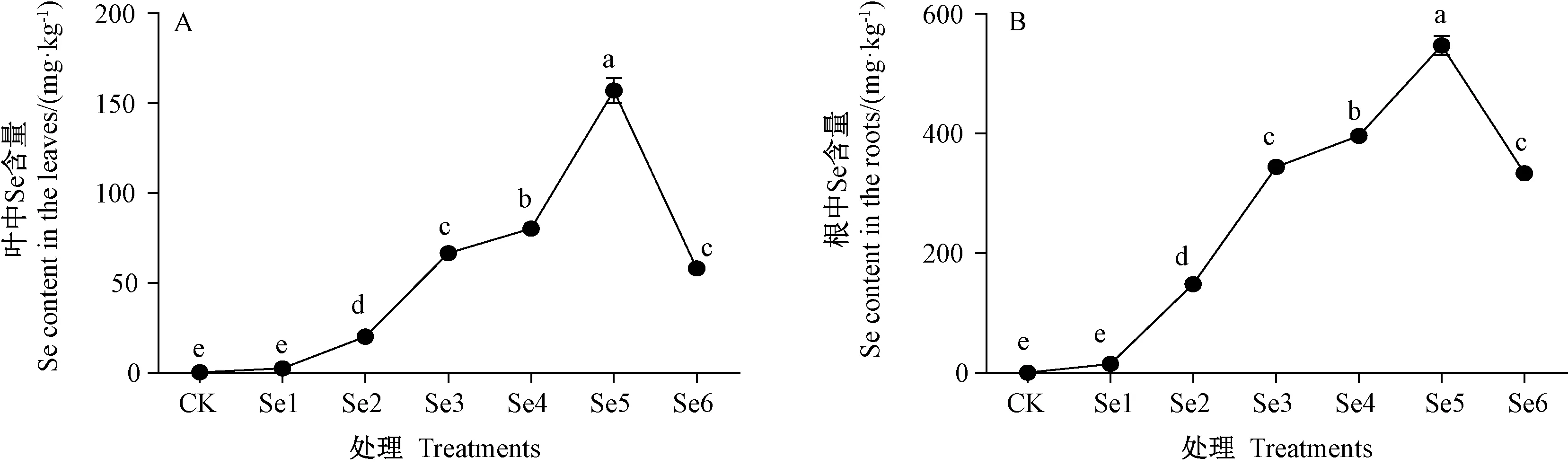
图2 硒处理对薄壳山核桃幼苗Se 含量的影响Fig.2 Effect of selenium treatments on content of Se in pecan seedlings
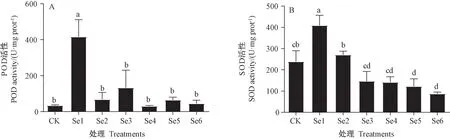
图3 硒处理对薄壳山核桃幼苗酶活性的影响Fig.3 Effect of selenium treatments on the enzyme activities of pecan seedlings
2.3 硒处理对幼苗酶活性的影响
由图3 可知,POD 活性在Se1 处理时达到最高,较CK 显著增加11.27%;SOD 活性在Se1 处理时达到最高,但随后呈下降趋势。结果表明,适量施硒能够增强植物抗氧化能力。
2.4 硒处理对幼苗MDA 含量的影响
由图4 可知,随着硒浓度的增加,MDA 含量呈先下降后上升再下降的趋势,在Se3 处理时达到最高,随后下降趋于平稳,但不同处理间的MDA 含量无显著差异。结果表明,硒处理对MDA 含量作用不明显。
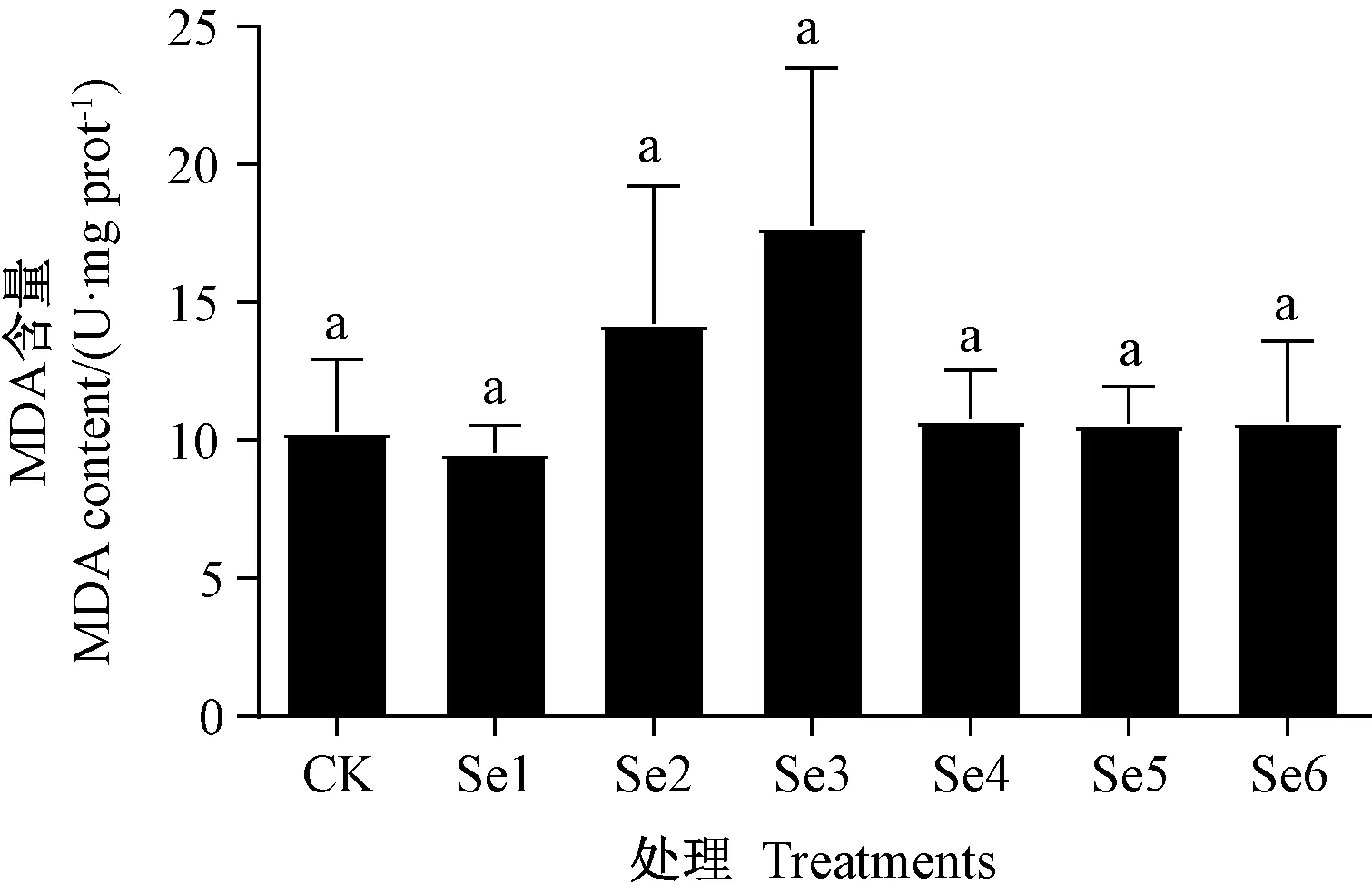
图4 硒处理对薄壳山核桃幼苗MDA 含量的影响Fig.4 Effect of selenium treatments on MDA content of pecan seedlings
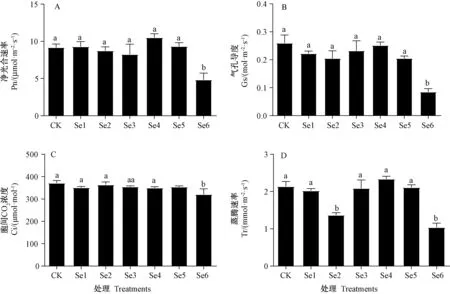
图5 氮钾对薄壳山核桃幼苗光合气体交换参数的影响Fig.5 Effects of nitrogen and potassium on photosynthetic gas exchange parameters of pecan seedlings
2.5 硒处理对幼苗生理特性的影响
由图5 可知,随着硒浓度的增加,Pn、Gs 和Tr 均呈先下降后上升再下降的趋势。Se6 处理下植株的Pn、Gs、Ci 均显著低于其他处理,但其他处理间无显著差异。Se2、Se6 处理下的Tr 显著低于其他处理,且其他处理间无显著差异。
由图6 可知,比较7、8月份叶片荧光特性,发现不同处理下,同一月份的Fv/Fo、Fv/Fm、qP、ETR、qN 值均无显著差异。同一硒浓度处理下,7、8月份的Fv/Fo和Fv/Fm值间无显著性差异。同一硒浓度处理下,随着时间的推移,qP 和ETR 值均有所下降,而qN 则相反,8月幼苗的qN 值大于7月。
由表4 可知,叶片硒浓度与生物量、Gs、Ci 均呈负相关,相关系数分别为-0.296、-0.143、-0.202;生物量与Pn、Gs、Ci、Tr 均呈正相关;Pn 与Gs、Tr 均呈极显著正相关;Gs 与Ci、Tr 均呈极显著正相关;Ci 与Tr 呈显著正相关。
3 讨论
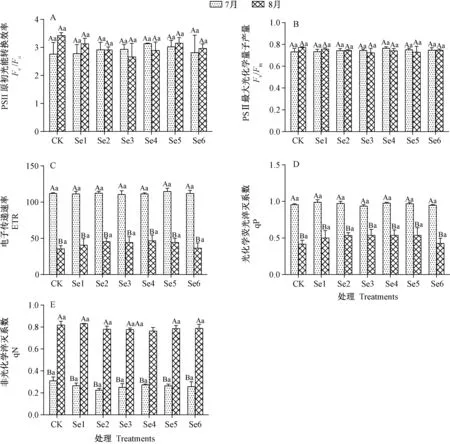
图6 硒处理对薄壳山核桃幼苗叶片叶绿素荧光参数的影响Fig.6 Effect of selenium treatments on chlorophyll fluorescence parameters of leaves of pecan seedlings
本研究中,当硒浓度≤40 μmol·L-1时,薄壳山核桃幼苗的硒含量随着硒浓度的增加而增加,且根内的硒含量大于叶片,但硒浓度>40 μmol·L-1时,幼苗的硒含量则随着硒浓度的增加而下降。这与李登超等[26]研究发现施硒有利于小白菜体内硒含量的积累的研究结论相符。说明薄壳山核桃幼苗具有一定积累硒的能力,且幼苗地下部分中的硒含量高于地上部分。这可能是由于大量微生物聚集在植物的根部,增强了根部对各物质的吸收能力(植物的根际效应),因此通常根部硒的含量较高[27]。本研究发现施硒影响了幼苗对矿质营养物质的吸收,硒对叶中的Mn2+、Mg2+和根中的K+有一定的拮抗作用,但对茎中Zn2+积累有一定的促进作用。低硒(≤10 μmol·L-1)处理促进了根中Mn2+、Mg2+含量和叶中的Zn2+含量的积累,当硒浓度≥10 μmol·L-1时,促进了根中Zn2+含量和茎中Mn2+含量的积累。这与前人发现低浓度硒对小白菜N、P、K、S、Mg、Zn 吸收有促进作用,而高浓度硒抑制其吸收的结论一致[28]。在高浓度环境下,硒会降低植物对营养元素的吸收,但是在生理浓度范围内,硒总体上可促进植物对P、K、Ca、Mg、S、Fe、Mn、Cu、Zn 和Mo 的吸收。由此可见,施硒能改变植物内的元素组成,影响程度因植物种类、品种、部位不同而异。
植物受到环境胁迫时,会引起机体产生活性氧成分,以此作为信号刺激产生大量抗氧化物质,而硒能够直接或间接地调控植物体内抗氧化物质的形成[29]。本研究发现低硒(0.5 μmol·L-1)处理下,幼苗的POD、SOD 活性均最高, 分别较 CK 提高了12.06%、78.73%,这与张明中[30]的研究结果相同。说明适量施硒能够增强薄壳山核桃幼苗的抗氧化能力。在硒浓度≤40 μmol·L-1时,幼苗的Pn、Gs、Ci 无显著差异,这与硒能影响植物叶绿素的合成代谢、调节光合作用和呼吸作用的结论不符[29]。但当硒浓度为80 μmol·L-1时,Pn、Gs、Ci 和Tr 均较对照显著下降,这与尚庆茂等[31]的研究结论一致。付冬冬等[28]也发现高浓度硒(Se≥2.5 mg·L-1)抑制了小白菜的生长,降低了其产量;前人亦研究发现高浓度硒(1.0 mg·L-1)抑制菠菜生长[32]。说明低浓度硒对薄壳上核桃幼苗光合作用影响不大,高浓度硒会抑制其光合作用。

表4 叶片硒浓度、生物量与光合各参数间相关性分析Table 4 Correlation analysis of leaf Se concentration, biomass and photosynthetic parameters
4 结论
本研究结果表明,薄壳山核桃幼苗对硒的需求有一定的限度,适宜的硒浓度对薄壳山核桃幼苗的生长有促进作用,过高浓度的硒会产生抑制作用。幼苗的生理指标、元素浓度、酶活和光合作用分析结果表明,较低的硒浓度能促进其生长。综上,0.5 μmol·L-1浓度是最适宜薄壳山核桃幼苗的浓度。此外,硒与幼苗内的P、K、Mn、Mg 含量之间存在负相关关系。因此,建议在薄壳山核桃幼苗生长过程中,对幼苗喷施或土施低浓度硒时,还应注意增施K 肥,适量补充Mn、Mg等微量化肥,以促进薄壳山核幼苗的生长,并提高幼苗的品质。
